小麦酯酶电化学生物传感器构建及其对敌敌畏的检测
2022-02-16田运霞吴远根
刘 丰,田运霞,吴远根,陶 菡
(贵州大学酿酒与食品工程学院,发酵工程与生物制药省重点实验室,贵州 贵阳 550025)
目前,食品中农药残留超标的问题非常普遍和严重,尤其以粮食、果蔬等农产品为主,由此带来的食品安全问题是公共健康面临的最主要威胁之一[1-2]。因此,农残的监控和检测成为各国政府和民众强烈关注的问题。
农药检测当前基本依赖于大型仪器分析技术,如色谱、色谱-质谱联用、光谱等[3-5],以上方法检测通量大、灵敏度高,但仪器昂贵、操作复杂、携带不方便,而且需要比较复杂的前处理过程,检测时间较长,所以应该开发出快速、准确且低成本的检测方法。相比而言,电化学传感技术不仅具有灵敏度高、操作简便快速、成本低等优点[6-7],而且可以开发成便携式检测仪实现田间或农贸市场的实时检测[8-9]。因此,电化学农残检测技术近年来受到了广泛关注[10-11]。
基于农药对酶生物活性的抑制可以实现农药的快速检测[12]。目前用于农药检测的酶主要是乙酰胆碱酯酶(EC 3.1.1.7),其来源于动物,提取工艺繁琐,原材料珍贵,成本高[13]。近年来研究发现来源于植物的酯酶(EC 3.1.1.X)具有与乙酰胆碱酯酶相似的作用机理,其酶活也可以被农药所抑制且其对农药的敏感性不逊于胆碱酯酶[14-15]。此外,植物酯酶存在于各种农作物中,来源十分丰富,提取方法简单,价格也更加低廉[16],且对酶的保存条件不像胆碱酯酶那样苛刻。因此采用植物酯酶代替乙酰胆碱酯酶测定农药残留将会是一种更经济实用的方法,具有良好的开发应用价值。
基于此,本研究以小麦酯酶(plant-esterase from wheat flour,wPLaE)为酶源,构建基于酶抑制作用的电化学农药检测技术。同时,借助多壁碳纳米管(multiwalled carbon nanotubes,MWNT)和纳米金(gold nanoparticles,AuNPs)的协同电催化效应增敏传感信号,实现了有机磷农药敌敌畏的准确、低成本检测。目前鲜见基于wPLaE结合AuNPs/MWNT纳米材料用于农药检测的相关研究报道。本实验拟构建可用于有机磷农药检测的新型电化学酶传感器NF/wPLaE-CS/AuNPs/MWNT/GCE,以期为植物酯酶在电化学传感领域的应用提供新思路。
1 材料与方法
1.1 材料与试剂
小麦、大米、生菜购于当地农贸市场。
壳聚糖(chitosan,CS)、PEG 1000、硫酸铵、磷酸二氢钠、磷酸氢二钠、浓硫酸、硝酸、柠檬酸钠、HAuCl4、乙醇、柠檬酸、葡萄糖(均为分析纯)和Nafion 117溶液 上海阿拉丁试剂有限公司;敌敌畏标准品、溴氰菊酯标准品、多菌灵标准品、林丹标准品、1-乙酸萘酯(1-naphthyl acetate,1-NA)(分析纯) 美国Sigma-Aldrich公司;Al2O3打磨粉 上海辰华有限公司;MWNT 先丰纳米有限公司;实验用水均为超纯水。
1.2 仪器与设备
CHI660E电化学工作站 上海辰华仪器有限公司;A-10超纯水仪 美国Milipore公司;SB-5200 DTD超声清洗机 宁波新芝生物科技股份有限公司;S-3400N扫描电镜 日本日立公司;3K18离心机 德国Sigma公司;BSA124S-CW电子天平(可读精度0.000 1 g)德国Sartorius公司。
1.3 方法
1.3.1 wPLaE的提取与纯化
小麦洗净晾干后粉碎,称取适量小麦粉,按照1∶5(g/mL)比例加入蒸馏水,搅拌30 min,4 ℃浸提过夜,离心取上清液,即得到植物酯酶粗酶液。参照文献[17]进行双水相萃取,得到纯化后的wPLaE,冷冻干燥成粉末,储存于-20 ℃备用。
1.3.2 磷酸盐缓冲溶液(phosphate buffer solution,PBS)配制
先分别配制0.2 mol/L Na2HPO4溶液(A液)和0.2 mol/L NaH2PO4溶液(B液),取315 mL A液和685 mL B液混合均匀得pH 6.5的PBS。取720 mL A液和280 mL B液混合均匀得pH 7.2的PBS。
1.3.3 MWNT酸化
将1 g MWNT用80 mL浓硫酸与硝酸(H2SO4∶HNO3=3∶1,V/V)的混合物在80 ℃回流180 min,对纳米碳管进行羧基化,离心,弃上层悬浮液,然后水洗至pH值近中性,将产物在65 ℃真空干燥。
1.3.4 AuNPs的制备
150 mL超纯水搅拌加热至沸腾,迅速加入4.5 mL 1%的柠檬酸钠溶液与1.5 mL 1%的HAuCl4溶液,继续反应至溶液颜色变为酒红色,继续沸腾15 min后停止加热,继续搅拌至冷却[18]。将AuNPs溶液储存于棕色瓶中,4 ℃贮存备用。
1.3.5 酶电极的制备
将玻碳电极(glassy carbon electrodes,GCE)用0.3 μm和0.05 μm的Al2O3粉末打磨并抛光至镜面,然后依次用水、乙醇、超纯水超声清洗,在PBS(0.2 mol/L、pH 7.2)中活化后备用。首先在GCE表面滴加6 μL 0.5 mg/mL的MWNT溶液,室温晾干后,依次向电极表面滴加6 μL AuNPs和24 μL wPLaE-CS混合液,最后取4 μL Nafion(质量分数0.1%)滴涂在电极表面,制成NF/wPLaE-CS/AuNPs/MWNT/GCE。
1.3.6 电化学测试
采用三电极检测装置:修饰GCE为工作电极,铂丝为对电极,Ag/AgCl为参比电极。以PBS(0.2 mol/L、pH 6.5)溶液为测试底液,将制备好的电极首先在含有0.8 mmol/L 1-NA的PBS(0.2 mol/L、pH 6.5)中进行方波伏安(square wave voltammetry,SWV)检测得电流值I0,电极清洗后,将电极浸入不同质量浓度的敌敌畏标准液中孵育10 min,再次将其浸入含有同浓度底物的PBS(0.2 mol/L、pH 6.5)中进行SWV检测得电流值I1,根据下式计算抑制率Y:

1.3.7 实际样品的制备
称取25 g(精确至0.000 1 g)生菜样品,加入100 mL PBS(0.2 mol/L、pH 6.5)粉碎至浆,然后将生菜匀浆在8 000 r/min离心10 min,取1 mL上清液,稀释20 倍后作为生菜汁实际样品。
大米磨至粉末,过80 目筛,称取0.03 g(精确至0.000 1 g)大米粉与100 mL PBS(0.2 mol/L、pH 6.5)混合均匀,并在8 000 r/min离心30 min,离心后取0.2 mL上清液用20 mL超纯水稀释作为大米实际样品。
2 结果与分析
2.1 纳米材料表征
如图1a所示,MWNT呈细长的管状,直径在30 nm左右,且多个管状结构堆叠缠绕形成中空的网状结构,该结构可为后续材料的修饰提供更多的附着位点。
如图1b所示,紫外-可见光谱在518 nm波长处有最大吸光度,根据文献报道[19],不同粒径、不同浓度的AuNPs有不同的特征峰与最大吸收波长,且AuNPs的最大吸收波长与其粒径呈线性相关:λ=0.786D+505.53,其中λ为最大吸收波长,D为AuNPs的粒径,通过计算得到AuNPs的粒径为(15±2)nm,与透射电镜图基本一致。

图1 MWNT和AuNPs电镜图Fig. 1 Electron microscopic images of MWNT and AuNPs
2.2 酶电极修饰过程的电化学表征
在5 mmol/L的铁氰化钾探针溶液中对电极的修饰过程进行循环伏安(cyclic voltammetry,CV)法表征,结果如图2所示,在-0.2~0.6 V区间,所有电极都出现了一对氧化还原峰,对应的反应历程为[Fe(CN)6]3-+e=[Fe(CN)6]4-。与裸电极(曲线a)相对比,修饰MWNT之后(曲线b)氧化还原峰电流明显增加,这说明MWNT具有良好的导电性和电催化活性,能够促进电子传递;继续修饰AuNPs后(曲线c),响应电流又出现小幅度提升,这得益于AuNPs的良好导电性。而在修饰了wPLaE和Nafion后(曲线d),电极的响应电流值明显减小,这是因为wPLaE为蛋白质,导电性能差,因而阻碍了电子的传递。图2表明wPLaE被成功地修饰于电极上,且修饰后的电极比裸电极具有更好的电化学响应。

图2 不同修饰电极在探针溶液中的CV曲线图Fig. 2 CV curves of different modified electrodes in probe solution
2.3 传感电极对1-NA的酶催化电化学响应
采用CV技术考察wPLaE对其底物1-NA的电化学响应,结果如图3所示。修饰了wPLaE的传感器在不含底物1-NA的溶液中无任何峰出现(曲线b),加入1-NA后在0.55 V附近出现了一个明显的氧化峰(曲线c),这是wPLaE水解底物1-NA生成了具有电化学活性的1-萘酚,随后1-萘酚被电化学氧化产生相应的氧化峰,反应历程如图4所示。曲线a为无wPLaE的传感器在PBS(0.2 mol/L、pH 6.5)底液中的CV图,发现无任何氧化还原峰出现,进一步证明曲线b中的氧化峰就是wPLaE催化1-NA所致。以上现象表明wPLaE被成功固载在电极上且保持了其酶催化活性。
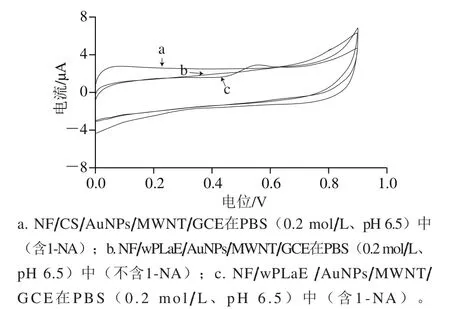
图3 不同修饰电极的CV图Fig. 3 CV curves of different modified electrodes
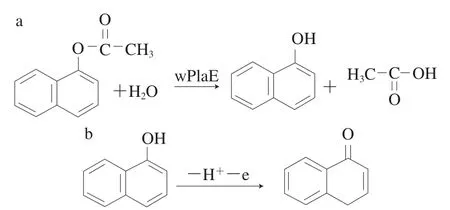
图4 酶催化反应(a)和1-萘酚氧化反应(b)Fig. 4 Enzyme catalyzed reaction (a) and oxidation reaction of 1-naphthol (b)
考察3种不同酶电极对同一浓度1-NA的电化学响应(图5)。实验发现,电极上没有修饰纳米材料时只出现了很小的一个氧化峰(曲线a)。修饰MWNT后,该氧化峰有所增大,继续修饰AuNPs后氧化峰明显增大且峰电位负移,这表明AuNPs和MWNT具有协同电催化效应,能有效地促进电子转移,从而对wPLaE的生物催化电化学响应有显著增敏作用。此外,AuNPs具有良好的生物相容性[20],这有利于保持电极上wPLaE的生物活性。

图5 不同修饰电极在含0.8 mmol/L 1-NA的PBS(0.2 mol/L、pH 6.5)中CV曲线Fig. 5 CV curves of different modified electrodes in PBS (0.2 mol/L,pH 6.5) containing 0.8 mmol/L 1-NA
2.4 敌敌畏对酶催化响应信号的影响
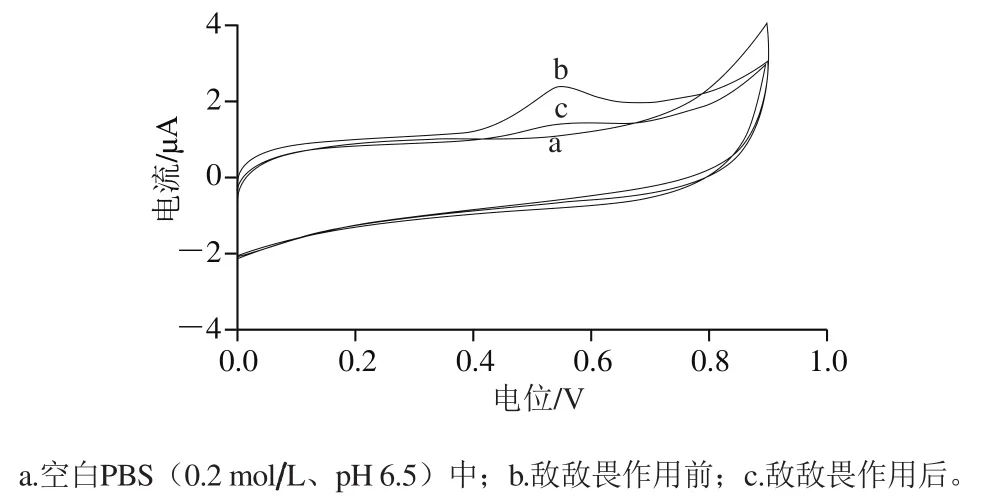
图6NF/wPLaE-CS/AuNPs/MWNT/GCE在不同条件下的CV曲线Fig. 6 CV curves of NF/wPLaE-CS/AuNPs/MWNT/GCE under different conditions
考察敌敌畏对电极上wPLaE生物催化活性的影响。由图6可知,酶电极在未加入底物1-NA的空白PBS中未出现氧化峰(曲线a),加入底物1-NA后,出现了明显的电化学氧化峰(曲线b),用80 μg/L敌敌畏农药作用后,氧化峰电流的响应值减小(曲线c),以上实验现象说明敌敌畏可以抑制wPLaE的活性,使得体系中生成的1-萘酚的量减少,从而导致1-萘酚氧化峰响应电流也随之减小,据此可以建立基于酶抑制作用的敌敌畏农药检测新技术,检测原理如图7所示。
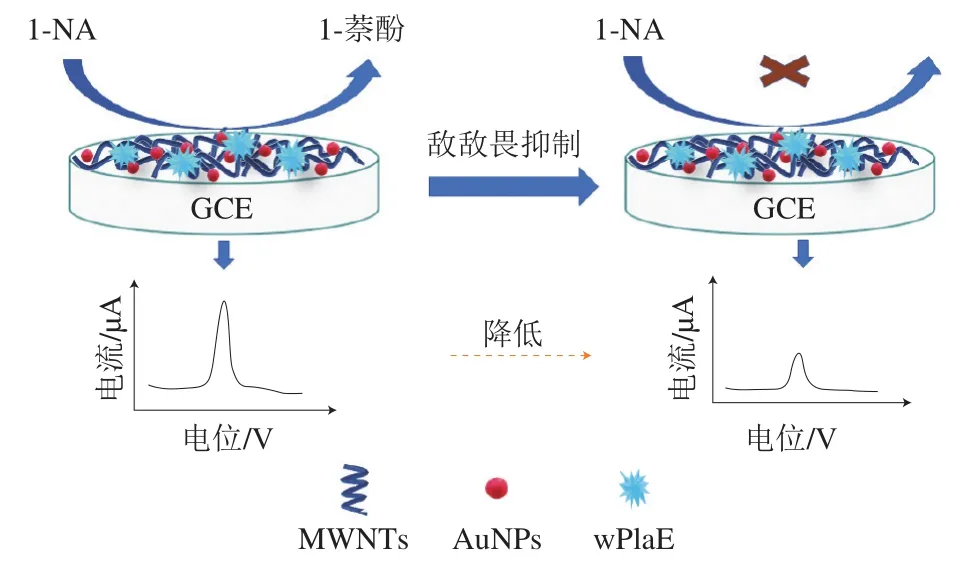
图7 敌敌畏检测原理示意图Fig. 7 Schematic illustration of the principle of dichlorvos detection
2.5 敌敌畏检测标准曲线的建立
如图8所示,随敌敌畏质量浓度增加,峰电流值减小,即随敌敌畏质量浓度增加,对wPLaE活性的抑制作用也增强。结果表明在10~100 μg/L范围内,敌敌畏质量浓度(C)与抑制率(Y)之间呈良好的线性关系,线性回归方程为Y=0.778C+6.248,R2=0.995,检出限为4 μg/L(RSN=3)。
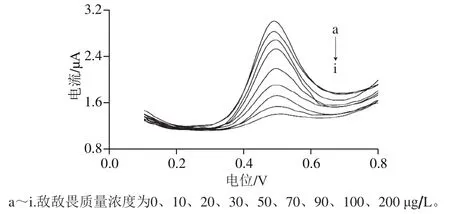
图8 不同质量浓度敌敌畏作用后的SWV图Fig. 8 SWV curves after treatment with different concentrations of dichlorvos
2.6 重复性和稳定性结果
同一支电极测定5 次0.8 mmol/L 1-NA,峰电流值的相对标准偏差为3.3%(n=5)。此外,同一批制备的5 支电极,分别测定0.8 mmol/L 1-NA,峰电流值的相对标准偏差为5.3%(n=5)。
考察所制酶电极的稳定性,每隔5 d对同一浓度的1-NA进行测试,不用时放在4 ℃避光保存。结果表明,第5天响应电流值减小为初始电流值的93%;第10天响应电流值降至88%;第15天仍保持初始电流值的78%,说明制备的酶电极具有良好的稳定性。
2.7 抗干扰性实验结果
考察实际样品中可能共存的常见离子、有机物和其他类型农药对测定的影响,结果如图9所示(以只有敌敌畏时的响应信号为100%)。结果表明,3 mg/L的Cl-、柠檬酸和葡萄糖与30 μg/L敌敌畏共存时,响应信号没有明显改变,说明所建方法具有良好的抗干扰能力。但当300 μg/L的Pb2+与30 μg/L的敌敌畏共存时,响应信号降低为原来的63%,说明Pb2+也能抑制wPLaE活性,对测定有干扰。此外,30 μg/L的林丹(有机氯类农药)和溴氰菊酯(拟除虫菊酯类农药)共存对测定几乎无干扰,但30 μg/L多菌灵(氨基甲酸酯类农药)共存时,响应信号明显下降,表明其对wPLaE活性有抑制。但同样的抑制作用也在其他植物酯酶型和乙酰胆碱酯酶型传感器中出现。
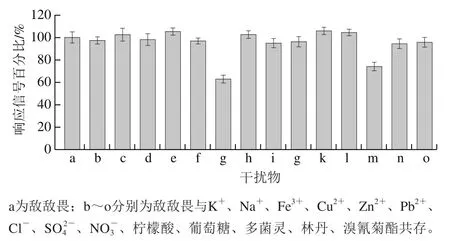
图9 NF/wPLaE-CS/AuNPs/MWNT/GCE传感器的抗干扰性Fig. 9 Anti-interference ability of NF/wPLaE-CS/AuNPs/MWNT/GCE
2.8 与其他方法比对结果
对所建方法与近年来其他方法进行比较。由表1可知,所建方法具有较低的检出限。此外,虽然本法的检出限仍高于超高效液相色谱-三重四极杆串联质谱,但与昂贵的大型仪器相比,本法的具有仪器便宜、操作简单,样品无需预处理的优势。
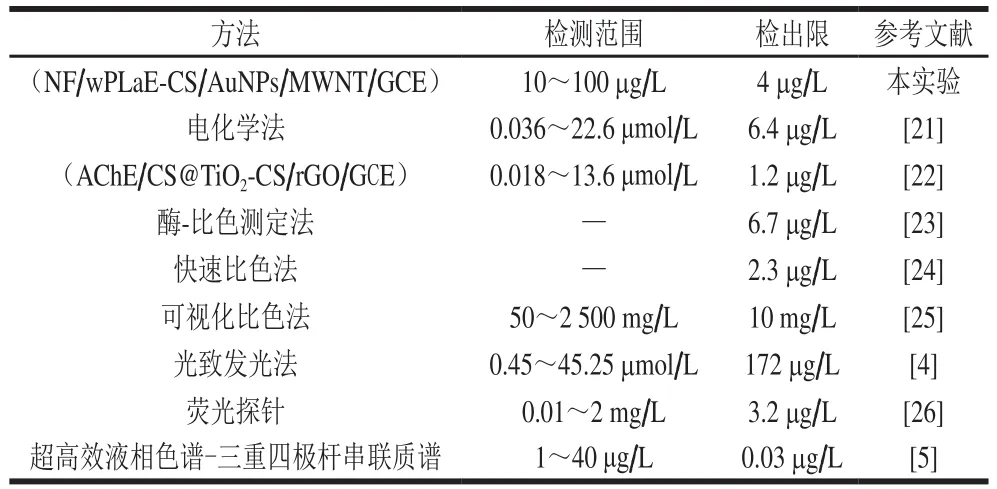
表1 本法与其他敌敌畏检测方法比较Table 1 Comparison of this method with other dichlorvos detection methods
2.9 方法的回收率和精密度实验结果
采用NF/WPLaE-CS/AuNPs/MWNT/GCE传感器对实际样品(生菜和大米)中敌敌畏的检测性能进行考察。在实际样品中添加不同质量浓度的敌敌畏进行检测,每组实验平行测定3 次。从表2可以看出,对敌敌畏的检测回收率在95.4%~107.2%之间,具有良好的回收率,表明该传感器可以用于实际样品中敌敌畏检测。
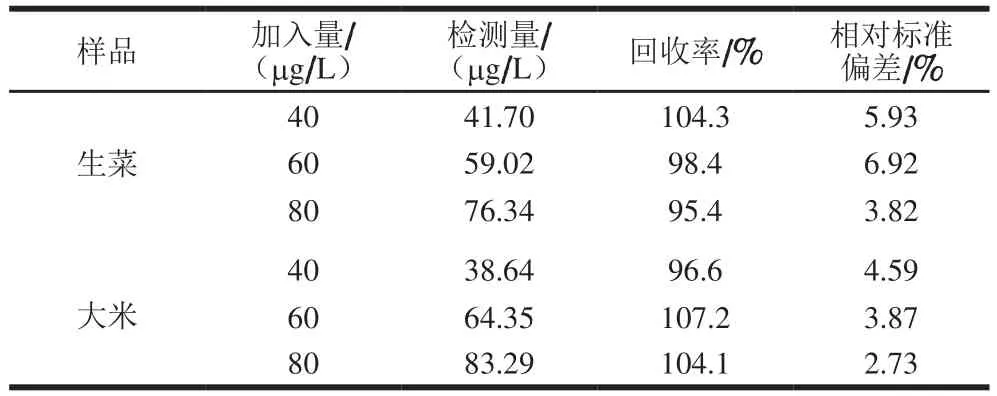
表2 NF/wPLaE-CS/AuNPs/MWNT/GCE实际样品中敌敌畏检测结果Table 2 Recoveries and precision of dichlorvos spiked in real samples with NF/wPLaE-CS/AuNPs/MWNT/GCE
3 结 论
以来源于植物的wPLaE代替来源于动物的乙酰胆碱酯酶为酶源,构建了一种新型生物传感电极NF/wPLaECS/AuNPs/MWNT/GCE,将其用于农药敌敌畏的简便、准确检测,检出限为4 μg/L(RSN=3)。该生物传感电极具有良好的稳定性,这得益于AuNPs和CS良好的生物相容性及植物酯酶自身较好的稳定性。与大型仪器分析方法相比,所建电化学检测方法具有简便、准确、快速、样品预处理简单等优点。该研究也可为食品中农残电化学传感器的实际应用开发和后续便携式电化学传感器的研发提供一定的理论和技术基础。
