恒温隔绝式聚合酶链式反应检测食品中金黄色葡萄球菌
2022-02-16李传友曾宝锋赵燕英朱成林曾英杰于基成唐俊妮
李传友,曾宝锋,赵燕英,汤 承,陈 娟,刘 骥,朱成林,曾英杰,于基成,唐俊妮,*
(1.西南民族大学食品科学与技术学院,四川 成都 610041;2.西南民族大学畜牧兽医学院,四川 成都 610041;3.大连民族大学 生物技术与资源利用教育部重点实验室,沈阳 大连 116600)
金黄色葡萄球菌(Staphylococcus aureus)广泛存在于自然界,是一种常见的食源性致病微生物[1]。其容易污染食物并在食物上生长产生具有毒性的肠毒素物质(Staphylococcal enterotoxins,SEs),如SEA、SEB、SED等经常引发食物中毒,威胁着食品安全[2-3]。人体是金黄色葡萄球菌的天然宿主,30%~50%健康人体的鼻腔中定植有金黄色葡萄球菌[4],因此,食品从生产加工到最终的销售环节都有被污染的可能。每年因金黄色葡萄球菌污染食物而引发的食物中毒事件时有发生,如陈永正等[5]对一起幼儿园食物中毒事件展开调查,发现该起食物中毒事件由金黄色葡萄球菌A型肠毒素引起;熊玉华等[6]对一家自助餐厅的食材进行检测,发现从不同食材中都能分离出金黄色葡萄球菌。
目前,金黄色葡萄球菌的常用检测方法主要有传统培养法、免疫学方法和分子生物学检测方法等[7-9]。其中传统检测方法和免疫学方法都存在耗时长,操作繁琐等缺点[10]。分子生物学作为最常用的一种检测方法,具有特异性好、灵敏度高等优点,已经广泛用于金黄色葡萄球菌的检测中[11]。
恒温隔绝式聚合酶链式反应(insulated isothermal polymerase chain reaction,iiPCR)是一种新型荧光PCR技术,它是根据Rayleigh-Benard对流原理,通过反应管底部液体持续加热产生上部液体与下部液体的温度差,通过控制散热的速率与对流的时间,在反应管内部形成稳定温度梯度,从而提供PCR扩增所需的反应条件[12]。该技术最早在2002年,由Krishnan首次报道[13],结合POCKITTM系列手持式核酸检测仪,体积小、自带电源,加样后一键操作,反应仅需42 min便可完成,结果以“+”、“-”、“?”直接显示于液晶屏幕上,方便快捷,可达到现场快速检测的目的。目前iiPCR技术主要用于病毒检测,如猪流行性腹泻病毒[14]、牛冠状病毒[15]、虾白斑病病毒[16]、尖孢镰刀菌[17]、滑膜支原体[18]等;而针对细菌的检测报道较少,仅有无乳链球菌[19]和沙门氏菌[20]的相关报道。因此,本研究拟建立一种基于iiPCR技术快速检测金黄色葡萄球菌的方法,并进行方法的比较和初步应用,以期为后期进一步推广应用提供一定的参考依据。
1 材料与方法
1.1 菌株
金黄色葡萄球菌ATCC6538作为参考菌株,其他菌株:猪链球菌II型、大肠杆菌ATCC25922、蜡样芽孢杆菌ATCC11778、单核细胞性李斯特菌ATCC19115、副溶血弧菌ATCC17802、阪崎肠杆菌ATCC29544、志贺菌ATCC12022、沙门氏菌H9812均由本实验室保存。
1.2 试剂与仪器
7.5%氯化钠肉汤、Baird-Parker(BP)琼脂基础、胰蛋白胨大豆肉汤培养基(trypticase soy broth,TSB)、胰蛋白胨大豆琼脂(trypticase soy agar,TSA)、1%亚碲酸钾卵黄增菌液 海博生物技术有限公司;DL2000 Marker、TaqPCR Mix预混液(2X含蓝染料) 北京擎科新业生物技术有限公司;氯化钠 天津市致远化学试剂有限公司;G-10电泳琼脂糖凝胶 西班牙Biowest公司;Tris-HCl、EDTA 北京博奥拓科技有限责任公司;Premix ExTaq(Probe qPCR)、TB Green Premix ExTaqII、核酸染料GELVIEW 宝生物工程(大连)有限公司。
CFX96荧光定量PCR仪、VerSaDoc2000凝胶成像系统美国Bio-Rad有限公司;TSNENEN031445 PCR仪基因(美国)有限公司;POCKITTM小型智能型核酸分析仪、R-tube(48) 厦门金瑞鸿捷生物科技有限公司;SC-15数控超级恒温槽 宁波新芝生物科技股份有限公司;5804R型冷冻离心机 Eppendorf生命科技公司;DYY-6C电泳仪 北京六一仪器厂;WD800B型微波炉 顺德市格兰仕微波炉电器有限责任公司。
1.3 方法
1.3.1 引物及探针的设计与合成
选取金黄色葡萄球菌的nuc基因作为目标基因,利用Primer Premier 5软件设计一对引物及探针,并对引物与探针进行BLAST比对。另一对常规PCR引物参考唐俊妮等[21]的引物,详细引物信息见表1。引物和探针均由生工生物工程(上海)股份有限公司合成。
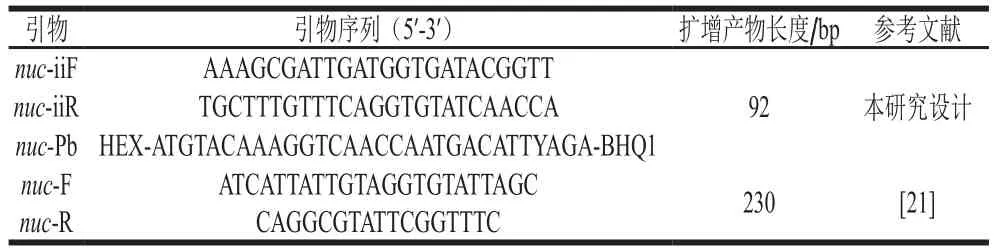
表1 引物、探针基本信息Table 1 Sequences of primers and probes used in this study
1.3.2 模板DNA的提取
参考酚-氯仿提取法[22]、水浴提取法[23]、微波提取法[24]提取模板DNA,并对3种方法的扩增效果进行对比。
1.3.3 iiPCR反应体系的探索
参考李凡等[15]建立的牛冠状病毒iiPCR方法。采用25 μL体系分别对已知浓度的Taq酶(预混酶)5 U/μL(11~13.5 μL)上下游引物10 μmol/μL(0.5~2 μL)、探针10 μmol/μL(0.25~1 μL)、模板DNA(1~4 μL)、无菌水的用量进行条件探索,确定各自用量的最佳值。
1.3.4 特异性实验
采用上述扩增体系,结合POCKITTM手持式核酸分析仪对提取的金黄色葡萄球菌、单核细胞性李斯特菌、大肠杆菌、蜡样芽孢杆菌、沙门氏菌、副溶血弧菌、猪链球菌、阪崎肠杆菌、志贺菌的模板DNA进行检测,以判定该方法的特异性。
1.3.5 灵敏性实验
将纯培养的金黄色葡萄球菌菌液通过10 倍稀释成不同的浓度梯度(100~10-10),提取各个浓度模板DNA采用上述体系并结合POCKITTM手持式核酸分析仪进行检测,确定其检出限。
1.3.6 稳定性实验
参考谢国驷等[25]的方法,采用上述扩增体系并结合POCKITTM手持式核酸分析仪分别对纯培养菌液的3个稀释度(10-6、10-7、10-8)提取的模板DNA进行3 次重复性实验,以评价该方法的稳定性。
1.3.7 人工模拟污染食物样品的检测
将起始接种总数量为100 个CFU的金黄色葡萄球菌分别接种到250 mL的脱脂牛奶和10 g猪肉中进行培养,之后在细菌生长过程中的第2、4、6、8小时进行取样,同时采用传统PCR方法和iiPCR方法进行检测,对比其检测结果。传统PCR体系及反应条件:TaqPCR Mix预混液(2X,含蓝染料)10 μL、上游引物0.4 μL、下游引物0.4 μL、模板DNA 1 μL、无菌超纯水补足至20 μL体系;反应扩增条件:95 ℃预变性5 min,95 ℃变性40 s,55 ℃退火50 s,72 ℃延伸40 s,35个循环;72 ℃延伸10 min。产物于4 ℃保存或进行凝胶电泳检测。产物的琼脂糖电泳检测:配制琼脂糖凝胶为1 g/100 mL,取4.5 μL扩增产物进行点样,90 V、72 A条件下电泳40 min,在凝胶成像系统下观察结果。
1.3.8 采集实际食物样品
市场上采集20 份食品样品,每份10 g直接分装至7.5%氯化钠肉汤中富集培养,采用传统PCR方法、iiPCR方法对样品进行检测,同时根据GB 4789.10—2016《食品微生物学检验 金黄色葡萄球菌检验》对检测结果进行验证[26]。
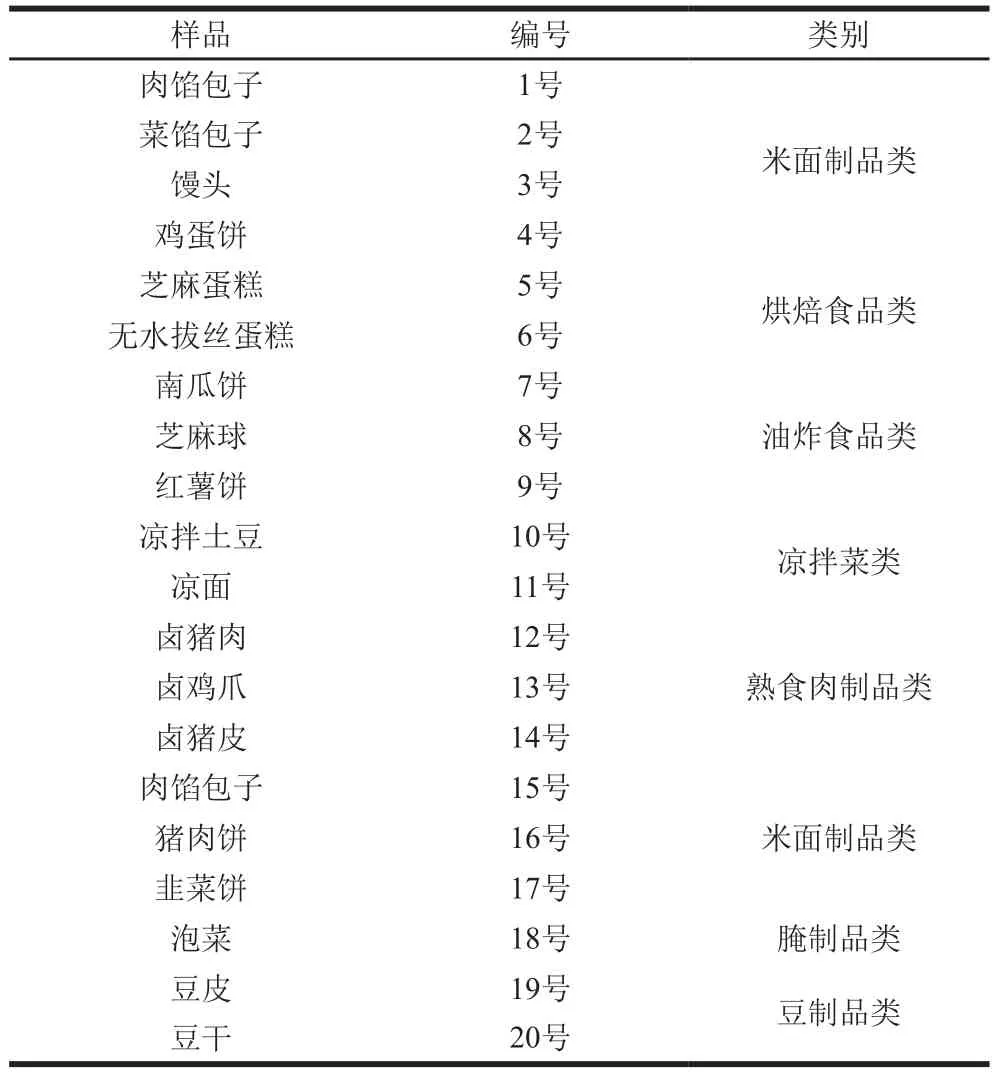
表2 样品采集信息Table 2 Information about samples collected in this study
2 结果与分析
2.1 模板DNA提取方法的比较结果
采用酚-氯仿提取法、水浴提取法、微波提取法提取DNA的PCR扩增结果见图1。3种方法都能扩增出目的条带,但考虑到酚-氯仿提取法所使用试剂有毒,所耗时间长;微波提取法对微波炉功率有一定要求;而水浴法操作简便,因此,本研究选择水浴法作为细菌DNA提取的方法。
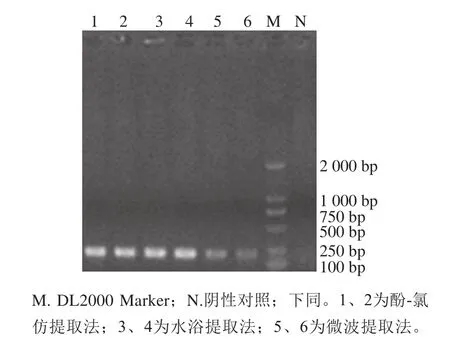
图1 模板DNA提取方法扩增产物的比较Fig. 1 Comparison of PCR-amplified products of template DNA extracted by different methods
2.2 iiPCR体系的探索结果
经过筛选确定,摸索出iiPCR最终反应体系:5 U/μLTaq酶(预混酶)12.5 μL,10 μmol/μL上、下游引物各1 μL,10 μmol/μL探针0.5 μL,模板2 μL,补足无菌水至25 μL。
2.3 iiPCR的特异性实验结果
将金黄色葡萄球菌、单核细胞性李斯特菌、大肠杆菌、蜡样芽孢杆菌、沙门氏菌、副溶血弧菌、猪链球菌、阪崎肠杆菌、志贺菌的DNA按上述扩增体系进行扩增,结果见图2,图中POCKITTM手持式核酸分析仪界面上显示只有金黄色葡萄球菌检出为阳性结果(+),阴性对照和单核细胞性李斯特菌、大肠杆菌、蜡样芽孢杆菌、沙门氏菌、副溶血弧菌、猪链球菌、阪崎肠杆菌、志贺菌均检出为阴性(-)。表示针对金黄色葡萄球菌所建立的iiPCR检测方法特异性良好。

图2 iiPCR特异性实验Fig. 2 Specificity evaluation of iiPCR
2.4 iiPCR的敏感性实验结果
将纯培养浓度为109CFU/mL金黄色葡萄球菌菌液,通过梯度稀释培养液,然后采用上述扩增体系对不同稀释浓度的培养液进行检测,结果见图3,可以看出,POCKITTM手持式核酸分析仪界面上阴性对照和浓度为10 CFU/mL时显示为阴性(-),浓度为103CFU/mL和102CFU/mL显示为阳性(+),说明建立的iiPCR检测方法对金黄色葡萄球菌纯培养液的检出限为102CFU/mL。
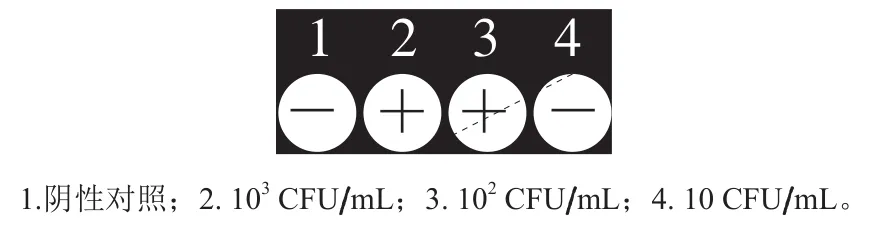
图3 iiPCR敏感性实验Fig. 3 Sensitivity evaluation of iiPCR
2.5 iiPCR的稳定性实验结果
采用本研究建立的iiPCR方法对3个稀释度(10-6、10-7、10-8CFU/mL)的模板DNA分别进行3 次重复性检测,从图4可看出,POCKITTM手持式核酸分析仪界面上10-6CFU/mL和10-7CFU/mL显示为阳性(+),10-8CFU/mL和阴性对照显示为阴性(-),3 次重复检测结果一致,表示所建立的iiPCR方法稳定性良好。

图4 iiPCR稳定性实验Fig. 4 Stability evaluation of iiPCR
2.6 人工模拟污染食物样品的检测结果
2.6.1 猪肉样品的检测结果
对猪肉中培养至第2、4、6、8小时的样品进行检测,结果见图5。在培养至第2、4小时,传统PCR方法和iiPCR方法均不能检测出样品;培养至第6小时,猪肉样品中的金黄色葡萄球菌数量约为1 000 CFU/mL,建立的iiPCR方法可以得到检测结果为阳性,传统PCR方法检测结果为阴性。在培养至第8小时,传统PCR方法和iiPCR方法均能得到阳性检测结果,此时金黄色葡萄球菌数量约为105CFU/mL。

图5 猪肉样品检测结果Fig. 5 Results of iiPCR and traditional PCR for pork samples
2.6.2 脱脂牛奶样品的检测结果
对脱脂牛奶中培养至第2、4、6、8小时样品进行检测,结果见图6。培养至第2、4小时,传统PCR方法和iiPCR方法均不能检测出阳性结果;培养至第6小时,脱脂牛奶样品中的金黄色葡萄球菌数量约为100 CFU/mL,建立的iiPCR方法可检测出阳性结果,传统PCR方法检测结果为阴性。培养至第8小时,传统PCR方法和iiPCR方法均能得到阳性检测结果,此时金黄色葡萄球菌数量约为105CFU/mL。
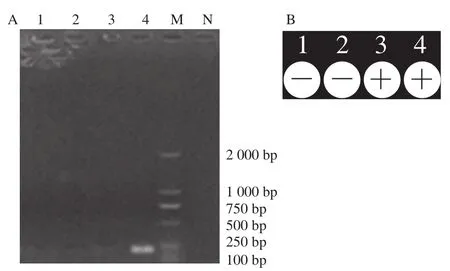
图6 脱脂牛奶样品检测结果Fig. 6 Results of iiPCR and traditional PCR for skim milk samples
2.7 实际采集食物样品的检测结果
2.7.1 实际样品检出结果
采用建立的iiPCR方法对采集的20 份实际样品进行检测,在培养至第6小时iiPCR方法扩增结果见图7,可看出此时iiPCR方法可对17 份样品检出阳性结果,6号、8号和18号样品未检出,检出率为85%(17/20)。
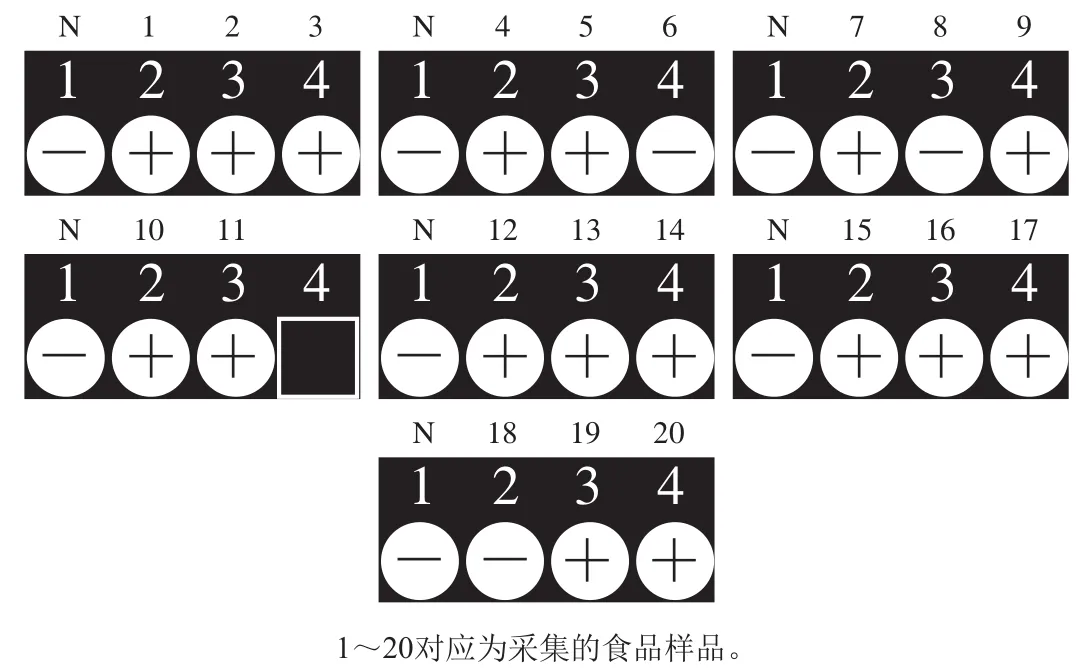
图7 建立的iiPCR在培养至第6小时检测食品样品的结果Fig. 7 Results of iiPCR for food samples at 6 h
2.7.2 iiPCR方法与其他检出方法的比较
采用建立的iiPCR方法、传统PCR方法以及传统培养法对采集样品检出结果进行比较,结果见表3。在培养至第8小时传统PCR方法扩增结果见图8,可看出此时传统PCR方法只能对14 份样品检出阳性结果,检出率为70%,3、6、8、10、17、18号样品未能检出。进一步对未检出样品进行培养,直到培养至第12小时,传统PCR方法才可对3、10、17号样品检出阳性,结果见图9。同时根据GB 4789.10—2016对培养至第16小时的样品进行分离鉴定,部分结果见图10,所有能检出的阳性样品在BP琼脂上均能生长出金黄色葡萄球菌的典型菌落形态,菌落呈灰黑色、周围有浅白色的边缘并绕以不透明圈,其外有一清晰带,通过镜检染色进一步鉴定,并同时进行PCR确认,结果见图11,除6、8、18号样品检测为阴性,其他17 份样品检测均为阳性结果,培养至第6小时iiPCR方法检测出的结果一致。可见,由本研究建立的金黄色葡萄球菌iiPCR检测方法耗时更短,且应用于实际食品样品检测时,快捷、实用和准确度高。

图8 传统PCR检测食品样品结果(8 h)Fig. 8 Results of traditional PCR for food samples at 8 h
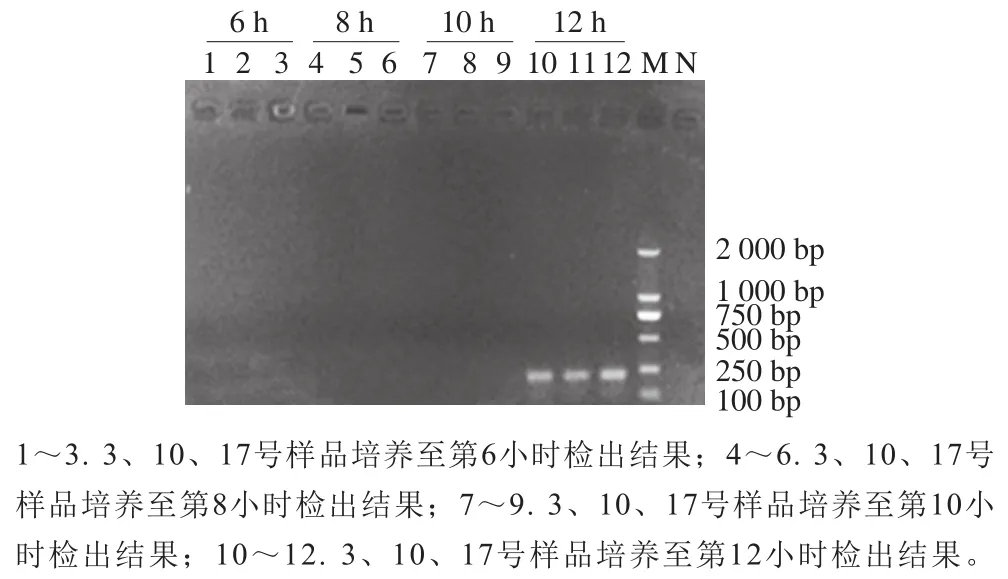
图9 食品样品3、10、17号采用传统PCR在培养至第6、8、10、12小时的检出结果Fig. 9 Results of traditional PCR for food samples 3, 10, and 17 at 6, 8, 10 and 12 h
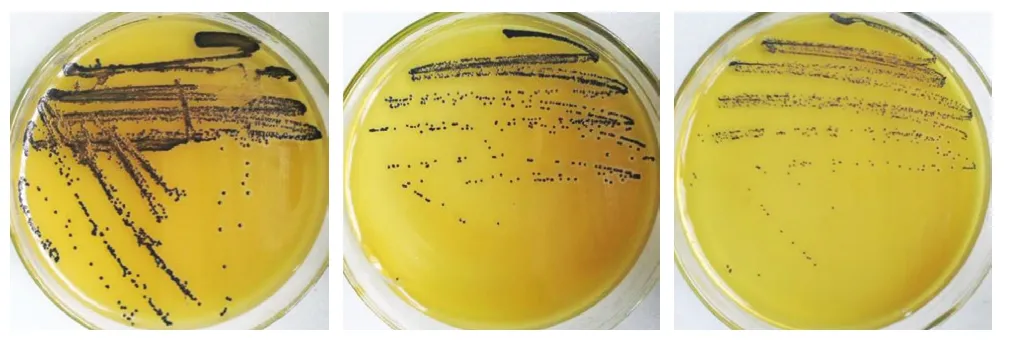
图10 传统培养法验证Fig. 10 Results of validation by traditional culture method
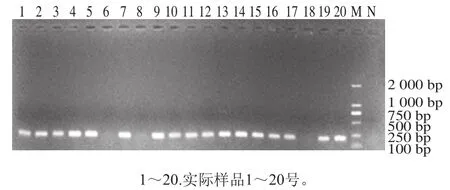
图11 传统培养方法分离细菌的PCR鉴定结果Fig. 11 PCR identification results of bacteria isolated by traditional culture method
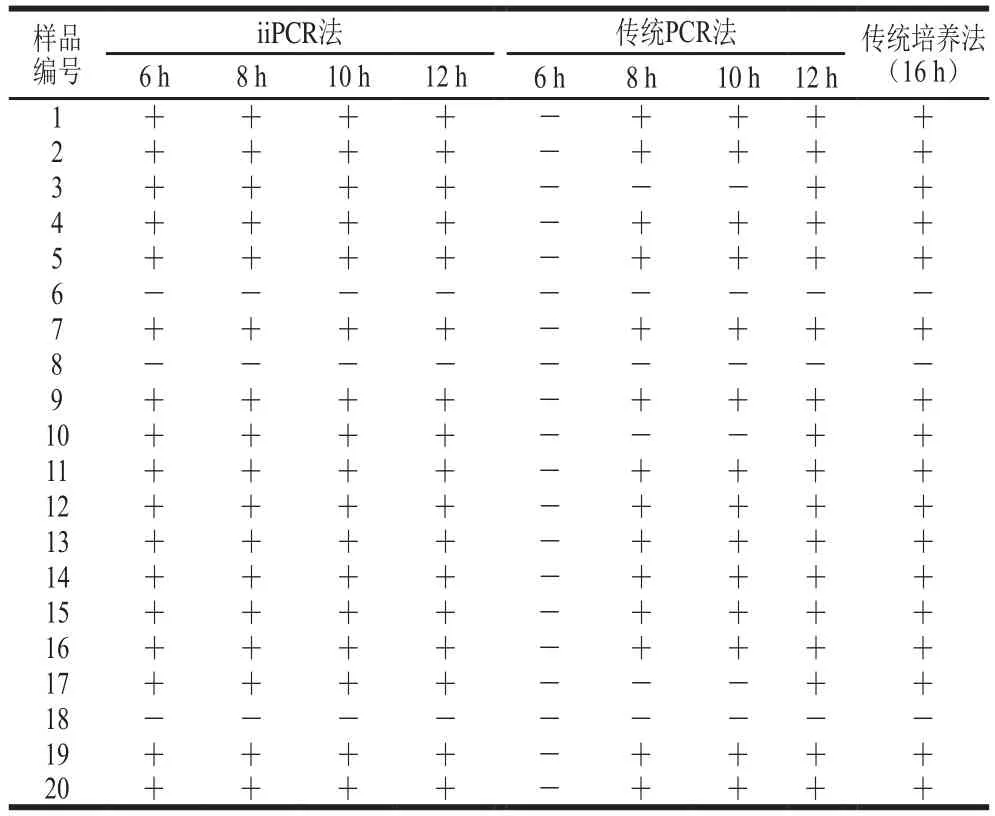
表3 3种检测方法的比较结果Table 3 Comparison of results of three detection methods
3 讨论与结论
本研究基于iiPCR技术,建立一种适用于快速检测金黄色葡萄球菌的方法,在缩短检测时间的同时,提高了工作效率。至今发现的SEs和类肠毒素共有27 种[27-28],有相关报道认为金黄色葡萄球菌污染食品并产生危害是在生长对数后期或达到生长稳定期时,此时SEs大量产生,造成食物中毒[29-31]。因此,在产生毒素前及时检测出结果十分必要。本研究建立的iiPCR方法可以满足这一要求。
本研究在模拟的食物基质检测表明,含量很低的金黄色葡萄球菌在前4 h生长速度相对较缓慢,而在4 h之后则开始生长加快,建立的方法可从培养6 h人工污染的脱脂牛奶和猪肉中提取出细菌模板DNA,并检测到金黄色葡萄球菌的存在,而传统的PCR检测方法需要更久的培养时间,说明方法的敏感性优于传统PCR方法;另外发现,金黄色葡萄球菌在脱脂牛奶和猪肉中前8 h的生长速度低于在TSB中的生长速度,可能由于培养基中营养成分的种类和含量比脱脂牛奶和猪肉更适合细菌生长[32]。目前,对于食品中金黄色葡萄球菌的检测一般都是按照国标方法[26],首先进行细菌的富集培养,再进行细菌的分离纯化,耗时较长,通常需要2~3 d甚至更久才能完成整个检测过程。本研究探讨对食品样品中金黄色葡萄球菌的iiPCR检测,通过对样品进行简单前处理,只需在7.5%氯化钠肉汤中富集 6 h后,配合水浴法提取模板DNA,证实建立的iiPCR方法可检测食品样品中的金黄色葡萄球菌,说明模板DNA提取探索和方法的建立成功。Tsen等[20]针对鸡肉中沙门氏菌检测,建立了iiPCR方法,并经实验证明鸡肉样品只需富集5 h,就可利用iiPCR检测沙门氏菌,本研究的结果也达到了同样效果。结合POCKITTM系列手持式核酸检测仪42 min的反应和结果的显示,省去繁琐的凝胶电泳过程,大大节省时间。可见,采用的iiPCR技术在目标细菌的富集时间上节省了至少2 h以上,再加上传统PCR所需的扩增反应时间和凝胶电泳时间,整个检测时间可缩短至少5 h以上。传统PCR方法检测整个流程所需至少12 h甚至更久,而iiPCR方法检测整个流程可在7~8 h完成,操作更便捷。当然,本研究中也存在一定的不足,未来将扩充菌株的验证数量,进一步加大该方法的使用和评价。
综上,本研究建立的一种基于iiPCR技术检测金黄色葡萄球菌的方法,对方法进行初步应用,证明该方法具有灵敏度高、特异性好、稳定性好的特点。将该方法结合水浴法快速提取模板DNA以及POCKITTM手持式核酸分析仪,通过设计特异性引物和探针,可实现对金黄色葡萄球菌的现场快速检测。从目标细菌富集,到模板DNA提取,特异性基因扩增到出现检测结果,整个过程可在7~8 h完成。相比于传统PCR检测方法,至少节省了5~6 h的检测时间,省去凝胶电泳过程,操作更便捷。
