同时检测玉米中黄曲霉毒素B1和赭曲霉毒素A的时间分辨荧光免疫层析试纸条的研制
2022-02-16卢迪莎杨金易肖治理
卢迪莎,王 序,杨金易,罗 林,肖治理
(广东省食品质量安全重点实验室,华南农业大学食品学院,广东 广州 510642)
黄曲霉毒素B1(aflatoxin B1,AFB1)是所有真菌毒素中致癌性最高的,被国际癌症研究机构(International Agency for Research on Cancer,IARC)归为一类致癌物[1],若人体不慎大量摄入会引发急性肝炎,长期摄入甚至会造成肝脏癌变[2]。赭曲霉毒素A(ochratoxin A,OTA)是赭曲霉毒素中毒性最强的,主要损害人体的肾脏,还会引起免疫抑制,IARC已将其归类为2B类致癌物[3-4]。为了保障人民食品安全,国家质监局要求AFB1与OTA为谷物类食品的必检项目,GB 2761—2017《食品的真菌毒素限量》规定AFB1在谷物及其制品中最大残留限量为5.0~20 μg/kg,OTA为5.0 μg/kg[5]。由于真菌毒素污染广泛[6],且往往共同存在于食品中造成混合污染,引起的联合毒性效应给人畜带来更大的威胁[7-8],其中AFB1与OTA常同时污染谷物类食品[9-10],因此有必要开发一种操作简便、成本较低、可对这2 种毒素同时进行快速筛查的免疫检测方法。
目前,食品中真菌毒素的多组分检测方法已迅速发展,用于检测AFB1和OTA的方法主要有高效液相色谱法[11]、液相色谱-串联质谱法[12-13]、超高效液相色谱-串联质谱法[14-15]等。基于抗原抗体特异性结合反应的免疫快速检测方法也在不断开发,其中时间分辨荧光免疫层析方法(time-resolved fluorescence immunochromatographic assay,TRFICA)是以包埋了稀土元素离子螯合物的时间分辨荧光微球为免疫探针,在层析体系中通过竞争反应体系进行检测的方法[16-19]。利用其荧光衰变期长和发射光谱窄的特点,可使有效信号与非特异性的背景荧光信号区分,减少非特异性荧光的干扰,提高了灵敏度[18,20]。通过荧光读数仪检测荧光强度比值,对食品中的真菌毒素进行定性或定量检测,具有简单、快速和可视的检测优势[21-22]。目前已建立的免疫层析试纸条多集中于采用胶体金或量子点作为标记探针实现多组分检测。章先等[23]以胶体金为标记载体,建立了OTA和玉米赤霉烯酮(zeralenone,ZEN)金标二联胶体金免疫层析检测法,能应用于污染样品中OTA和ZEN的同时快速检测。Beloglazova等[24]将一种基于非镉量子点作为横向免疫测定的信号标签,建立了新型的同时多组分免疫检测方法,可对小麦和玉米样品的ZEN和呕吐毒素进行快速多通路定性分析。然而,时间分辨荧光微球作为免疫探针同时检测多种真菌毒素的免疫层析检测方法鲜有报道。本研究基于前期制备的AFB1和OTA单克隆抗体,建立基于稀土铕荧光微球作为检测信号,可同时检测AFB1和OTA的TRFICA。
1 材料与方法
1.1 材料与试剂
玉米样品 温氏食品集团股份有限公司。
197 nm羧基化铕(III)时间分辨荧光微球(365/610,固含量1%) 美国Bangs Laboratories公司;硝酸纤维素膜(NC膜)(UniSart CN 95) 德国赛多利斯公司;样品垫(RB65)、PVC底板(SMA31-40)、吸水纸(CH37K) 上海良信科技有限公司;96 孔酶标板 深圳金灿华实业有限公司。
黄曲霉毒素B2(aflatoxin B2,AFB2,≥98%)、黄曲霉毒素G1(aflatoxin G1,AFG1,≥98%)、黄曲霉毒素G2(aflatoxin G2,AFG2,≥98%)、黄曲霉毒素M1(aflatoxin M1,AFM1,≥98%)、黄曲霉毒素M2(aflatoxin M2,AFM2,≥98%)、赭曲霉毒素B(ochratoxin B,OTB,≥98%)、赭曲霉毒素C(ochratoxin C,OTC,≥98%)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON,≥98%)、ZEN(≥98%)、伏马菌素B1(fumonisin B1,FB1,≥98%)和T-2毒素(T-2,≥98%)标准品 上海阿拉丁生化科技股份有限公司;AFB1(≥98%)、OTA(≥98%)标准品、牛血清白蛋白(bovine serum albumin,BSA)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC)、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)、2-(N-吗啡啉)乙磺酸(2-(N-morpholino)ethanesulfonic acid,MES)、Procline 300美国Sigma公司;羊抗鼠IgG(HRP标记)北京全式金生物科技有限公司;吐温-20、蔗糖麦克林化学试剂有限公司;AFB1-MAb(2.45 mg/mL)、OTA-MAb(3.24 mg/mL)、包被抗原AFB1-OVA、包被抗原OTA-OVA由实验室制备。
1.2 仪器与设备
UNIQUE-R10纯水仪 广州誉维生物科技仪器有限公司;KQ-100E超声波清洗器、CTS300数控裁条机、ZQ2000微电脑自动斩切机、XYZ 3060划膜仪、DHG 9245A鼓风干燥机、AFB1快速检测试纸、OTA快速检测试纸 奥瑞特生物科技有限公司;FIA-680单通道免疫层析定量分析仪 广州敏捷生物技术有限公司;Nexera x2高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 溶液的配制
活化液:0.05 mol/L MES,pH 6.0。偶联缓冲液:12.5 mmol/L Na2B4O7·10H2O,50 mmol/L H3BO3。封闭液:100 g BSA加入100 mL蒸馏水。荧光微球复溶液:0.5 mol/L PBS、3%海藻糖、3%蔗糖、1% BSA、0.4%Tween-20、0.03% Procline 300。样品缓冲液:50 mmol/L Na2B4O7·10H2O,200 mmol/L H3BO3。
1.3.2 荧光探针的制备
采用羧基化时间分辨荧光微球制备荧光探针,具体操作步骤如下[25]:将10 μL时间分辨荧光微球均匀分散在1 mL活化液中,依次加入50 μL EDC溶液(0.5 mg/mL)和50 μL NHS溶液(0.5 mg/mL),超声混匀,放置摇床振荡(200 r/min)室温活化15 min,14 000 r/min离心20 min弃上清液;复溶于1 mL偶联缓冲液中,超声振荡,使荧光微球重悬;加入抗体,放置摇床振荡室温反应30 min;随后加入20 μL封闭液,放置摇床振荡室温封闭反应60 min,离心弃上清液;用200 μL荧光微球复溶液复溶,4 ℃保存。
1.3.3 荧光免疫层析试纸条的组装
试纸条由样品垫、硝酸纤维素膜(NC膜)、吸水纸和PVC底板4个部分组成[26],如图1a所示。在NC膜上喷涂(0.8 μL/cm)OTA-OVA和AFB1-OVA分别作为检测线(T1线和T2线),羊抗鼠IgG作为质控线(C线),包被后置于37 ℃的鼓风干燥箱中烘12 h;将样品垫、吸水纸、NC膜与PVC底板进行组装,切成宽3.05 mm的试纸条后避光干燥备用。
1.3.4 检测步骤和结果判定
取100 μL样品缓冲液或待测样品液,加入含有荧光探针的微孔中吹打混匀,37 ℃孵育3 min;将试纸条插入微孔(图1a),37 ℃反应7 min,随后对荧光层析试纸条进行检测分析。
反应结束后30 s内,将荧光层析试纸条插入荧光读数仪读取结果(图1c),由荧光读数仪读取T1、T2线和C线的荧光信号值,并得出以B0为阴性样本的T/C值,以B为阳性样本的T/C值。
紫外灯下,通过肉眼判断定性结果(图1b),当含有一定浓度待测物时,荧光探针先与待测物结合且无多余特异性位点与T线上的包被抗原结合,结合形成的荧光探针-待测物复合物被C线上的羊抗鼠IgG截留,故T线不显线,C线显红色荧光,则结果为阳性,用“+”表示;相反,当无待测物时,部分荧光探针被T线上的包被抗原截留,多余的荧光探针与C线上的羊抗鼠IgG结合,故T线和C线均显红色荧光,结果为阴性,用“-”表示。

图1 TRFICA试纸条检测原理(a)、定性检测(b)和定量检测(c)Fig. 1 Schematic diagrams of the principle of TRFICA strip for detection of two mycotoxins (a), and their qualitative detection (b) and quantitative detection (c)
1.3.5 荧光免疫层析试纸条检测条件优化
1.3.5.1 荧光微球活化pH值的选择
用NaOH溶液(1 mol/L)将活化液的pH值调至6.5、6.0、5.5、5.0,在不同pH值条件下按照步骤1.3.2节活化荧光微球,分别加入抗体(AFB1-Mab为4.90 μg,OTA-Mab为3.24 μg)进行偶联,根据试纸条的T1、T2线和C线荧光强度,选择荧光强度最强且消线效果明显的为最适pH值[26]。
1.3.5.2 偶联荧光微球的抗体用量选择
在最优荧光微球活化的pH值条件下,按1.3.2节步骤对偶联荧光微球的抗体用量进行优化制备荧光探针,AFB1-MAb的量设定为1.78、2.50、3.50、4.90 μg,OTAMAb的量设定为0.96、1.44、2.16、3.24 μg。根据试纸条的T1、T2线和C线的荧光强度,选择荧光强度强且消线效果明显的为偶联荧光微球的抗体最佳用量[24]。
1.3.5.3 抗体-荧光探针用量的选择
在最优pH值和偶联荧光微球的抗体最优用量条件下,按1.3.3节步骤制备试纸条,并分别取不同浓度的探针进行检测,AFB1荧光探针的量设定为4、5、6、7、8 μL,OTA荧光探针的量设定为1、2、3、4、5 μL[26]。根据试纸条的T1、T2线和C线荧光强度,选择荧光强度强且消线效果明显的荧光探针用量确定为最佳探针用量。
1.3.5.4 检测线上包被抗原质量浓度的选择
在最优荧光探针制备与加入量的条件下,按1.3.3节步骤对T线上包被抗原的质量浓度进行优化。T1线上OTAOVA(1.38 mg/mL)质量浓度设为1.07、0.87、0.71、0.61、0.54 mg/mL,T2线上AFB1-OVA(4.28 mg/mL)质量浓度设为1.38、0.83、0.41、0.28、0.21 mg/mL[25]。通过荧光免疫层析定量分析仪测定,选择无待测物时T线和C线显色明显,且添加待测物时抑制率高的为T1和T2线最佳抗原质量浓度。
1.3.5.5 质控线上羊抗鼠IgG质量浓度的选择
在最优荧光探针制备与加入量的条件下,按1.3.3节步骤对C线上羊抗鼠IgG的质量浓度进行优化。羊抗鼠IgG的质量浓度设为0.25、0.20、0.17、0.14、0.12 mg/mL[28]。通过读数仪测定,选择无待测物时T线和C线显色明显,且添加待测物时抑制率高的为C线羊抗鼠IgG最佳浓度。
1.3.6 样品前处理条件优化
玉米粉碎过20 目筛,分装避光保存。选取经高效液相色谱检测不含AFB1和OTA的玉米样品作为空白样品。
1.3.6.1 提取溶液的选择
准确称取1.0 g玉米粉样品,分别加入5 mL乙酸乙酯、乙腈、无水甲醇和甲醇-水(70∶30,V/V)提取剂,充分振荡5 min,室温4 000 r/min离心5 min;取100 μL上清液,用样品缓冲液稀释4 倍,制得待测样品液[26]。
1.3.6.2 提取时间的选择
准确称取空白及加标的1.0 g玉米粉样品,加入5 mL甲醇提取剂,分别充分振荡3、5、7 min和10 min,室温4 000 r/min离心5 min;取100 μL上清液,用样品缓冲液(0.2 mol/mL PB,pH 7.4)稀释4 倍[26],制得待测样品液。
1.3.7 荧光免疫层析检测方法的评价
1.3.7.1 灵敏度评价
按1.3.6节步骤制备得到空白样品液,分别加入AFB1标准品(100.00、33.33、11.11、3.70、1.23、0.41、0.14、0 μg/kg),OTA标准品(150.00、50.00、16.57、5.55、1.85、0.65、0.21、0.5、0 μg/kg),以1.3.5节步骤选择的最佳测定条件进行测定。通过肉眼直接进行定性检测,使T1线和T2线消失的最小药物浓度,分别确定为AFB1和OTA的可视检测限(visible limit of detection,vLOD)[27-28]。使用荧光读数仪得到检测结果,以B/B0为纵坐标,真菌毒素浓度的对数值为横坐标,通过Origin 9.0绘图软件分别建立AFB1和OTA的标准曲线。定量限为20 个空白样品检测平均值与3 倍标准差[29]。
1.3.7.2 特异性评价
以交叉反应率(cross-reactivity,CR)评价该方法的特异性。以其他常见真菌毒素作为交叉药物,如AFB2、AFG1、AFG2、AFM1、AFM2、OTB、OTC、DON、ZEN、FB1和T-2。将交叉药物配成梯度系列标准浓度,按1.3.5节最佳条件用荧光免疫层析定量分析仪进行测定,得出各竞争物的半抑制浓度(half inhibition concentration,IC50),并按下式计算CR[26]:

式中:IC50为根据标准曲线拟合的半抑制浓度/(μg/kg)。
1.3.7.3 添加回收实验
对玉米空白样品添加低、中、高3个不同浓度的AFB1和OTA混合溶液,按1.3.5节最优条件进行样品前处理后,按1.3.4节进行检测,根据标准曲线进行定量,并计算加标回收率评价该方法的准确度,计算变异系数评价精确度[25]。
1.3.7.4 稳定性实验
稳定实验可以作为判断试纸条能否长期稳定贮存的依据[29]。本研究将制好的荧光试纸条和铺有荧光探针的酶标微孔置于铝箔袋内,加入干燥剂,抽真空密封,置于37 ℃进行加速老化实验。在第1、7、15天分别取出试纸条,并按照1.3.7.1节分别对试纸条的灵敏度进行评价。
1.3.7.5 仪器法比对
取30 份玉米样品(均有不同水平的AFB1和OTA混合污染),分别采用本研究所建立的TRFICA和国标的高效液相色谱法[30-31]2 种检测方法进行检测,并对检测结果的一致性进行分析。
色谱条件:色谱柱为C18柱(4.6 mm×150 mm,2.7 μm);流动相由5 mmol/L乙酸溶液(流动相A)和甲醇溶液(流动相B)组成;流速0.8 μL/min;柱温35 ℃;进样量10 μL;多反应监测模式;梯度洗脱:0~5 min,95%~10% A、5%~90% B;5~7 min,10% A、90% B;7~10 min,95% A、5% B。
2 结果与分析
2.1 荧光探针的鉴定
通过电子显微镜对荧光探针进行扫描,荧光微球呈圆球形(图2a),无异形颗粒,大小均一,直径大约为200 nm。标记抗体后,微球周围有明显的蛋白晕环(图2b),且结构完整,表明抗体已成功标记在荧光微球表面。

图2 时间分辨荧光微球的透射电子显微镜扫描图Fig. 2 SEM images of fluorescent microspheres
2.2 TRFICA的优化
2.2.1 标记荧光微球的最佳活化pH值
在抗体标记荧光过程中,荧光微球的活化pH值影响荧光探针制备效率和抗体活性。若pH值与抗体浓度适宜时,能提高活化效率,有利于抗体与荧光微球的共价结合。本研究采用不同pH值的MES缓冲液作为活化液,在同样检测条件下(根据预实验结果,选择以下检测条件:C线0.1 mg/mL,T1线0.41 mg/mL,T2线0.61 mg/mL),选择阴性T线显色强度高,阳性T线褪色明显作为最佳条件。结果如图3所示,随着pH值的升高,T线显色逐渐明显,当pH值为6.0时为最佳效果,但pH 6.5时显色强度降低,故本研究选择活化pH值为6.0。

图3 荧光微球活化pH值对显色结果的影响Fig. 3 Effects of different pH values for fluorescent microsphere activation on results of color development
2.2.2 标记荧光微球的最佳抗体用量
在抗体标记过程中,抗体的标记用量是影响荧光探针制备效率和抗体活性的另一重要因素。若偶联时的抗体浓度过高,没有与微球结合的过量抗体会与T线的包被抗原、C线的羊抗鼠IgG竞争结合,影响结果的判断,造成假阴性,降低试纸条的检测灵敏度。本研究采用不同用量的抗体与等量荧光微球偶联,在同样检测条件下(根据预实验结果,选择以下检测条件:C线0.1 mg/mL,T1线0.41 mg/mL,T2线0.61 mg/mL),随着标记抗体量越大,T线显色越清晰(图4),但AFB1-MAb和OTA-MAb标记量分别超过3.50 μg和2.16 μg时,阳性试纸条的抑制效果降低,当标记量分别小于2.50 μg和1.44 μg时,T线显线不明显。因此,选择AFB1探针与OTA探针的标记抗体用量分别为3.50 μg和2.16 μg。

图4 标记微球抗体用量对显色结果的影响Fig. 4 Effect of different amounts of labeled microsphere antibody on results of color development
2.2.3 荧光探针用量
检测过程中,免疫荧光探针用量会影响检测灵敏度和阴阳性的判断。如图5所示,探针用量过低时,T线显色强度不够清晰,且易造成检测结果假阳性;探针过量时,探针上多余的结合位点,与T线上的包被抗原结合,造成检测结果假阴性,因此本研究对探针用量进行优化。紫外灯下肉眼观察,随着探针用量的减少,阴性试纸条的T线逐渐下降,且阳性试纸条消线明显,均有良好的抑制效果。故选择OTA荧光探针用量为2 μL,AFB1荧光探针用量为3 μL。

图5 荧光探针用量对显色结果的影响Fig. 5 Effect of fluorescent probe dosage on results of color development
2.2.4 包被抗原与羊抗鼠IgG质量浓度
包被在NC膜上的抗原与羊抗鼠IgG的质量浓度,会影响T线和C线的荧光强弱。高浓度的包被原使显色强度过大,导致灵敏度下降;反之包被质量浓度过低时,显色较弱,用肉眼定性检测时,难以识别。图6结果表明,随着包被抗原的质量浓度下降,紫外灯下肉眼观察到阴性试纸条T线显色强度逐渐变弱,T1线与T2随着包被抗原和羊抗鼠IgG的质量浓度增加,试纸条的荧光强度逐渐增强,且C线的显色均一。荧光读数仪测定,结果如图7所示,阴性试纸条与阳性试纸条的T/C值比较平均,当T1包被抗原为0.71 mg/mL,T2包被抗原为0.41 mg/mL,羊抗鼠IgG为0.17 mg/mL,试纸条对OTA和AFB1的抑制率最高,分别为92.86%和93.92%。故最终选择OTA-OVA、AFB1-OVA与C线的羊抗鼠质量浓度分别为0.71、0.41 mg/mL和0.17 mg/mL。
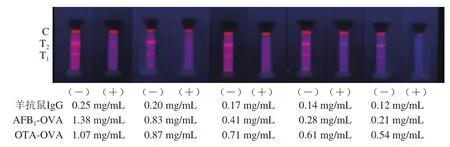
图6 包被抗原质量浓度与羊抗鼠IgG质量浓度对显色结果的影响Fig. 6 Effects of coating antigen concentration and goat anti-mouse IgG concentration on results of color development

图7 不同包被抗原质量浓度的优化结果(荧光仪读数)(n =3)Fig. 7 Optimization of coating antigen concentrations (n = 3)
2.2.5 样品前处理条件优化
优化样品前处理条件可以使样品提取液对试纸条的基质干扰减至最小,且保持其灵敏度,使空白测定结果与缓冲液测定结果接近,因此本研究对前处理的提取液与提取时间进行优化。对比乙酸乙酯、乙腈、无水甲醇和甲醇-水溶液(70∶30,V/V)4 种提取液,加标量为10 ng/g AFB1与10 ng/g OTA混合液的空白玉米样品的回收率(图8a),甲醇-水溶液的提取效果最好,基制干扰小,玉米样品添加回收率高达93%。
使用甲醇-水溶液作为提取剂,分别对比提取时间3、5、7 min和10 min的提取效果(图8b),加标为5 ng/g AFB1与5 ng/g OTA混合液的空白玉米样品,提取时间为5、7、10 min的回收率为96%左右,为缩短检测时间达到快速检测的目的,确定玉米样品的提取液为甲醇-水(70∶30,V/V),提取时间为5 min。

图8 样品前处理条件优化(n=3)Fig. 8 Optimization of sample pretreatment conditions (n = 3)
2.3 试纸条性能评价
2.3.1 灵敏度
在优化条件下进行检测,用肉眼进行判读,AFB1和OTA的vLOD分别为3.70 μg/kg和5.55 μg/kg(图9)。通过荧光读数仪读取药物浓度梯度稀释系列的T/C数值,计算出B/B0,利用Origin 8.5的四参数拟合模块拟合AFB1和OTA标准曲线(图9),得到IC50分别为1.58 μg/kg和3.91 μg/kg,检测范围(IC20~IC80)分别为0.26~9.73 μg/kg和1.14~13.29 μg/kg,定量限分别为0.03、0.07 μg/kg(表1)。

表1 本方法检测玉米中AFB1和OTA的性能参数(n=3)Table 1 Analytical figures of merit of TRFICA for AFB1 and OTA in corn samples (n = 3)
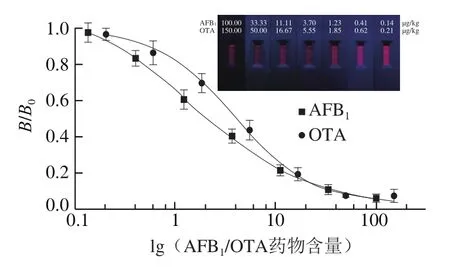
图9 AFB1与OTA标准曲线与实物图(n=3)Fig. 9 Standard curves for determination of AFB1 and OTA and results of color development in strips (n = 3)
2.3.2 特异性
分别取AFB1和OTA和几种常见真菌毒素进行检测,按1.3.7.1节建立各种真菌毒素的标准曲线,计算得到IC50和CR。由于抗体的特异性依赖于抗原的结构,抗原的结构相似时会导致抗体的交叉反应,因此本方法与其他类似真菌毒素存在一定的交叉反应。如表2所示,与AFB2、AFM1的交叉率达到60%以上,与AFG1交叉率为38%,与AFG2、AFM2为20%以下。与其他常见真菌毒素,如DON、ZEN、FB1和T-2均无明显交叉反应。本方法与OTB交叉反应率为58%,与其他常见真菌毒素均无明显交叉反应。
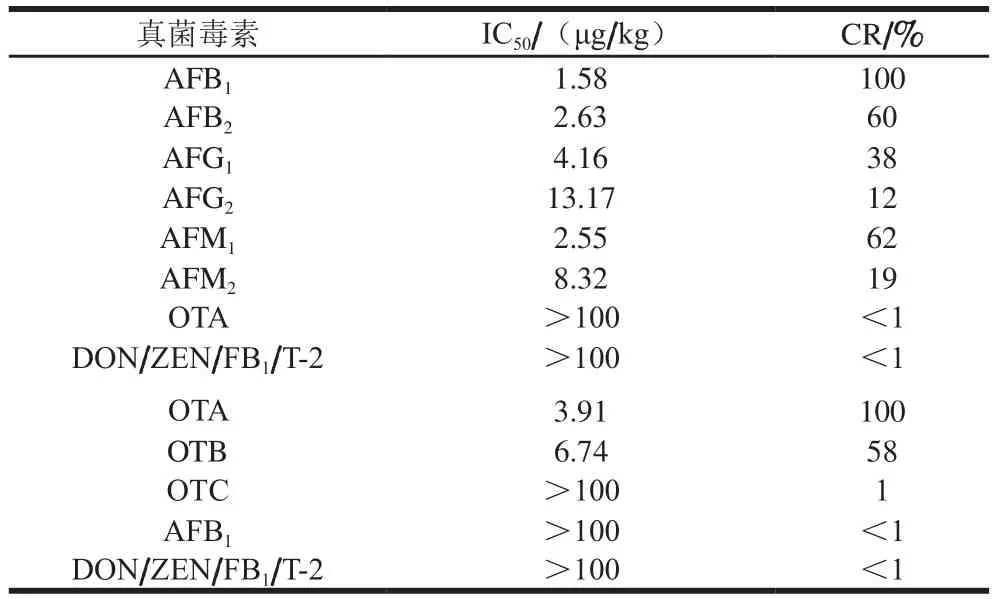
表2 本方法试纸条的交叉反应实验结果(n =3)Table 2 Cross-reactivity of TRFICA (n = 3)
2.3.3 添加回收实验结果
用试纸条对添加不同含量AFB1和OTA混合溶液的空白玉米样品进行检测,通过回收率和变异系数评估其准确度和精确度。如表3所示,AFB1和OTA的回收率在92%~103%之间,变异系数均小于15%。故此检测方法的准确度和精确度较高,可以满足实际检测的要求。

表3 本方法的回收率和变异系数=3)Table 3 Recoveries and coefficients of variation of TRFICA (n = 3)(n
2.3.4 稳定性实验结果
在加速老化实验中,考虑时间和温度2个因素,试纸条有效期的确定常用37 ℃有效期的10 倍,随着高温保存时间的延长,试纸条和荧光探针上的蛋白都开始老化,在接近保质期限时,灵敏度会逐渐减少至0。若一段时间荧光强度与灵敏度基本不变,说明试纸条的稳定性良好[29]。分别用在鼓风干燥箱中放置1、7 d和15 d的试纸条进行检测。如表4所示,3 次测定结果相近,灵敏度与检测范围变化不大,且性能都符合残留检测的要求,故该荧光免疫层析试纸条稳定性较好,可在4 ℃有效保存5个月以上。
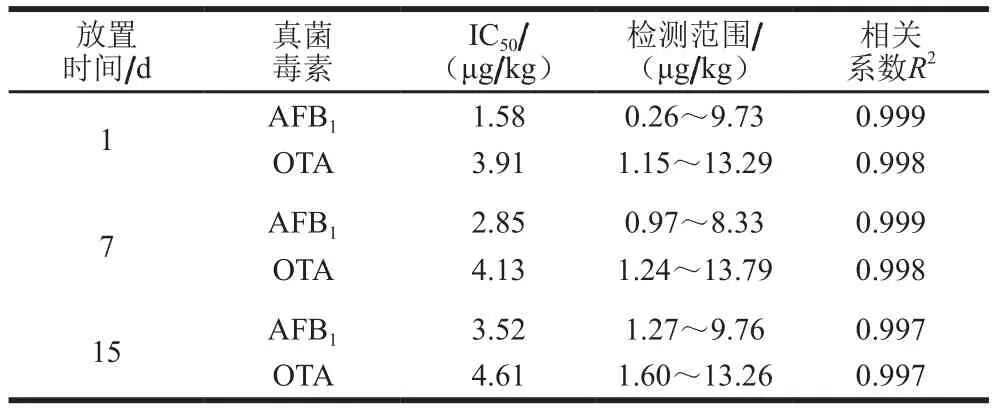
表4 TRFICA试纸条的稳定性实验Table 4 Stability of TRFICA strip
2.3.5 与其他检测方法的比较
将本研究建立的TRFICA与GB 5009.96—2016《食品中赭曲霉毒素A的测定》和GB 5009.22—2016《食品中黄曲霉毒素B族和G族的测定》的高效液相色谱法和胶体金免疫层析法进行比对,检测样品为不同水平真菌毒素污染的玉米样品。如表5和图10所示,本方法与高效液相色谱检测结果的相关性良好(R2>0.9),结果一致,胶体金免疫层析法检测出阴、阳性结果相当,定性结果符合率为100%。而TRFICA检测过程只需20 min,且配合荧光读数仪使用可提高定量检测结果的速度与准确度。因此本研究建立的TRFICA可有效完成大规模样品的筛查,节约检测时间,具有较好的实用性。

图10 本方法与高效液相色谱法对30 个玉米样本的相关性分析Fig. 10 Correlation of TRFIA with HPLC results for 30 corn samples
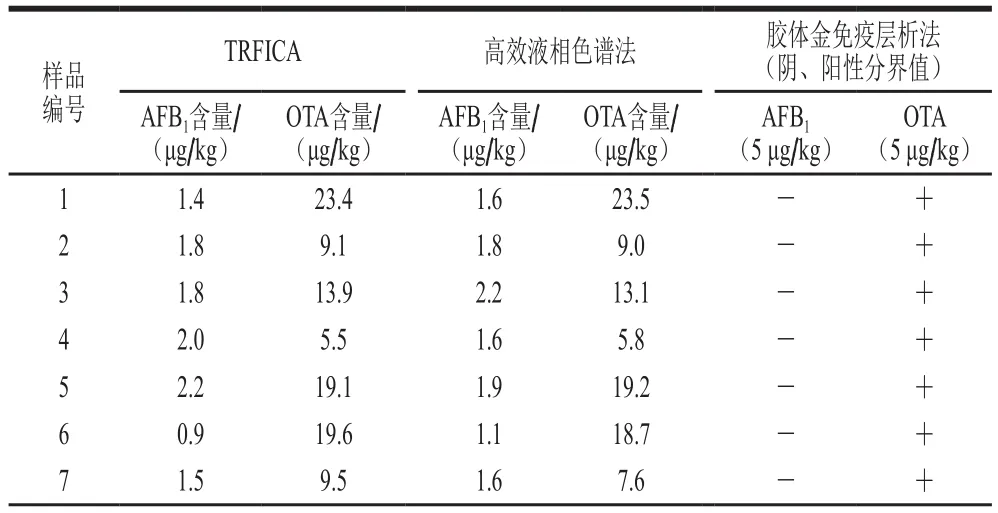
表5 高效液相色谱法、胶体金免疫层析法与本方法检测=3)Table 5 Results of determination of AFB1 and OTA in real samples by TRFICA, HPLC and GICA (n = 3)实际样品中的AFB1和OTA(n
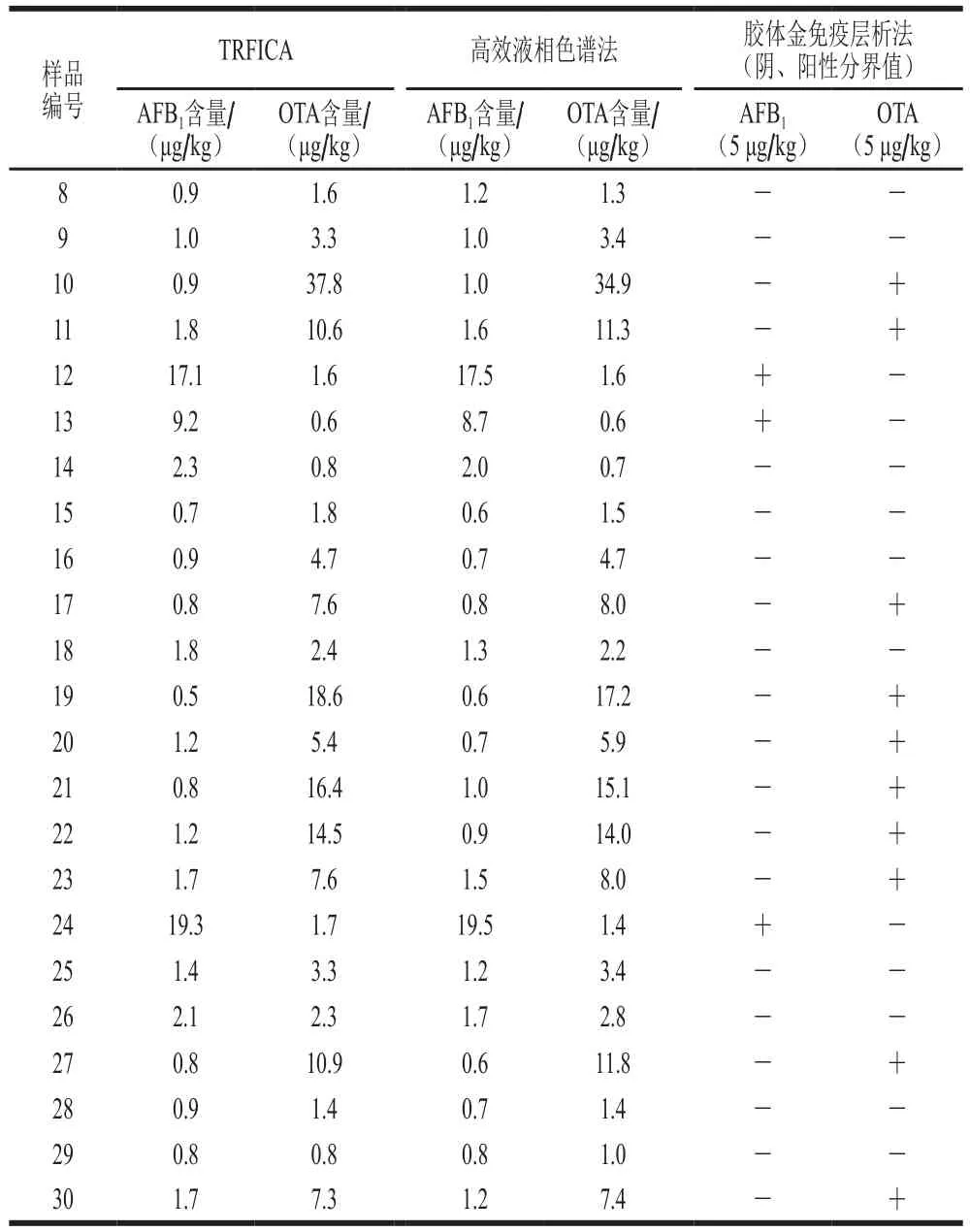
续表5
3 结 论
本研究建立一种可同时快速定量检测AFB1和OTA的二联TRFICA试纸条,并经过样品前处理的优化,AFB1和OTA在玉米样品中的vLOD分别为3.70、5.55 μg/kg,IC50分别为1.58、3.91 μg/kg,线性范围分别为0.26~9.73,1.14~13.29 μg/kg,检测时间只需20 min,操作简单快速。本研究方法对其他黄曲霉毒素和其他赭曲霉毒素存在一定交叉反应,与黄曲霉毒素类似物交叉率为12%~62%,与OTB交叉率为58%,适用于对样品中的黄曲霉毒素和赭曲霉毒素含量进行筛查。优化样品前处理后,添加回收率在92%~103%之间,变异系数小于15%,且与国标规定的高效液相色谱法检测结果相关性良好(R2>0.9)。在实际样品的检测实验中,本方法比高效液相色谱检测时间短且操作简便,和市售胶体金免疫层析试纸检测相比,能够定量检测,实现痕量分析,3种检测方法检测结果一致,表明本研究的TRFICA试纸结果精准可靠。通过稳定性实验,确定该试纸条有较强的稳定性,在4 ℃可稳定保存5个月以上。
本研究制备的TRFICA快速、简便、成本低,适合用于大批量样品的现场快速检测,结合便携式的荧光免疫层析定量分析仪,既可定性又可定量,具有重要的研究意义和应用价值。但对于实际样品的检测应用,目前只优化出玉米样品的前处理,对于其他谷物如小麦和燕麦等的样品提取还需要进一步研究。而对黄曲霉毒素类似物存在较高交叉反应,后续也可以考虑建立样品中黄曲霉毒素总量和赭曲霉毒素总量的检测方法。
