多酶级联催化合成(R)-β-酪氨酸
2022-01-26宋伟王金辉胡贵鹏陈修来刘立明吴静
宋伟,王金辉,胡贵鹏,陈修来,刘立明,吴静
(1 江南大学药学院,江苏 无锡 214122; 2 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122)
引 言
β-酪氨酸是非蛋白氨基酸,在自然界中较少见,主要存在于海洋生物和陆地原核生物产生的许多次级代谢物中[1-3]。近年来,关于多种β-酪氨酸衍生物的药理学和构象特性研究较多,其表现出多种生物活性[4]。例如,含有(R)-β-酪氨酸结构的环肽Jasplakinolide 和Chondramide 具有非常突出的抗肿瘤活性;(S)-β-酪氨酸是抗生素依地碱A(Edeine A)的关键结构单元(图1)[5-7]。因此,β-酪氨酸及其衍生物的不对称合成引起了人们广泛的关注。
β-酪氨酸的合成方法主要包括以下几种途径[8]:(1)α-氨基酸的Arndt-Eistert 同系化[9];(2)酶法拆分[10];(3)立体选择性Mannich 反应[11];(4)胺与同手性α,β-不饱和脂肪酸的共轭加成[12];(5)N-苄基羟胺与亚酰胺的加成反应[13];(6)β-氨基巴豆酸盐[14]或β-酰氨基丙烯酸盐[15]的催化还原;(7)同手性硝基化合物的偶极环加成等[16]。其中,同手性胺基锂介导的α-甲基苄胺与α,β-不饱和脂肪酸的共轭加成可以用作不对称合成β-酪氨酸及其衍生物的一般途径。例如:Davies 等[17]使用n-BuLi 为催化剂,以(S)-N-苄基-N-α-甲基苄胺和肉桂酸酯衍生物为底物,在THF 和-78℃条件下合成了氨基和羧基被保护的β-酪氨酸,ee 值>95%,产物得率为63%。Yamagiwa等[18]以Li 配合物为催化剂,以N-吡咯酰基-肉桂酸酯衍生物和酰胺为底物,在THF 和-30℃条件下合成了氨基和羧基被保护的β-酪氨酸类似物,ee 值81%~82%,产物得率53%~63%。然而,目前报道的这些方法需要较为复杂的底物而且大多依赖于贵金属催化剂,反应产物需要进一步脱去保护基团才能获得目标化合物。为了有机合成工业的可持续发展,以酶转化法为代表的绿色合成方法越来越受到人们的欢迎和重视[19]。多酶级联为一些化合物合成困难的问题提供了可靠的解决方案,因此被越来越多的合成化学家们所关注[20-21]。多酶级联能够使用一些廉价化合物作为初始底物,经过多酶之间的协同合作,促使反应朝向终产物进行,有助于提高整体转化效率和最终产量[21-24]。多酶级联被广泛地应用于有机合成领域[25-30],包括苯丙酸类化合物的合成,如酪氨酸衍生物[31-34]和苯丙氨酸衍生物[35]等。尽管上述策略可以合成一些苯丙酸类化合物,但是目前鲜有多酶级联合成β-酪氨酸的文章报道。
C—H 功能化介导的小分子不对称组装是合成非天然氨基酸最具潜力的合成途径。因此,通过生物催化逆合成分析可知,(R)-β-酪氨酸可由L-酪氨酸通过α-NH2变位获得,而L-酪氨酸可通过苯酚、丙酮酸和游离铵根的C—C 偶联和选择性氨化获得。于是,基于小分子不对称组装,本研究设计了如图2 所示的级联路径:首先利用酪氨酸酚裂解酶(TPL)将苯酚、丙酮酸和NH+4转化为具有α-NH2的L-酪氨酸;随后,再通过引入酪氨酸氨基变位酶(TAM)将L-酪氨酸的α-NH2转变为β-NH2生成(R)-β-酪氨酸。本研究将酪氨酸酚裂解酶(TPL)和酪氨酸氨基变位酶(TAM)级联,以苯酚、丙酮酸和铵盐等廉价化合物为底物,合成了(R)-β-酪氨酸,为(R)-β-酪氨酸的绿色酶法生产提供了理论指导。
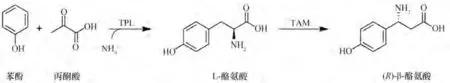
图2 合成(R)-β-酪氨酸级联路径设计Fig.2 Design the cascade route for the synthesis of(R)-β-tyrosine
1 实验材料和方法
1.1 材料
1.1.1 菌种和质粒 所用的克隆宿主(Escherichia coliJM109)和表达宿主(Escherichia coliBL21)购自Invitrogen公司;Citrobacter freundii菌株为本实验室保藏。所用的质粒包括单T7lac 启动子(pET28a)和双T7lac 启动子(pRSFDuet-1、pACYCDuet-1、pETDuet-1、pCDFDuet-1),均购自Invitrogen公司。
1.1.2 培养基 LB 培养基:10 g/L 蛋白胨,5 g/L 酵母粉,10 g/L NaCl;121℃灭菌15 min。
TB 培养基:12 g/L 蛋白胨,24 g/L 酵母粉,4 g/L甘油,2.31 g/L KH2PO4,12.54 g/L K2HPO4;121℃灭菌15 min。
1.1.3 试剂 使用限制性内切酶、DNA 聚合酶、T4 DNA 连接酶、DNA Maker 和SDS-PAGE Protein Marker 等购自TaKaRa(大连)有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、抗生素、胶回收试剂盒、质粒提取试剂盒、磷酸吡哆醛(PLP)、Tris购自生工生物工程(上海)股份有限公司;基因组提取试剂盒购自天根生化科技(北京)有限公司;酵母粉、蛋白胨购自英国OXIOD 公司;苯酚、丙酮酸钠、L-酪氨酸、(R)-β-酪氨酸购自上海阿拉丁生化有限公司;PCR 引物由苏州金唯智生物科技有限公司合成;其他试剂购自国药集团化学试剂有限公司。
1.1.4 仪器 所使用的主要仪器有:Agilent 1260高效液相色谱、恒温培养箱、SpetraMax M3多功能酶标仪、超净工作台、XD-650D 超声破碎仪、BIORAD Thermal Cycler PCR 仪、核酸电泳仪、Invitrogen iBright智能成像系统、全自动凝胶成像系统等。
1.2 重组菌的构建
1.2.1 DNA 基本操作 基因组的提取、质粒提取、酶切、连接、定点突变、感受态细胞的制备和转化等按照试剂盒的说明书进行相关操作。
1.2.2 重组菌株的构建 单酶表达菌株构建方法:(1)基因组提取;(2)PCR 扩增目的片段;(3)表达载体提取;(4)双酶切和胶回收;(5)酶切回收片段的连接;(6)测序验证;(7)提取测序正确的重组质粒,导入宿主菌;(8)蛋白电泳和酶活检测,验证目的基因是否正确表达。
共表达菌株的构建方法:扩增TcTAMC107S,L104A基因,用EcoRI和SalI双酶切pETDuet-1质粒和扩增出的TcTAMC107S,L104A基因片段,然后经过连接构建重组质粒pETDuet-1-TcTAMC107S,L104A。 接下来扩增TPLM379V基因,用BglII 和XhoI 双酶切pETDuet-1-TcTAMC107S,L104A质粒和扩增出的TPLM379V基因片段,然后经过连接构建重组质粒pETDuet-1-TcTAMC107S,L104ACfTPLM379V。随后用EcoRI和XhoI分别双酶切表达质粒pACYCDuet-1、pCDFDuet-1、pRSFDuet-1 以及重组质粒pETDuet-1-TcTAMC107S,L104A-CfTPLM379V。将得到的TcTAMC107S,L104A-CfTPLM379V基因片段,与具有相同黏性末端的表达质粒片段分别进行连接。随后,把构建好的重组质粒分别导入表达宿主,成功构建四种重组表达菌株。
重复表达菌株的构建:扩增TcTAMC107S,L104A基因,用SalI和HindIII双酶切pRSFDuet-1-TcTAMC107S,L104ACfTPLM379V质粒和扩增出的TcTAMC107S,L104A基因片段,然后经过连接构建了重复表达质粒:pRSFDuet-1-TcTAMC107S,L104A-TcTAMC107S,L104A-CfTPLM379V。随后,把构建好的重组质粒导入表达宿主,构建TcTAMC107S,L104A重复表达的工程菌。
所使用的引物如表1 所示,所构建的表达菌株如表2所示。
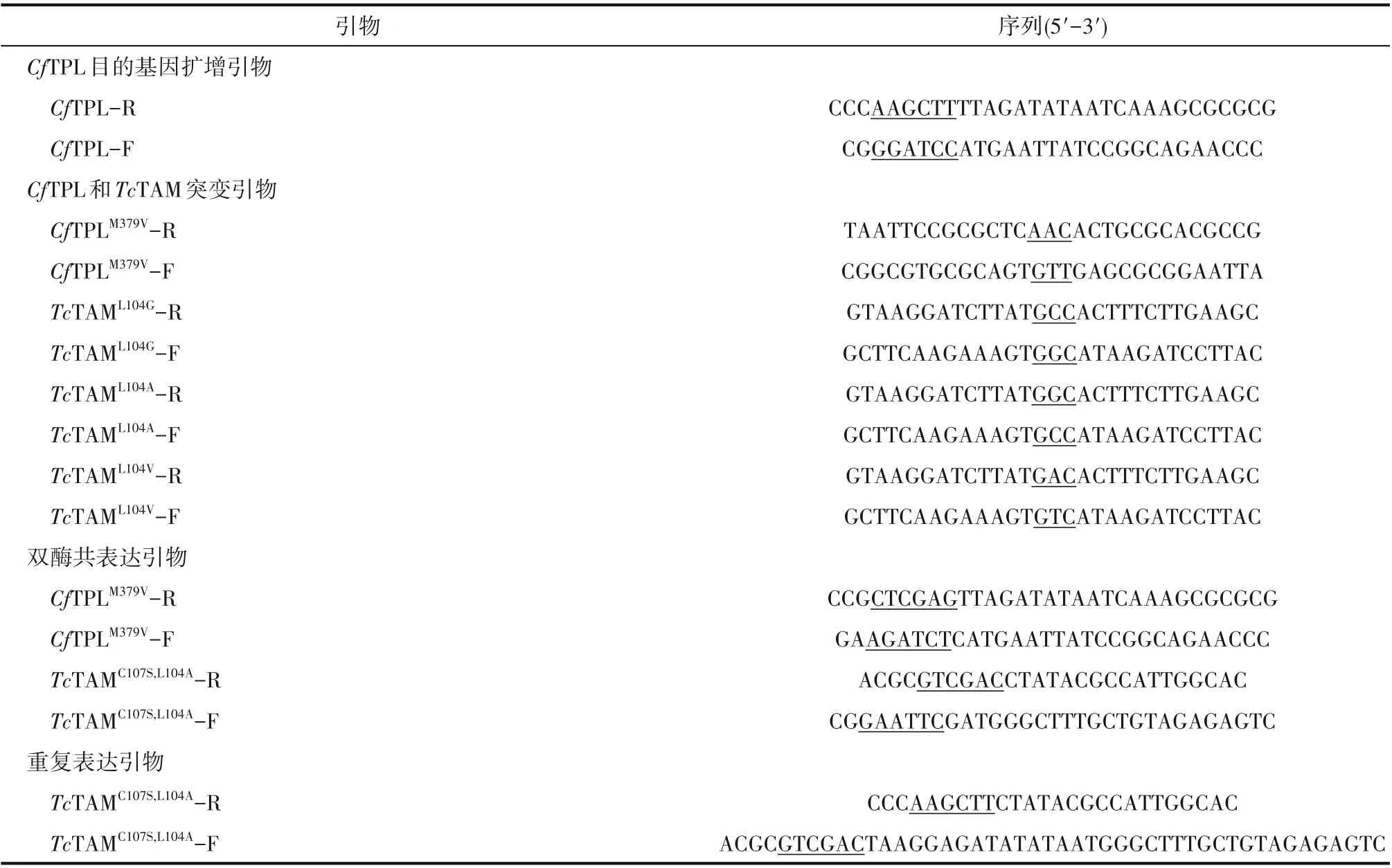
表1 所使用的引物Table 1 The primers used in this study

表2 所构建的重组菌株Table 2 The recombinant strains constructed in this study
1.2.3 重组菌株的培养方法 从平板中挑取重组大肠杆菌单菌落,接种至LB 培养基中,根据表达载体的抗性基因,添加适宜的抗生素(100 mg/L 氨苄霉素、50 mg/L 氯霉素、50 mg/L 卡那霉素、50 mg/L 链霉素或者它们的组合;过滤除菌)。在200 r/min、37℃条件下培养8 h 后,转接至含相同抗生素的100 ml的TB 培养基中(接种量1%)。在相同条件下培养至菌种OD600为0.6~0.8 时,在培养基中加入过滤除菌后的IPTG(终浓度为0.4 mmol/L)进行诱导。然后将培养温度降至20~25oC 进行诱导,继续培养12 h,待蛋白充分表达,离心收集湿菌体。
1.3 转化条件优化
(1)温度优化:在25、30 和37oC 的温度条件下分别进行转化实验,考察转化温度对(R)-β-酪氨酸产量的影响,确定最优转化温度。1 ml反应体系:苯酚1 mmol/L、丙酮酸钠2 mmol/L、氯化铵8 mmol/L、PLP 50 μmol/L、E. coliS10 湿菌体50 g/L、Tris-HCl 缓冲液(pH 8.0,含5% DMSO)100 mmol/L。于200 r/min反应2 h 后,12000 r/min 离心10 min,通过HPLC 检测上清液中(R)-β-酪氨酸的浓度。
(2)pH 优化:在pH 7.0~10.0 的条件下分别进行转化实验,考察转化pH对(R)-β-酪氨酸产量的影响,确定最优转化pH。1 ml反应体系:苯酚1 mmol/L、丙酮酸钠2 mmol/L、氯化铵8 mmol/L、PLP 50 μmol/L、E. coliS10 湿菌体50 g/L、Tris-HCl 缓冲液(pH 7.0~10.0,含5% DMSO)100 mmol/L。于25℃和200 r/min反应2 h 后,12000 r/min 离心10 min,通过HPLC 检测上清液中(R)-β-酪氨酸的浓度。
(3) 菌体浓度优化:在10~50 g/L 菌体浓度下分别进行反应,考察菌体用量对(R)-β-酪氨酸产量的影响,确定最优菌体浓度。1 ml 反应体系:苯酚1 mmol/L、丙酮酸钠2 mmol/L、氯化铵8 mmol/L、PLP 50 μmol/L、E.coliS10 湿菌体10~50 g/L、Tris-HCl 缓冲液(pH 9.0,含5% DMSO)100 mmol/L。于25℃、200 r/min 反应2 h 后,12000 r/min 离心10 min,通过HPLC检测上清液中(R)-β-酪氨酸的浓度。
1.4 分析检测方法
1.4.1 酶活检测
(1)PAL 活力检测:将10 mg 表达PAL 的大肠杆菌全细胞加入到1 ml(100 mmol/L Tris-HCl,pH 8.0)包含70 mmol/L 苯酚、140 mmol/L 丙酮酸钠、560 mmol/L 氯化铵、50 μmol/L PLP 的反应体系中检测酶活。于25℃反应5 min 后,12000 r/min 离心10 min取上清液,通过HPLC 检测L-酪氨酸生成量。酶活单位(1 U):在单位时间(1 min)内生成1 μmol L-酪氨酸所需的酶量。
(2)TAM 活力检测:将10 mg表达TAM 的大肠杆菌全细胞加入到1 ml(100 mmol/L Tris-HCl,pH 8.0)包含2 mmol/L L-酪氨酸的反应体系中检测酶活。于25℃反应5 min 后,12000 r/min 离心10 min 取上清液,用HPLC 检测(R)-β-酪氨酸生成量。酶活单位(1 U):在单位时间(1 min)内生成1 μmol(R)-β-酪氨酸所需的酶量。
1.4.2 产物浓度和对映选择性分析
(1)浓度的测定:取转化液12000 r/min 离心10 min,收集上清液,HPLC 测定L-酪氨酸和(R)-β-酪氨酸的含量。检测条件:色谱柱:Agilent SB-AQ C18 (250 mm×4.6 mm,5 μm);流动相A:10 mmol/L KH2PO4溶液(pH 5.3);流动相B:乙腈/甲醇/A相=5∶3∶1(体积比;pH 5.3);流速:1 ml/min;柱温:35℃;荧光检测器:激发波长330 nm,发射波长465 nm。
(2) ee 值的测定:取转化液12000 r/min 离心10 min,收集上清液,HPLC 测定L-酪氨酸和(R)-β-酪氨酸的ee 值。检测条件:色谱柱:Daicel Crownpak CR-I(+)(150 mm×3 mm,5 μm);流动相:高氯酸溶液/乙腈(80/20,体积比;pH 1.5);流速:0.4 ml/min;柱温:25℃;紫外检测器:波长为210 nm。
1.4.3 产物纯化和产物鉴定 首先通过Dowex 50WX8 型阳离子交换树脂进行离子交换,得到的离交物为氨基酸混合物。然后,用磷酸盐缓冲液(90 mmol/L,pH 7.0)溶解离交物,将得到的溶液与二氯甲烷溶液(含1 mmol/L 双三苯基磷二氯化钯)混合,体积比为1∶1。对混合溶液进行搅拌(12 h,6℃),然后进行沉降(大于30 min)分层,取水相冻干,再用乙醇溶液(90%)洗涤得到固体即可得到纯化产物。最后,使用高分辨质谱(HRMS)确定纯化产物的分子量是否与目标化合物一致,并使用核磁共振谱图(NMR)鉴定纯化产物的结构是否正确。
2 实验结果与讨论
2.1 TPL酶的挖掘
由于本研究设计的级联催化是由两个酶组成,任意一个酶存在缺陷均会影响级联反应的催化效率。因此,需要筛选高效率的目标酶元件。本研究通过对Brenda数据库进行数据挖掘和基因挖掘,筛选了6种不同来源的TPL(表3)。通过对比分析这六种来源的TPL的比酶活,发现来源于弗式柠檬杆菌(Citrobacter freundii)的TPL比酶活最高,为10.01 μmol/(min·mg)。根据文献报道,Seisser 等[36]对CfTPL 进行了蛋白质工程改造,通过以结构为导向的改造获得了突变体CfTPLM379V,该突变体具有较宽的底物谱,可以催化一系列的苯酚衍生物,具有较好的转化率(几乎完全转化)和对映选择性(ee 值>97%)。因此,本研究选择CfTPLM379V作为第一步反应的催化剂,来转化苯酚、丙酮酸和氯化铵合成L-酪氨酸。首先以C.freundii的基因组作为模板进行扩增,构建重组质粒pET28a-CfTPL。然后再以pET28a-CfTPL 为模板,进行定点突变,构建突变体质粒pET28a-CfTPLM379V,并通过基因测序验证突变点是否准确引入目标位点。将测序正确的重组载体导入表达宿主E. coliBL21 DE3,获得表达CfTPLM379V基因的重组大肠杆菌,命名为E.coliS01。为了验证目标蛋白是否能够正常表达,对E.coliS01 进行了培养和诱导,收集菌体后进行全细胞蛋白电泳。结果如图3 所示,CfTPLM379V在电泳图上显示出清晰的条带,与目标蛋白大小相符(约51.5 kDa),且酶活测试显示E. coliS01 湿细胞对苯酚的催化活力为0.086 U/mg,说明CfTPLM379V正确表达。
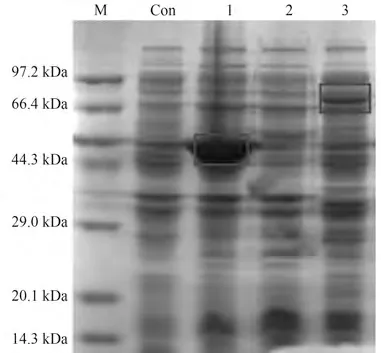
图3 蛋白电泳图Fig.3 SDS-PAGE analysis
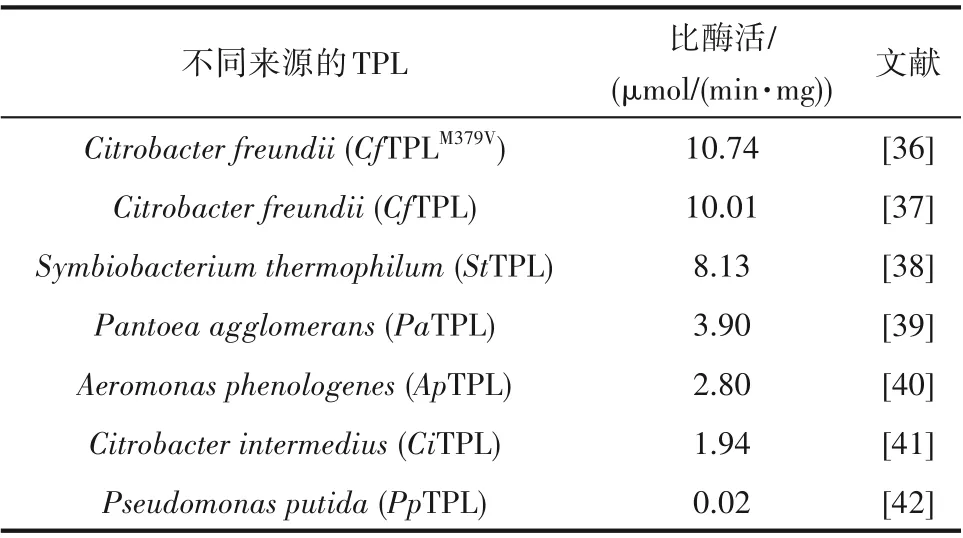
表3 不同来源的TPL及其比酶活对比Table 3 Comparison of TPLs from different strains and its specific enzyme activity
2.2 TAM酶的挖掘
通过文献检索发现关于TAM 酶的报道比较少。来源于球孢链霉菌(Streptomyces globisporus)[43]的SgTAM 催化效率和对映选择性较低,尽管该酶能够催化L-酪氨酸及其类似物,但会生成香豆酸及其类似物等副产物。番红软骨(霉)菌(Chondromyces crocatus)[44]来源的CcTAM 对映选择性较差;经过改造的突变体CcTAME399K[45]可将ee 值从70%提高到97%,但却大大降低了酶活。来源于水稻(Oryza sativa)[46]的OsTAM 具有对映选择性高、副产物少的优点,但其催化活性不高。而来源于南方红豆杉(Taxus chinensis)的TcTAM 具有良好的对映选择性,其改造后的突变体TcTAMC107S[47]对L-酪氨酸也表现出相对较好的催化活性。相关TAM 酶性质汇于表4。因此,通过活性和选择性的综合对比,选择TcTAMC107S作为多酶级联的第二步反应的酶。由于TcTAMC107S来源于红豆杉,不便于基因扩增,因此根据E.coliBL21(DE3)表达系统的密码子偏好性,对编码TcTAMC107S的基因进行密码子优化,通过全合成获得重组质粒pET28a-TcTAMC107S。将合成的重组质粒导入表达宿主E. coliBL21 DE3,获得表达TcTAMC107S基因的重组大肠杆菌,命名为E.coliS02。为了验证目标蛋白是否能够正常表达,通过全细胞蛋白电泳考察E. coliS02 的蛋白表达情况,结果如图3 所示,可清晰地观察到TcTAMC107S的蛋白条带,大小约75.2 kDa,与蛋白胶结果相符,说明TcTAMC107S正确表达。随后的酶活测试显示E. coliS02 湿细胞对L-酪氨酸的催化活力为0.004 U/mg。通过酶活数据对比分析发现,TcTAMC107S的酶活力远小于CfTPLM379V,转化数据也表明L-酪氨酸的催化效率较低。为了提高TcTAMC107S的催化效率,以高效地合成(R)-β-酪氨酸,遂对TcTAMC107S进行了蛋白质工程改造。如图4 所示,通过结构分析可以发现,TcTAM 结构(PDB ID:3NZ4)中的L104 残基与含苯环的底物香豆酸(TCA)存在空间冲突,那么该位点对更大体积的对香豆酸的空间冲突将更严重。为了消除空间位阻,本研究选择用具有较小侧链的氨基酸(缬氨酸、丙氨酸和甘氨酸)来替代L104残基,成功构建了三株突变菌株E. coliS03~S05。最优突变体TcTAMC107S,L104A(E. coliS04)对L-酪氨酸底物的初始反应速率达到59.8 μmol/(L·min),比TcTAMC107S(4.6 μmol/(L·min))提高了13倍。
2.3 路径组装构建全细胞催化剂
全细胞催化剂使用方便,无须对酶进行分离纯化,大大降低了成本。因此,将筛到的两个酶元件组装到一个菌株中,构建全细胞催化剂。首先,通过四个不同拷贝数的质粒(pACYCDuet-1、pCDFDuet-1、pETDuet-1 和 pRSFDuet-1) 对TcTAMC107S,L104A和CfTPLM379V的表达进行整体的调控。成功构建了四株共表达CfTPLM379V和TcTAMC107S,L104A重组菌株,将这四株菌株命名为E.coliS06~S09。通过全细胞蛋白电泳考察E. coliS06~S09 的蛋白表达情况,结果如图5(a)所示,可清晰地观察到两条目标蛋白条带,表明CfTPLM379V和TcTAMC107S,L104A共表达成功。随后,以苯酚、丙酮酸钠和氯化铵为底物,考察这四株菌株合成(R)-β-酪氨酸的能力。结果如图5(b)所示,在所构建的四株重组菌株中,E.coliS09的转化效果最好,但是最终转化率仅有62.1%。由上述结果可知,造成转化效率低的原因是TcTAMC107S,L104A的酶活较低。因此,为了进一步提高TcTAMC107S,L104A的酶活,基于E.coliS09 菌株重复表达TcTAMC107S,L104A基因以提高其表达量,构建了菌株E.coliS10,该菌株的转化率达到了74.0%。
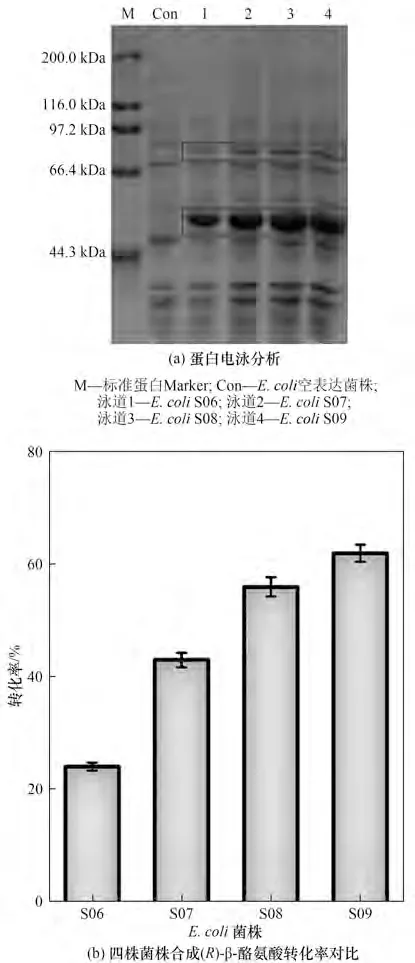
图5 (R)-β-酪氨酸合成菌株的构建Fig.5 Construction of(R)-β-tyrosine synthesis strain
随后,对转化条件进行优化以进一步提高转化率(图6),主要包括:温度、pH 与菌体浓度等条件的优化。首先考察了转化温度对转化率的影响,结果表明当转化温度为25℃时的转化率最高,达到了64%[图6(a)];接下来在pH 7.0~10.0 的范围内考察pH 对转化率的影响,发现最优pH 为9.0,此时转化率达到了73%[图6(b)];最后考察了菌体浓度对转化率的影响,在菌体浓度为50 g/L 时达到最大转化率(75%)[图6(c)]。因此,确定了最佳的转化条件为:pH 9.0 (含5% DMSO),50 g/LE. coliS10 湿菌体,转化温度为25℃。最后,将底物苯酚浓度提升到20 mmol/L,在上述的最适条件进行转化,(R)-β-酪氨酸合成曲线如图7 所示,(R)-β-酪氨酸的产量在24 h 后达到最大值2.7 g/L,转化率为78%,ee 值为99%。转化率不能达到接近完全转化,主要是由于TAM 催化效率不足。因为在以L-酪氨酸作为底物时,TAM 所催化的反应转化率仅为40%~62%(表4),而级联催化可以使得整体转化效率提升到76%。经过多酶之间的协同合作,促使反应朝向终产物进行,有助于提高整体转化效率和最终产量[21]。
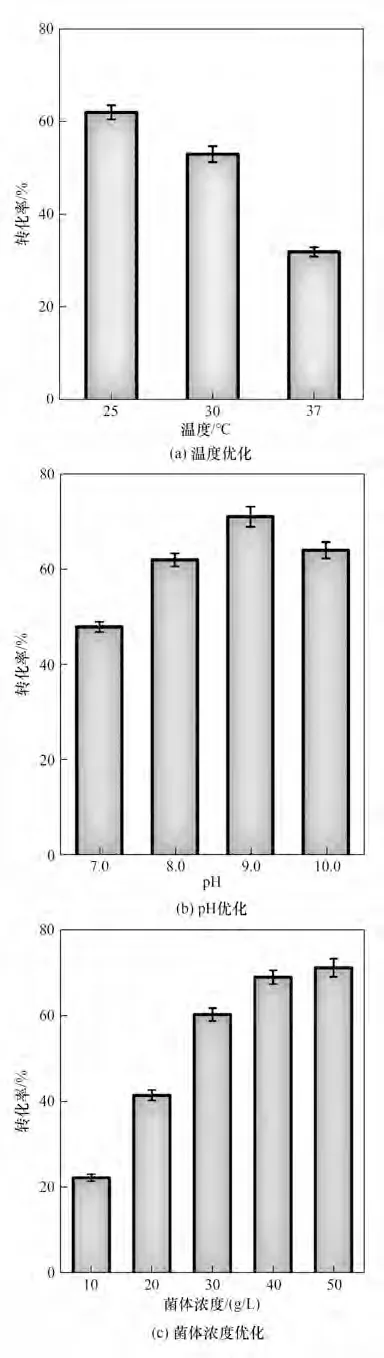
图6 (R)-β-酪氨酸合成条件优化Fig.6 Condition optimization for(R)-β-tyrosine synthesis
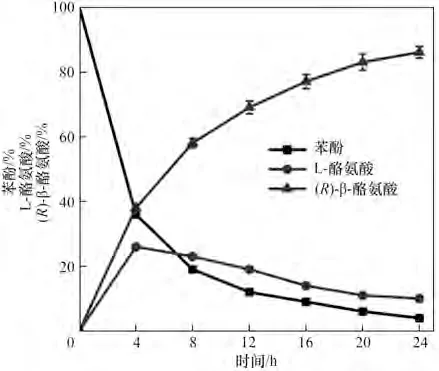
图7 (R)-β-酪氨酸合成过程曲线Fig.7 The time course of(R)-β-tyrosine synthesis process
2.4 全细胞催化合成(R)-β-酪氨酸
将(R)-β-酪氨酸合成体系放大到1 L,以进一步评估本研究设计的多酶级联催化系统的合成潜力。以50 g/LE. coliS10 湿细胞为催化剂,以20 mmol/L苯酚为底物,经过24 h的转化,以78%的转化率合成了(R)-β-酪氨酸(ee 值99%)。然后对产物进行分离纯化,(R)-β-酪氨酸的分离收率为63%,所得样品为白色固体,纯度为95%。随后通过HRMS 和NMR 对纯化获得的产物进行结构分析鉴定。首先使用HRMS对产物的分子量进行鉴定,由于使用的是阴离子色谱,产物的羧基在碱性溶液中电解为—COO-,故得到的是理论分子量减一的产物峰,为180.0654[图8(a)]。在确定分子量正确之后,又通过NMR,鉴定产物结构,鉴定时使用含有NaOD 的D2O 溶液溶解样品进行NMR分析,活泼氢在这种检测条件下是不出峰的,因此H 谱只有4 个峰[图8(b)],按照产物结构,分析C 谱应出7 个峰[图8(b)]。结果表明纯化产物的结构和分子量均与目标产物分子相符合。与目前文献中报道的(R)-β-酪氨酸合成水平相比(ee值>95%,产物得率为53%~63%)[17-18],本研究设计的方法具有较好的转化率(78%)和选择性(99%),为(R)-β-酪氨酸的绿色高效生产提供了理论指导。
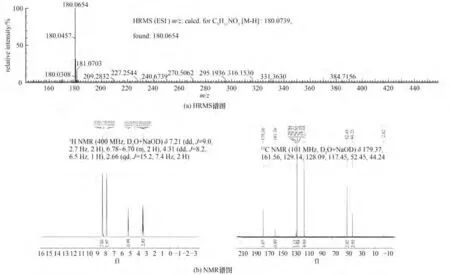
图8 (R)-β-酪氨酸的鉴定Fig.8 Identification of(R)-β-tyrosine
3 结 论
(1)开发了生物酶法绿色合成β-酪氨酸及其衍生物的路线。基于C-H 功能化介导的小分子不对称组装,通过生物催化逆合成分析设计了两步级联反应合成(R)-β-酪氨酸。该反应以价格低廉、简单易得苯酚、丙酮酸和氯化铵为底物,具有较好的成本优势。
(2)通过数据库挖掘和蛋白质工程改造筛选了性能优良的酶元件。基于数据挖掘和基因挖掘分别获得了初始酶元件,并通过蛋白质工程改造提高TAM 对底物的催化效率。通过双酶共表达和表达水平调控,构建了全细胞催化剂。
(3)通过表达水平调节和转化条件优化,进一步提高了(R)-β-酪氨酸的生产性能。在1 L 规模制备级转化实验中,最优菌株E. coliS10 可生产2.7 g/L(R)-β-酪氨酸,转化率达到了78%,ee 值为99%,收率为63%。本研究为(R)-β-酪氨酸的绿色酶法生产提供了理论指导。
