广西武宣地区红糟酸微生物多样性分析
2022-01-11李洋罗佳沂林凤毛瑞丰李凯
李洋,罗佳沂,林凤,毛瑞丰,李凯
(广西大学 轻工与食品工程学院,南宁 530004)
红糟酸(red vinasse acid)是产于广西来宾市武宣县的一种风味独特的食物,其颜色鲜艳、酸甜适口,可谓是色、香、味俱全,而且红糟还可以促消化,具有一定保健作用,深受当地人民的喜爱。红糟酸是在稍高于室温的环境温度下,将红糟配上适量醋和米酒,与煮熟的米饭拌匀,然后清洗、发酵、晾凉,投入辣椒、生姜等泡制而成。红糟酸不仅色鲜味浓,而且具有对人体有益的功效,例如软化血管、帮助消化、增加食欲等,是一种老少皆宜的食品[1]。
红糟酸的品质与微生物的代谢有密切联系,例如醋酸杆菌属、片球菌属、乳酸杆菌属等,但不同地区由于制作原料及制作环境的影响,对红糟酸中的微生物种类及含量也会有一定影响,目前对不同发酵时间和不同地区产红糟酸的差异性研究比较少。
高通量测序技术(high-throughput sequencing,NGS),又称“下一代”测序技术,一次可以对几十万至几百万条DNA分子进行序列测定,这种测序技术已经在发酵食品及环境生物中广泛应用,用于微生物群落的分析[2-3]。沈琦等[4]利用高通量技术分析了盐地碱蓬根际细菌群落多样性,检测出355个属,变形菌门的细菌属占比接近50%;Chen等[5]采用PCR-DGGE技术探究泡菜发酵中优势微生物菌群以及动态变化规律,揭示了泡菜中微生物的多样性。本实验采用高通量测序技术对武宣县不同村庄的红糟酸成品及发酵过程进行微生物多样性分析,为提高红糟酸的品质提供了一定的理论基础。
1 材料和方法
1.1 实验材料、试剂与仪器
1.1.1 实验材料
样品地理位置情况(见图1):广西壮族自治区来宾市武宣县(北纬23°19′~23°56′,东经109°27′~109°46′),东北面与金秀县为界,西南面与桂平市、贵港市毗邻,西面与来宾市兴宾区接壤,北面与象州县交界,县境面积1739.45 km2,东西最大横距50.2 km,南北最大纵距68.6 km。武宣县地处广西中部,属亚热带季风气候区。北回归线横贯武宣县南部,全年太阳辐射强。春秋干旱较频繁,夏多洪涝,冬有霜冻。年平均气温为21.3 ℃。雨水充沛,分布不均,年平均降雨量为1243.6 mm。
图1 采样点位置图
样品:样品DX、ET、SL、HM以及7个发酵过程样是来宾市武宣县不同村庄的红糟酸。
1.1.2 主要试剂

1.1.3 主要仪器

1.2 实验材料、试剂与仪器
1.2.1 样品的收集与处理
收集:2020年8月下旬,在来宾市武宣县4个地点,各收集1种成品红糟酸及7种发酵过程中的红糟酸,装入无菌密封塑料袋中,置于冰盒中,快速运输至实验室后在-20 ℃条件下冷冻保藏待用。
处理:称取200 mg红糟酸汁,加入灭菌后的2 mL离心管中,加入1×PBS溶液,振荡混匀,以10000 r/min在室温下离心3 min,弃置上层液体。
1.2.2 总DNA的提取
按Omega DNA提取试剂盒说明书,从11个红糟酸样品中提取微生物总DNA,利用琼脂糖凝胶检测DNA的完整性,用Qubit定量检测DNA样本浓度。16S rRNA和ITS序列分析:进入NCBI数据库,采用BLAST分别对所得细菌和真菌目标序列与标准菌株序列进行比对,删除结果中错位区、冗杂区,将处理好的目标序列与标准菌株序列采用MEGA 7.0软件[6]计算序列的碱基组成百分比(nucleotide composition)[7],基于Kimura 2-parameter模式对上述目标菌株与标准菌株进行遗传距离计算[8],基于neighbor-joining (NJ)法构建系统发育树[9],并对系统发育树各分支的置信度进行检验[10]。
1.2.3 高通量测序

扩增程序[11]:95 ℃预变性 3 min;95 ℃变性 30 s,45 ℃退火20 s,72 ℃延伸45 s,共20个循环;72 ℃再延伸10 min。利用Min Eluter PCR Purification Kit对PCR扩增产物进行纯化,PCR扩增产物通过2%琼脂糖凝胶电泳检测,纯化目的产物后,委托生工生物工程(上海)股份有限公司进行高通量建库与微生物多样性分析。
1.2.4 实验数据分析
根据97%相似性,将非重复序列进行操作分类单元(OTU)聚类。利用RDP Classifier贝叶斯算法对97%相似水平的OTU进行分类学分析[12],统计不同地区和发酵时间红糟酸样品的微生物在不同水平的群落组成。利用Mothur软件绘制稀释性曲线,利用QIIME[13]软件计算样品的各种多样性指数,利用Excel软件构建群落分布柱状图、数据分析表等。
2 结果与分析
2.1 OTU聚类分析
在分析中引入OTU分析,首先对相似序列进行聚类,分成数量较少的分类单元进行分析,即OTU聚类分析,既可以简化数据结构,也可去除一些测序错误序列,从而得到样品中的微生物多样性及不同微生物的丰度。
由图2可知,4个样品共有的细菌OTU数为77个,HM和SL无特有的OTU,ET和DX各有1个,样品共有的真菌OTU数为5个。
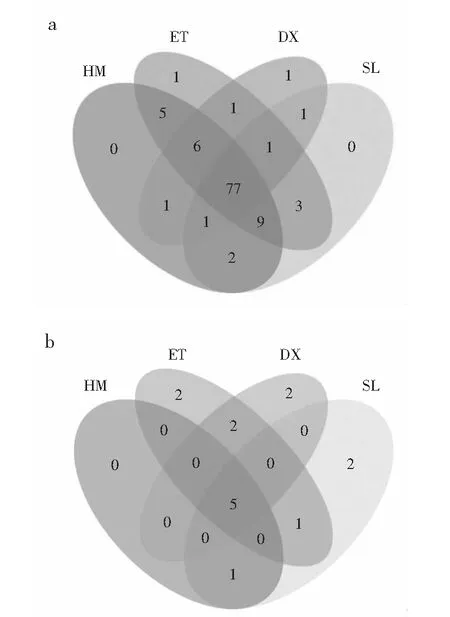
图2 成品样微生物OUTs Venn图
由图3可知,7个过程样共有的细菌OTU数为84个,共有的真菌数为8个。红糟酸制作前,需将红曲米种子用白醋泡发,打成匀浆,从而改变其发酵环境,降低发酵过程中的pH值,导致部分微生物的生长被抑制。真菌对于低pH环境具有耐受性,从而使其OTU数在发酵中期回升。
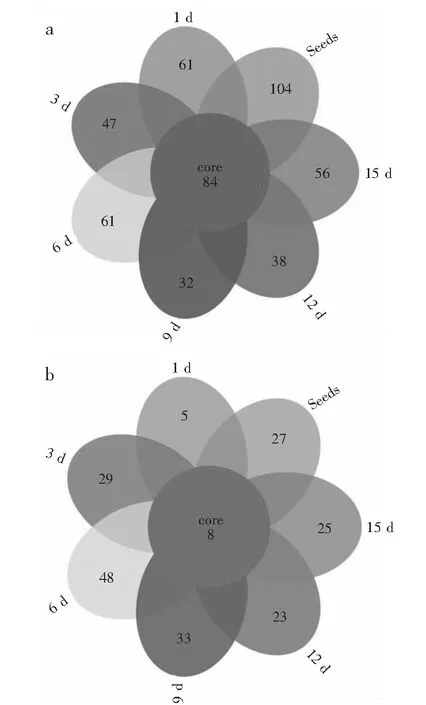
图3 过程样OUTs Venn图
2.2 Alpha多样性分析
Alpha多样性指一个生态系统或特定环境中的多样性,主要用于反映物种丰度、均匀度、测试深度。

续 表
由表1和表2可知11个样品的细菌和真菌群落多样性。在观察到的样品物种数和物种丰度指数中,D15是7个发酵样(Seeds~D15)中细菌物种总数相对较大的,在成品对比中,SL是成品红糟酸中细菌物种总数和物种丰度最高的;通过Shannon和Simpson值可以看出,细菌的多样性在发酵过程中略有波动,且在成品红糟酸中细菌多样性最高。由表2可知,11个样品中D6、D9和D15的真菌物种总数较大,且样品中真菌多样性波动较小。Alpha多样性指数显示过程样与成品样之间波动较大。
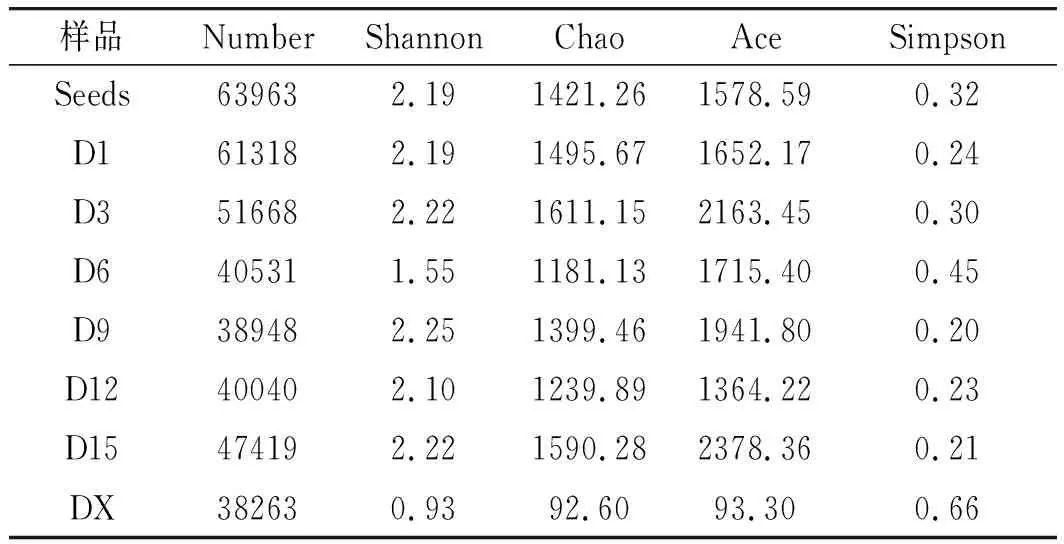
表1 样品细菌群落Alpha多样性指数

表2 样品真菌群落Alpha多样性指数Table 2 Alpha diversity indexes of fungal communities of samples
2.3 红糟酸中微生物群落结构分析
2.3.1 成品样中微生物群落分析
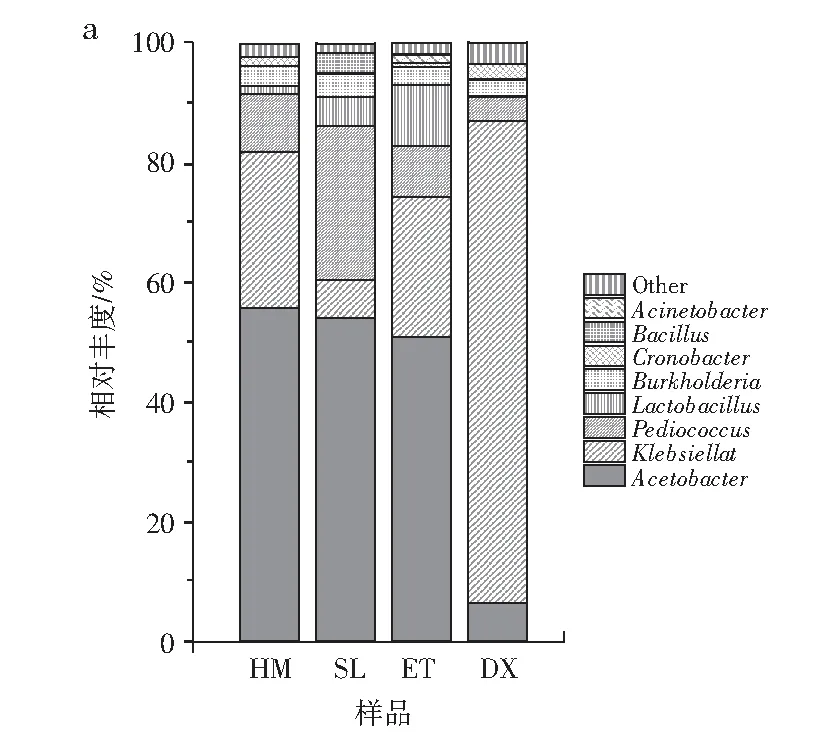
由图4可知,醋酸杆菌属、克雷伯氏菌属和片球菌属在红糟酸成品中占比较高,醋酸杆菌属在样品HM、SL和ET中较多,分别占比55.88%、53.99%和50.89%,醋酸杆菌属可以氧化乙醇成醋酸[14],是样品HM、SL和ET主要的产酸途径,DX中较少,占比6.46%,可能与当地的生产环境有很大关联。克雷伯氏菌属在DX中占比最多,约为80.52%,这种菌属如果含量过高,可能会对红糟酸的品质和口感有影响。片球菌属能赋予食品柔和的酸味及香气,改进食品的品质和营养,具有耐酸、耐高温特点,还具有抗肿瘤、降低胆固醇的生物学功能[15-16],在SL中占比较多,为25.8%,在HM、ET和DX中分别占比9.97%、8.44%和3.64%。乳酸杆菌属可以产生乳酸和多种抗菌物质,乳酸杆菌属细胞内碳水化合物活性酶存在特异性[17],在发酵过程中,乳酸的数量影响发酵的质量,乳酸菌属在样品HM、SL、ET和DX中分别占比1.42%、5%、10.43%和0.4%。伯克霍尔德菌属在HM、SL、ET和DX中分别占比3.63%、3.83%、2.86%和2.88%,有研究表明伯克霍尔德菌属中的大多数物种都使用氧气作为电子受体降解芳香化合物。阪崎肠杆菌属在HM、SL、ET和DX中分别占比0.85%、0.004%、0.57%和2.4%,此菌属耐高温、不耐酸[18]。芽孢杆菌属通过代谢产酸,在ET和DX中均未检出,在HM中占比小于1,为0.019%,在SL中为3.61%,不动杆菌属通过代谢消耗碳水化合物产酸,在HM、SL和DX中占比均小于1,分别为0.13%、0.16%和0.12%,在ET中占比1.17%。在属水平上,红糟酸成品真菌优势菌均为红曲霉,在HM和SL中有一定比例的念珠球菌,但占比均较低。总的来说,4种成品红糟酸中,DX与 SL、HM及ET的菌间差异较大,DX优势菌属为克雷伯氏菌,其他菌种相对丰度较小;SL、HM和ET优势菌属为醋酸杆菌,且在HM中相对丰度最高,SL中片球菌相对丰度较HM和ET高,ET中乳酸菌相对丰度较SL和HM高,其余菌属在4种样品中均占比较低,这可能与当地的气候以及操作环境和方法有关。

图4 属水平成品样群落结构
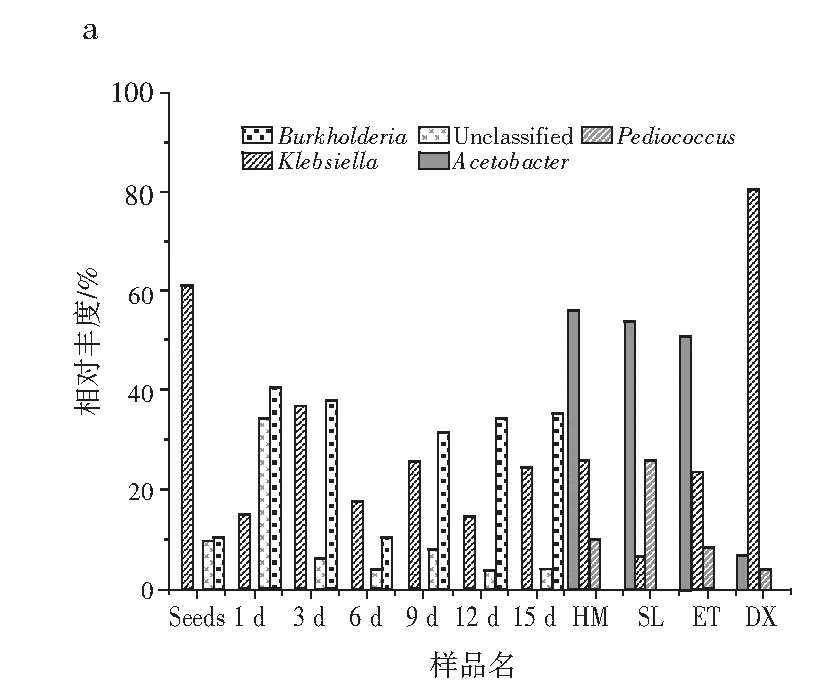
2.3.2 过程样中微生物群落分析

由图5可知,在属水平上,伯克霍尔德菌属和克雷伯氏菌属在整个发酵过程中占比较大。其中,伯克霍尔德菌属、克雷伯氏菌属和未分类菌在种子中占比较大,分别为60.97%、10.35%和9.89%。发酵到第3天,克雷伯氏菌属含量大量减少,伯克霍尔德菌属和未分类菌有所增加,分别为40.49%、34.4%和14.78%。发酵到第6天,伯克霍尔德菌属、克雷伯氏菌属和乳酸杆菌属为优势菌,分别为37.69%、36.62%和14.29%。发酵到第9天,乳酸杆菌属成为最大的优势菌,为66.02%,现已有众多报道证明,乳酸杆菌属为发酵中主导菌系[19-20],其次为克雷伯氏菌属和伯克霍尔德菌属,分别为17.36%和10.2%。发酵到第12天,乳酸杆菌属、克雷伯氏菌属和伯克霍尔德菌属为优势菌种,分别为30.83%、25.39%和31.34%。发酵到第15天,乳酸杆菌属、克雷伯氏菌属和伯克霍尔德菌属为优势菌种,分别为43.81%、14.44%和34.34%。红糟酸成品中,乳酸杆菌属、克雷伯氏菌属和伯克霍尔德菌属为优势菌种,分别为32.27%、24.25%和35.25%。在属水平上,红糟酸过程样真菌优势菌均为红曲霉。发酵中期,念珠球菌随发酵时间的延长有所增加,但占比较小。由上述研究可知,伯克霍尔德菌属和克雷伯氏菌属在发酵过程中占绝对优势,未分类菌属在发酵前期占优势,乳酸菌在发酵后期占绝对优势。

图5 属水平过程样群落结构
在泡菜发酵过程中,会产生一些与发酵无关的菌,甚至是有害菌。在红糟酸中存在伯克霍尔德菌、克雷伯氏菌、大肠杆菌(E.coli)、阪崎肠杆菌、黄单胞杆菌、类芽孢杆菌等有害菌,大肠杆菌是常见的肠道菌,也是食品中常用的粪源性污染卫生细菌学指标[21],该菌耐高温,55 ℃下可存活60 min且其最适pH为7.2~7.4,大肠杆菌在红曲米中限量为3.0 MPN/100 g,因此该菌是威胁红糟酸安全的微生物。此产生的原因可能与制作过程中操作环境、工作人员卫生规范以及原料有关。据观察,红糟酸制作过程中环境虽较干净,但并未做到完全无菌,加上在对红曲米制作工艺考察中发现,红曲米制作过程中使用自来水洗米,发酵晾晒环境也没有做到无菌,都可能是导致在样品中检测出大肠杆菌的原因。因此,在整个制作过程中要严格把控原材料以及操作人员的卫生健康问题,对直接接触食品的水要进行杀菌。
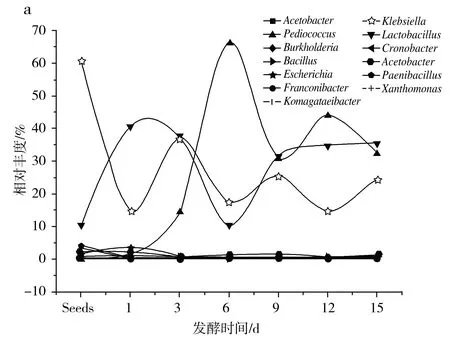
由图6可知,红糟酸发酵前期,伯克霍尔德菌属、驹形杆菌属、类芽孢杆菌属呈增加趋势,达到峰值后逐渐下降。片球菌属在发酵前期占比几乎为零,在发酵达到峰值后逐渐下降,乳酸杆菌属和片球菌属均属于乳酸菌的范畴[22]。醋酸菌属、大肠杆菌在发酵初期略有增加后一直呈下降趋势。克雷伯氏菌属、黄单胞杆菌属、不动杆菌属、克罗诺杆菌属、弗朗克氏杆属在种子中占比较大,之后呈大幅度下降趋势,在下降过程中有小幅度波动。乳酸杆菌属、杆菌属在发酵前中期占比上升至峰值后下降。

图6 红糟酸发酵过程微生物变化
在真菌中,红曲霉在种子中占比最高,在发酵中期缓慢下降至最低并随着发酵时间的延长逐渐上升,酵母菌的变化规律与红曲霉相反。Diutina,Cyberlindnera,unclassified,Pseudallescheria占比在发酵后期无增加后下降。毕赤酵母菌占比在发酵前期增加至峰值后下降。念珠菌属、Dekkera的占比在发酵前中期上升至峰值后下降。Kregervanrija、曲霉菌在种子中占比最高,随着发酵过程的进行占比几乎为零。
2.4 发酵过程样与成品中优势微生物群落分析
由图7可知,过程样与成品样对比发现,克雷伯氏菌属、红曲霉、毕赤酵母菌和念珠菌属贯穿整个发酵过程,在成品中均存在,而未分类菌和Diutina只在发酵中存在,在成品中未见到,成品中的优势菌增加了醋酸杆菌属和片球菌属。现有关红糟酸的报道较少,但在泡菜和发酵食品相关的研究中,均发现了与红糟酸相同的优势菌属。金华等[23]基于MiSeq高通量测序技术,发现自然发酵蔬菜片球菌属和乳酸杆菌属为主要优势菌属,最高占比为59.59%。宁明等[24]对不同地区辣椒酱进行细菌多样性分析,发现乳酸杆菌属和醋酸杆菌属等为主要的优势菌属。这些优势菌属对发酵食品的风味及品质有一定的影响,但对红糟酸的风味和品质是否有影响还需进行进一步的探究。
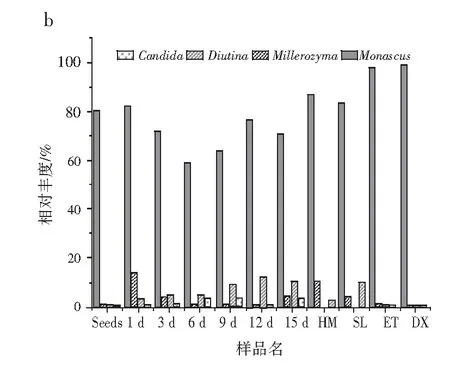
图7 样品优势菌群落结构
3 讨论与展望
本文对来自广西来宾市武宣县不同村庄的红糟酸进行微生物群落多样性分析,其中,伯克霍尔德菌和克雷伯氏菌在发酵过程中占比较大,醋酸杆菌属、克雷伯氏菌属和片球菌属在成品中占比较大。红曲霉菌是样本中真菌优势菌且抑制了酵母菌的生长。在红糟酸发酵过程中,发现了一些非发酵菌和致病菌,这提示在红糟酸制品中存在微生物安全性问题,应将使用无菌水,原料清洗晾晒这一环节改为无菌操作,在灌装前增加乳酸杆菌属添加步骤。
红糟酸的发酵与复杂的微生物区系相关,微生物种类和区系结构对红曲制品的产量、质量和风味起着至关重要的作用。本文为进一步对红糟酸安全性评价的研究提供了理论基础,为日后红糟酸制作中微生物病害控制提供了积极的参考意见。
