炎症性肠病患者血清miR-181a-5p和miR-126表达水平及其与肠道菌群相关性的研究
2021-03-05李国东李会荣
崔 昭 梁 博 李国东 李会荣
炎症性肠病(IBD)为肠道慢性炎性疾病,包括溃疡性肠炎(UC)与克罗恩病(CD),其临床症状主要为腹泻、腹痛、血便等,目前IBD的发病机制尚未完全明确[1-2]。研究显示肠道黏膜免疫异常可引发炎性反应,而肠道菌群异常可导致免疫紊乱[3],因此深入分析肠道菌群组成变化与IBD发病的相关性具有重要意义。既往研究显示微RNA(miRNA)在IBD发生过程中发挥着重要作用[4-5]。miR-181a-5p在急性胰腺炎模型细胞中呈高表达,可导致细胞炎性损伤[6]。研究表明miR-126在支气管哮喘患者的血浆中表达异常,并参与了炎性疾病的发生、发展[7]。目前miR-181a-5p、miR-126在IBD血清中的表达情况尚不明确。因此,本研究主要探讨miR-181a-5p、miR-126在IBD患者血清中的表达水平及其与肠道菌群的相关性。
1 资料与方法
1.1 一般资料 收集2016年10月至2018年12月保定市第二医院收治的100例活动期IBD患者作为研究组,所有患者均符合相关诊断标准[8],其中男性56例,女性44例,年龄25~60岁,平均年龄为(43.26±5.48)岁;研究组中包括60例UC患者(UC组)和40例CD患者(CD组);60例UC患者中,男性31例,女性29例,年龄25~58岁,平均年龄为(44.16±6.12)岁;40例CD患者中,男性25例,女性15例,年龄28~60岁,平均年龄为(42.16±7.11)岁。另选择同期于本院体检的50名健康志愿者作为对照组,其中男性30名,女性20名,年龄23~60岁,平均年龄为(45.26±7.48)岁。各组年龄、性别的差异均无统计学意义(P均>0.05),具有可比性。本研究经医院医学伦理委员会批准,所有入组者均签署知情同意书。
1.2 方法
1.2.1 采集血液样本 抽取所有入组者清晨空腹静脉血5 mL,4 ℃条件下1 000 r/min离心10 min,吸取血清置于离心管内,保存于-20 ℃冰箱内。
1.2.2 实时荧光定量聚合酶链反应检测miR-181a-5p、miR-126表达水平 采用TRIzol法提取血清中的总RNA,应用Nanodrop2000c超微量分光光度计检测RNA浓度。引物序列见表1,引物由上海生工生物工程股份有限公司设计合成。反转录体系:5×gDNA Buffer 2 μL,10×King RT Buffer 2 μL,FastKing RT Enzyme Mix 1 μL,FQ-RT Primer Mix 2 μL,RNA 2 μg,RNase-Free ddH2O补足体系至20 μL;反应条件:42 ℃ 15 min,95 ℃ 3 min。反转录得到cDNA,以cDNA为模板进行实时荧光定量聚合酶链反应(Real-time qPCR)扩增,反应体系:2×SYBR Premix Ex Taq Ⅱ 10 μL,cDNA 2 μL,上下游引物各0.8 μL,50×ROX Reference Dye 0.4 μL,ddH2O 6 μL;反应条件:95 ℃ 2 min预变性,之后95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。以U6为内参,采用2-ΔΔCt法计算miR-181a-5p、miR-126的相对表达量。TRIzol试剂、反转录与PCR试剂盒均购自大连宝生物工程有限公司。

表1 引物序列
1.2.3 细菌培养与鉴定 采集所有入组者粪便10 g,置于厌氧罐内,采用日本光冈知足法培养细菌,本研究选用以下肠道菌群进行培养:肠球菌属、酵母菌属、拟杆菌属、双歧杆菌属、消化球菌属、乳杆菌属、小梭菌属、真杆菌属、肠杆菌属、葡萄球菌属。细菌经革兰染色、生物化学实验进行阳性判断,并计算样本中各菌属水平。菌落数据取其对数值lgN(CFU/g)。
1.3 统计学处理
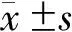
2 结果
2.1 各组血清miR-181a-5p、miR-126表达比较
与对照组相比,研究组、UC组、CD组的血清miR-181a-5p、miR-126的相对表达量均显著升高(P均<0.05)。见表2。

表2 各组血清miR-181a-5p、miR-126相对表达量比较()
2.2 各组菌群数量比较
与对照组相比,UC组肠球菌属、酵母菌属、拟杆菌属、双歧杆菌属、消化球菌属、乳杆菌属、小梭菌属数量显著增多(P<0.05),CD组肠球菌属、酵母菌属、拟杆菌属、双歧杆菌属、消化球菌属、乳杆菌属数量显著增多(P<0.05)。见表3。
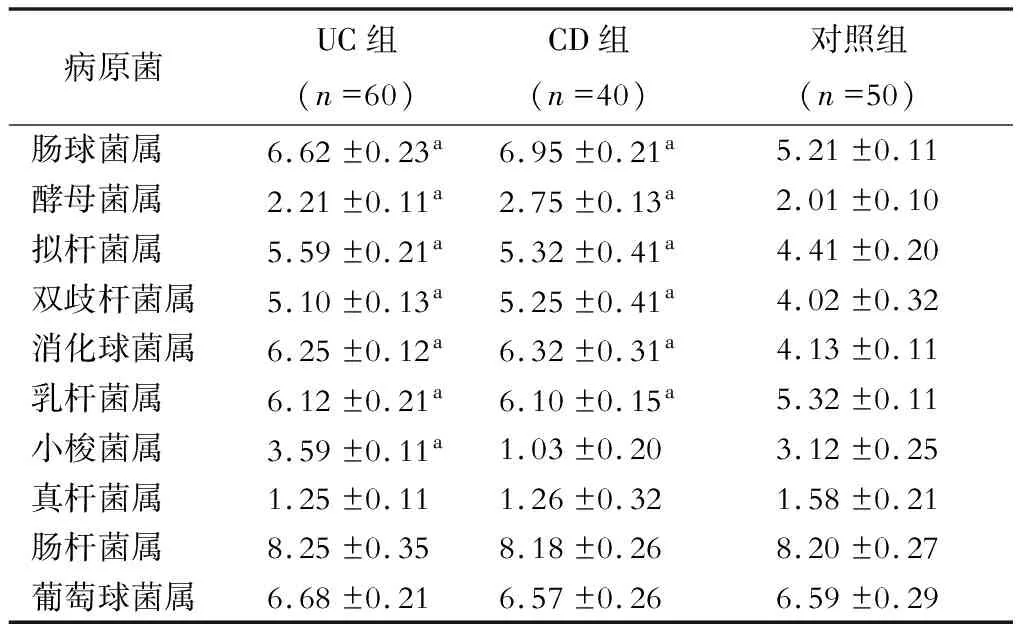
表3 各组菌群数量比较(lgN)
2.3 各组菌群培养阳性率比较
细菌培养与鉴定结果显示,与对照组相比,UC组拟杆菌属、双歧杆菌属、消化球菌属、乳杆菌属的培养阳性率显著升高(P<0.05);与对照组相比,CD组酵母菌属、双歧杆菌属、消化球菌属、乳杆菌属的培养阳性率显著升高(P<0.05)。见表4。
表4 各组菌群阳性率比较
2.4 血清miR-181a-5p、miR-126不同表达组的菌群数量比较
根据miR-181a-5p、miR-126表达水平的平均数(2.58、2.64)将患者分为miR-181a-5p高表达组和miR-181a-5p低表达组、miR-126高表达组和miR-126低表达组。与miR-181a-5p低表达组相比,miR-181a-5p高表达组肠球菌属、酵母菌属、葡萄球菌属的数量显著增多(P<0.05);与miR-126低表达组相比,miR-126高表达组肠球菌属、双歧杆菌属、消化球菌属、葡萄球菌属的数量显著增多(P<0.05)。见表5。
表5 IBD患者血清miR-181a-5p、miR-126不同表达组间菌群数量比较[lgN,]
2.5 血清miR-181a-5p、miR-126表达与菌群数量的相关性分析
采用Pearson法分析IBD患者血清miR-181a-5p、miR-126表达水平与菌群数量的相关性,结果显示血清miR-181a-5p表达水平与肠球菌属、酵母菌属、双歧杆菌属、肠杆菌属呈负相关(P<0.05),血清miR-126表达水平与消化球菌属、葡萄球菌属呈负相关(P<0.05)。见表6。

表6 血清miR-181a-5p、miR-126表达与菌群数量的相关性
3 讨论
miRNA在IBD患者血清中异常表达,其表达水平与机体炎性反应密切相关[9-10]。但miRNA表达水平与IBD患者肠道菌群的相关性研究相对较少。因此,本研究探讨了miR-181a-5p、miR-126在IBD患者血清中的表达水平,并分析其与IBD患者肠道菌群的相关性,为揭示IBD发病机制提供参考。
miR-181a-5p在血管炎性疾病、脓毒症等多种疾病中表达上调,并可促进炎性反应的发生[11-12]。与上述研究结果相似,本研究结果显示miR-181a-5p在IBD患者血清中呈高表达,提示miR-181a-5p表达水平升高可能促进IBD的发生。研究表明miR-126在消化系统疾病患者中表达异常并可促进IBD的发生[13]。另有研究指出miR-126在支气管肺炎患者血清中表达水平升高,并可能促进炎性反应[14]。本研究结果显示IBD患者血清miR-126表达水平升高,提示miR-126表达水平升高可能参与IBD发生过程。肠道菌群可形成相对稳定的状态并可保护肠道健康,若肠道环境发生改变可引起肠道菌群组成异常,进而促使肠道微生态破坏而导致肠道感染的发生[15]。本研究结果显示UC组肠球菌属、酵母菌属、拟杆菌属、双歧杆菌属、消化球菌属、乳杆菌属、小梭菌属数量显著多于对照组,CD组肠球菌属、酵母菌属、拟杆菌属、双歧杆菌属、消化球菌属、乳杆菌属数量显著多于对照组;UC组拟杆菌属、双歧杆菌属、消化球菌属、乳杆菌属的培养阳性率显著高于对照组,CD组酵母菌属、双歧杆菌属、消化球菌属、乳杆菌属的培养阳性率显著高于对照组,与相关报道结果相符[16]。这提示IBD患者存在肠道菌群失调,分析原因可能是肠道菌群中致病菌数量增加可破坏肠道微生态造成肠黏膜功能障碍,研究表明肠黏膜功能障碍的发生可降低机体免疫力,从而促进肠道炎性反应的发生[17]。本研究结果显示miR-181a-5p和miR-126高表达组的肠球菌属、葡萄球菌属数量显著高于低表达组,进一步分析miR-181a-5p、miR-126表达水平与菌群数量的相关性,结果显示miR-181a-5p表达水平与肠球菌属、酵母菌属、双歧杆菌属、肠杆菌属呈负相关,miR-126表达水平与消化球菌属、葡萄球菌属呈负相关,提示IBD患者血清miR-181a-5p、miR-126水平与肠道菌群组成的变化密切相关。分析原因可能为菌群数量改变导致肠道黏膜功能障碍,造成肠道免疫应答功能紊乱,而肠道菌群可参与机体糖脂代谢过程,血清miR-181a-5p、miR-126水平升高可促进炎性反应的发生,促进IBD发生,进而导致肠道功能障碍。
综上所述,IBD患者血清中miR-181a-5p与miR-126的表达水平升高,两者表达水平与肠道菌群组成变化密切相关,其具体作用机制仍需进一步探究。
