硼替佐米治疗新诊断多发性骨髓瘤期间心脏不良事件的影响因素及其对生存时间影响的真实世界研究
2021-12-08申曼黄仲夏李新张佳佳裴晓姣潘振宇陈文明
申曼,黄仲夏 *,李新,张佳佳,裴晓姣,潘振宇,陈文明
本研究价值:
(1)多发性骨髓瘤(MM)是一种易发生于中老年人的发病率逐年增高的血液系统恶性疾患,在硼替佐米治疗为主体的新药时代,MM患者中位生存期已经延长为目前的5~7年。以硼替佐米为基础的靶向治疗缓解率高,可迅速控制MM患者的病情进展。然而,近来的真实世界报道硼替佐米用药期间可出现危及生命的心脏不良事件(CAEs),已经逐渐引起越来越多临床医师的关注。(2)本研究分析了新诊断多发性骨髓瘤(NDMM)患者在应用硼替佐米治疗期间出现CAEs对生存时间的影响及发生CAEs的影响因素。结果发现,硼替佐米治疗期间出现CAEs的患者预后极差,尤其是第1周期治疗时出现的急性CAEs;而危险因素为血红蛋白<76 g/L、血清肌酐≥176 μmol/L和吸烟史。(3)硼替佐米治疗NDMM患者期间CAEs真实世界中相关研究较少,影响因素不明晰。本研究结果对于指导临床医师安全用药、有效减少CAEs有重要警示和参考价值。NDMM患者在接受硼替佐米化疗时,应加强CAEs的管理,积极输血和纠正肾功能,有利于降低CAEs的发生率,改善患者预后。
多发性骨髓瘤(MM)是一种浆细胞恶性疾病,中位发病年龄为70岁,随人口老龄化日益严重,发病率逐渐上升,占所有恶性肿瘤的1.6%,占血液系统肿瘤的10.0%[1]。随着蛋白酶体抑制剂——硼替佐米等新药的广泛应用,MM的中位生存期由3~5年延长至5~7年[2]。硼替佐米已成为治疗新诊断多发性骨髓瘤(NDMM)的Ⅰ类推荐药物[1]。然而,随着硼替佐米在临床的广泛应用,其不良反应除常见的周围神经病变之外[3],心脏不良事件(CAEs)逐渐显现,近年来偶见个案报道[4-5],严重影响患者的生存和预后,但鲜有真实世界的有关其影响因素的研究。因此,本研究选取本院近10年来收治的NDMM患者,筛选出应用硼替佐米治疗期间发生CAEs的患者,分析发生CAEs的危险因素,寻找预防措施,为硼替佐米在真实世界的安全用药提供指导。
1 对象与方法
1.1 研究对象 选取2009年1月—2019年1月北京朝阳医院西院血液与肿瘤科收治的NDMM患者164例作为研究对象,年龄33~85岁,中位年龄为62岁。患者确诊前均完善了骨髓细胞学、血尿M蛋白鉴定及免疫固定电泳、血常规、肝肾功能及骨骼影像学检查,符合2014年国际骨髓瘤工作组(IMWG)制定的MM诊断标准[6]:骨髓克隆性浆细胞比例≥10%和/或活组织检查证实有浆细胞瘤,并至少存在一项浆细胞增生相关器官损害表现(贫血、高钙血症、肾功能损害、溶骨性病变)。纳入标准:根据指南[7]选用以硼替佐米为基础的化疗方案作为一线诱导化疗方案。排除标准:(1)原发性系统性淀粉样变性或者MM合并淀粉样变性的患者;(2)浆细胞白血病患者;(3)一线化疗方案中联合应用蒽环类药物的患者;(4)确诊时心脏超声左心室射血分数<40%或心功能纽约心脏协会(NYHA)分级Ⅲ或Ⅳ级[8];(5)确诊前6个月内有急性心肌梗死病史或出现心肌缺血症状的患者。所有患者或家属签署知情同意书,本研究获取本院医学伦理委员会批准。
1.2 方法
1.2.1 治疗 以硼替佐米为基础的化疗方案作为一线诱导化疗方案,3周为1个疗程,包括如下方案:(1)硼替佐米联合地塞米松(BD方案):硼替佐米1.3 mg/m2,皮下注射,第1、4、8、11天;地塞米松20 mg,静脉注射,第1、4、8、11天。(2)BD联合异环磷酰胺(BCD方案):BD方案基础上联合异环磷酰胺500 mg·(m2)-1·d-1静脉注射,第1~4天。(3)BD联合沙利度胺(BTD方案):BD方案基础上联合沙利度胺100 mg/晚,口服,第1~21天。每2个疗程对患者进行疗效评估,4个疗程后达到完全缓解(CR)或非常好的部分缓解(VGPR)的患者中,原方案重复2~4个疗程作为巩固治疗。无禁忌证的患者常规使用阿司匹林或低分子量肝素预防静脉血栓形成。
1.2.2 CAEs定义与分组 按照通用不良反应术语标准4.0版(CTCAE.4.0)进行CAEs定义[9]。心力衰竭定义为以下3种类型中至少有2种:症状〔夜间阵发性呼吸困难、气短、踝关节水肿、呼吸困难、体质量增加(3 d内增加大于2 kg)〕、查体(颈静脉扩张、肺部啰音、第三心音、肝肿大、腹腔积液、胸腔积液)以及辅助检查〔胸部影像学示肺水肿/肺淤血,超声心动图可见心脏结构或功能异常或N端-B型钠尿肽前体(NT-proBNP)升高(450 ng/L)〕[8]。心力衰竭NYHA分级:轻度到中度活动出现症状(2级),轻微运动时出现症状(3级),不能从事任何体力活动、休息状态下出现症状需要紧急干预的危及生命的情况(4级)[8,10]。急性冠脉综合征定义为胸痛、肌钙蛋白I(cTnI)升高和缺血性心电图改变这3个临床表现中至少存在2个[11]。症状性心律失常是指需要治疗的心房颤动或心房扑动。动脉和/或静脉血栓栓塞通过影像学检查确定。
仅在接受硼替佐米的治疗过程中评估CAEs,出现上述症状为CAEs组26例,无上述症状为对照组138例。CAEs组中分为急性CAEs亚组与非急性CAEs亚组,第1疗程过程中出现的CAEs定义为急性CAEs;第2疗程及之后出现的CAEs定义为非急性CAEs。
1.2.3 临床资料收集 记录患者的性别、年龄、有无吸烟史、心脏病既往史(心律失常、冠心病、急慢性心力衰竭、高血压、动静脉血栓事件)、骨髓瘤分型、Durie-Salmon分期(DSS)、国际分期标准(ISS)、高危细胞遗传学、溶骨性病变、骨髓内异常浆细胞比例、血清钙(Ca)、血红蛋白(HGB)、血清肌酐(Scr)、乳酸脱氢酶(LDH)水平等临床资料。吸烟定义:吸烟≥1支/d,连续吸烟>1年。高危细胞遗传学是指通过荧光原位杂交(FISH)检测到t(4;14)、t(14;16)、del(17p)中至少一种[12]。
记录CAEs组26例患者发生CAEs时硼替佐米的累积剂量以及距离首次用药的时间,以及发生CAEs时的临床表现,包括:症状、体征、NYHA分级、NT-proBNP与cTnI峰值以及心电图、心脏超声、胸部影像学检查结果。
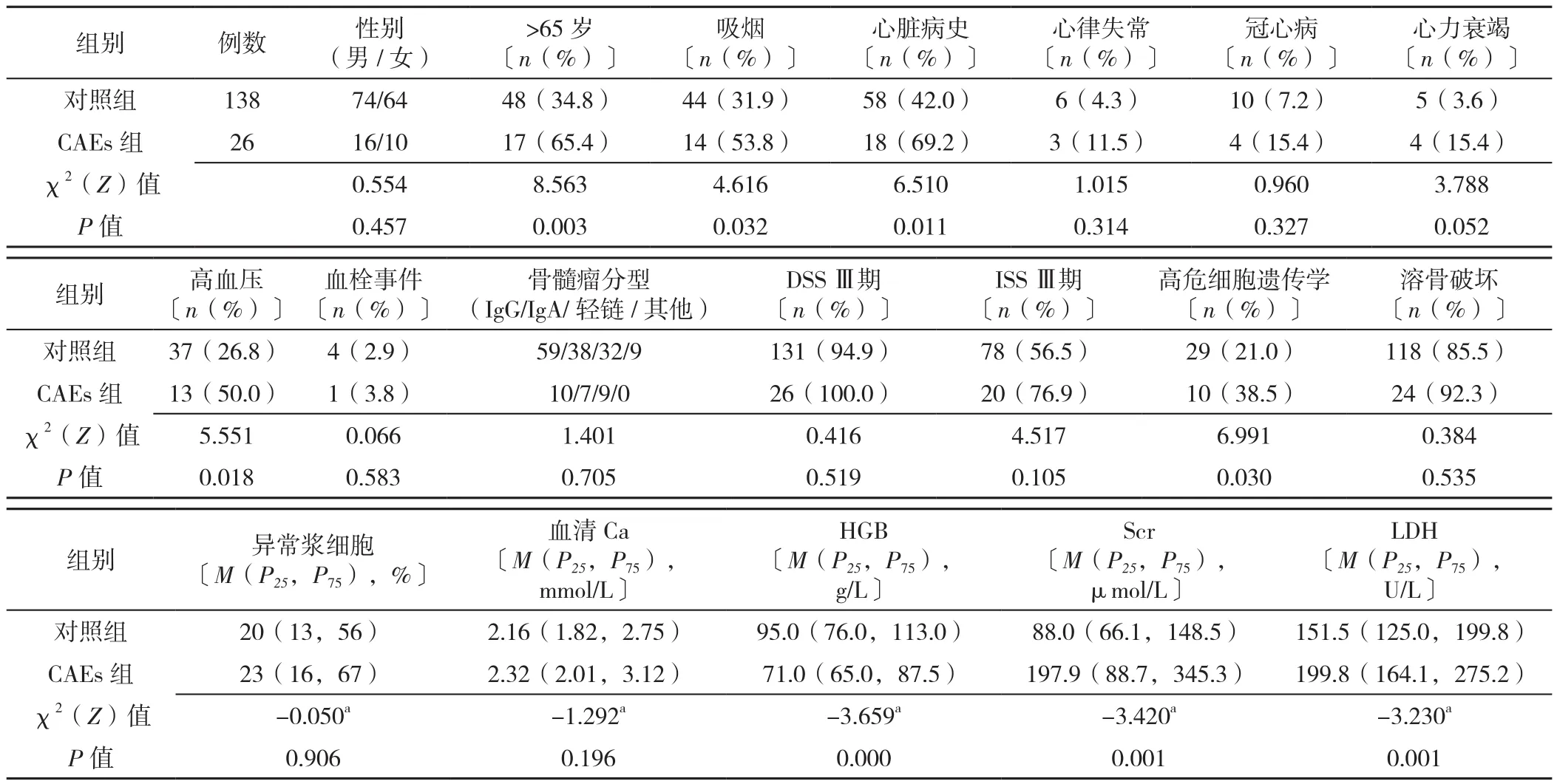
表1 CAEs组和对照组患者临床资料比较Table 1 Baseline clinical characteristic in CAEs group and control group
1.2.4 随访 对患者进行门诊或住院病历查阅及电话随访。末次记录后6个月若未看到患者复诊或再住院,则进行电话随访。随访内容为患者的生存状态,必要时需要死亡证明书。以死亡为随访终点,并记录总体生存时间(OS):诊断至死亡(任何原因)或随访终点的时间。随访截至2020-01-31,中位随访时间为38个月。
1.3 统计学方法 采用SPSS 24.0统计软件进行统计学分析。不符合正态分布计量资料以M(P25,P75)表示,两组间比较采用非参数秩和检验;计数资料以相对数表示,组间比较采用χ2检验;应用硼替佐米治疗期间发生CAEs影响因素采用多因素Logistic回归分析;绘制各组患者全因死亡的生存曲线,生存曲线比较采用Log-rank检验;绘制各指标诊断CAEs的受试者工作特征曲线(ROC曲线),并计算ROC曲线下面积(AUC)。以P<0.05为差异有统计学意义。
2 结果
2.1 CAEs组和对照组患者临床资料比较 以65岁为老年患者的界限,CAEs组>65岁患者、吸烟、心脏病史、高血压、高危细胞遗传学比例及Scr、LDH水平高于对照组,而HGB水平低于对照组,差异有统计学意义(P<0.05)。其余指标两组间比较,差异无统计学意义(P>0.05,见表1)。
2.2 CAEs的发病时间及硼替佐米累积剂量 26例CAEs患者中急性 CAEs 14例,非急性 CAEs 12例。急性 CAEs发病时间3~15 d,中位发病时间为7 d,硼替佐米累积剂量1.3~5.2 mg/m2,中位累积剂量为 2.7 mg/m2;非急性 CAEs发病时间36~170 d,中位发病时间为84 d,硼替佐米累积剂量10.4~41.6 mg/m2,中位累积剂量为 20.8 mg/m2。疗程和时间分布情况见表2。

表2 发生CAEs时硼替佐米累积剂量分布(n=26)Table 2 Distribution of the cumulative dose of bortezomib in the presence of CAEs
2.3 CAEs的临床表现 急性和非急性CAEs患者临床表现详见表3。急性CAEs患者均发生心力衰竭(100.0%),1例患者用药前与用药后胸部X线检查结果见图1A与图1B;非急性CAEs患者中心力衰竭4例(33.3%),心房颤动4例(33.3%),静脉血栓栓塞2例(16.6%),急性冠脉综合征2例(16.6%)。呼吸困难与心悸为最常见CAEs症状,两者在急性CAEs亚组中分别为9例(64.3%)和7例(50.0%),而非急性CAEs亚组中分别为5例(41.7%)和4例(33.3%);其次为体质量增加和水肿,急性CAEs亚组中分别为6例(42.9%)和6例(42.9%),非急性CAEs亚组中分别为3例(25.0%)和5例(41.7%)。双肺湿啰音为最常见的体征,在急性CAEs亚组中占100.0%,非急性CAEs亚组中有5例(41.7%);其次为胸、腹腔积液,两亚组中分别为5例(35.7%)和5例(41.7%)。NYHA分级中Ⅳ级比例最高,共12例(46.2%),Ⅲ级次之,有11例(42.3%),Ⅱ级最少有3例(11.5%)。
CAEs 患者的NT-proBNP 均 >400 ng/L;>5 000 ng/L 的患者占CAEs组的54.0%(14/26),其中急性CAEs亚组中有9例(64.3%),非急性CAEs亚组中有5例(41.7%);≥8 000 ng/L的患者占CAEs组的19.2%,其中急性CAEs亚组中有4例(28.6%),非急性CAEs亚组中有1例(8.3%)。最常见心电图改变为肢导低电压。CAEs患者中无一例室间隔厚度>12 mm,间接提示本研究对象中无淀粉样变性存在。胸部影像学表现中心脏增大最常见,且常合并肺淤血/肺水肿,急性CAEs亚组中有10例(71.4%)患者出现了心脏增大。
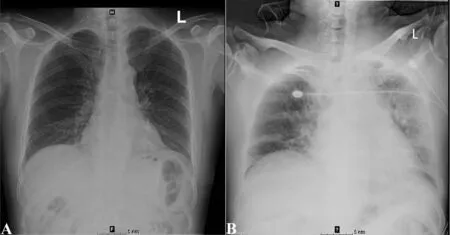
图1 接受硼替佐米治疗出现急性心力衰竭前(A)后(B)的患者胸部X线Figure 1 Chest radiograph comparison of a patient receiving bortezomibbased regimen before (A) and after (B) acute heart failure
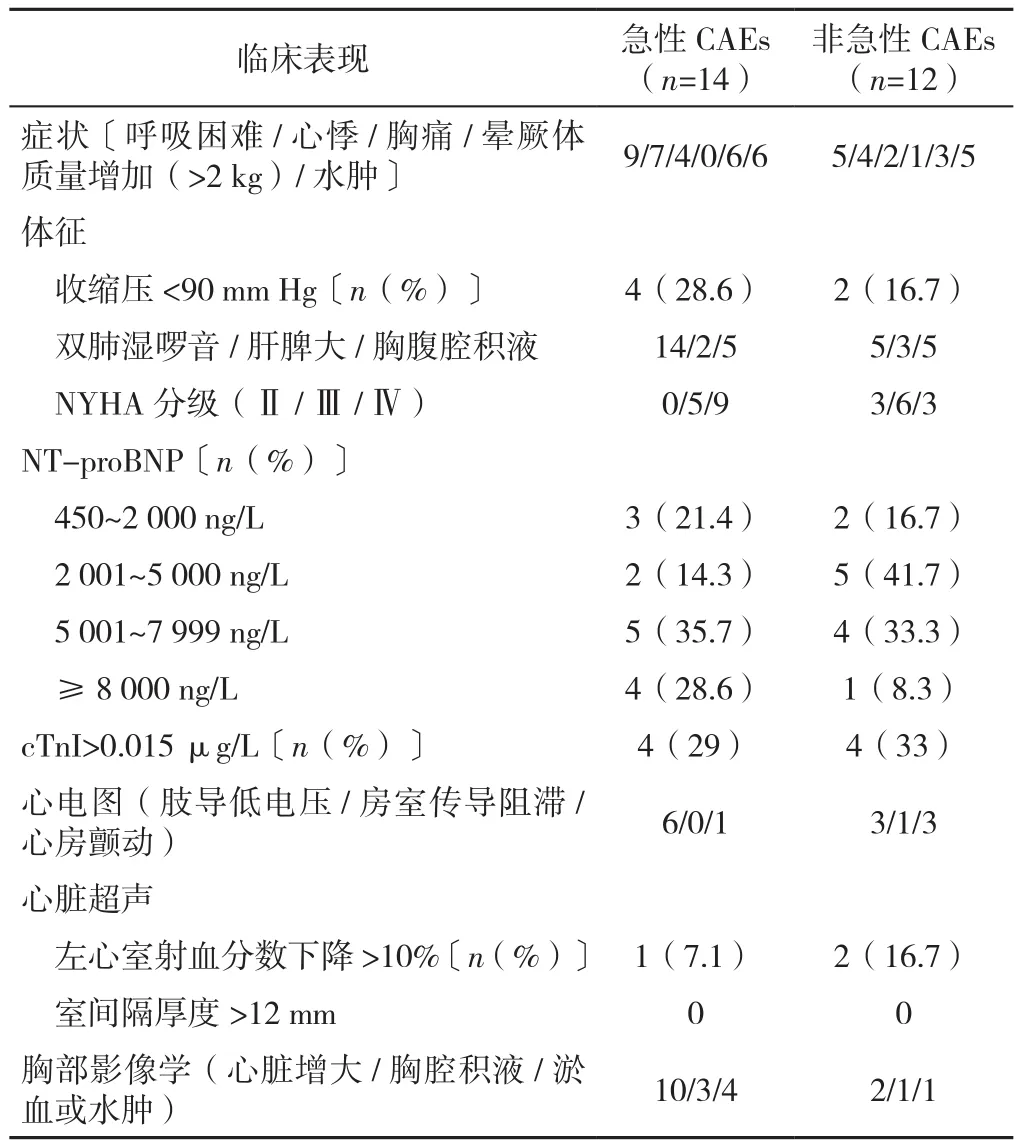
表3 26例患者的CAEs临床表现Table 3 Clinical features of CAEs in 26 newly diagnosed multiple myeloma patients
2.4 年龄、HGB、LDH、Scr对CAEs的诊断效能和ROC曲线 表1中经χ2检验得出差异有统计学意义的四个连续性计量资料:年龄、HGB、Scr、LDH,计算其AUC分别为0.686、0.726、0.712、0.700(见图2~5)。其中年龄对CAEs诊断的最佳截断值是66岁,灵敏度为65%,特异度为70%;HGB对CAEs诊断的最佳截断值是76 g/L,灵敏度为69%,特异度为76%;Scr对CAEs诊断的最佳截断值是176 μmol/L,灵敏度为62%,特异度为57%;LDH对CAEs诊断的最佳截断值是173 U/L,灵敏度为73%,特异度为64%。其中,HGB与Scr的AUC>0.7,被认为有较好的诊断效能。
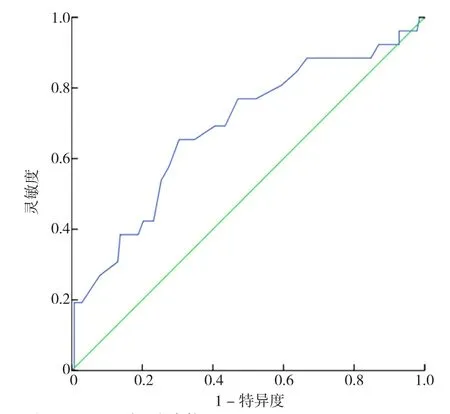
图2 年龄诊断CAEs风险的ROC曲线Figure 2 ROC analysis of age in predicting the risk of CAEs
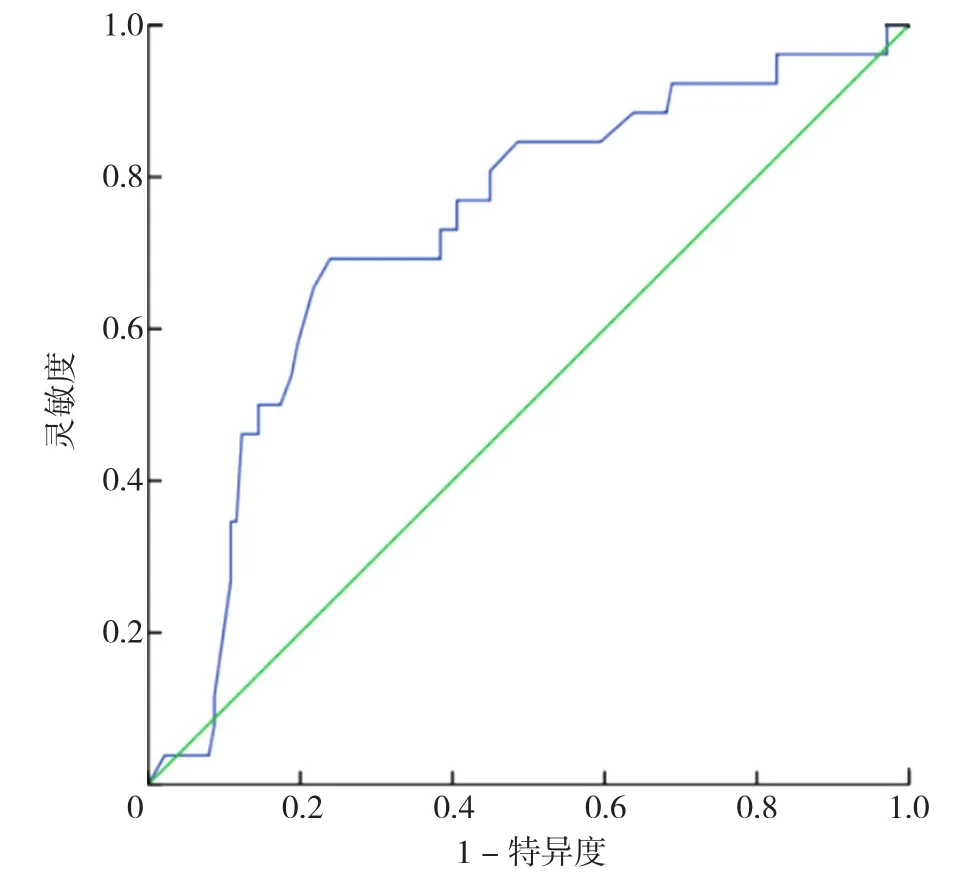
图3 血红蛋白诊断CAEs风险的ROC曲线Figure 3 ROC analysis of HGB in predicting the risk of CAEs
2.5 应用硼替佐米治疗期间发生CAEs的影响因素分析 首先以表4中二分类指标为自变量,其中年龄、HGB、Scr、LDH以截断值为界转化为分类指标,性别(赋值:男=1,女=2)、年龄(赋值:<66岁=1,≥66岁=2)、吸烟(赋值:无=1,有=2)、心脏病史(赋值:无=1,有=2)、心律失常(赋值:无=1,有=2)、冠心病(赋值:无=1,有=2)、心力衰竭(赋值:无=1,有=2)、高血压(赋值:无=1,有=2)、血栓事件(赋值:无 =1,有 =2)、HGB(赋值:≥ 76 g/L=1,<76 g/L=2)、Scr(赋值:<176 μmol/L=1,≥ 176 μmol/L=2)、LDH(赋值:<173 U/L=1,≥173 U/L=2),以是否发生CAEs(赋值:是=1,否=0)为因变量,进行单因素Logisitic回归分析,结果显示:两组年龄、吸烟、心脏病史、心力衰竭、高血压、HGB水平、Scr水平、LDH水平比较,差异有统计学意义(P<0.05);两组间性别、心律失常、冠心病、血栓事件比较,差异无统计学意义(P>0.05,见表4)。
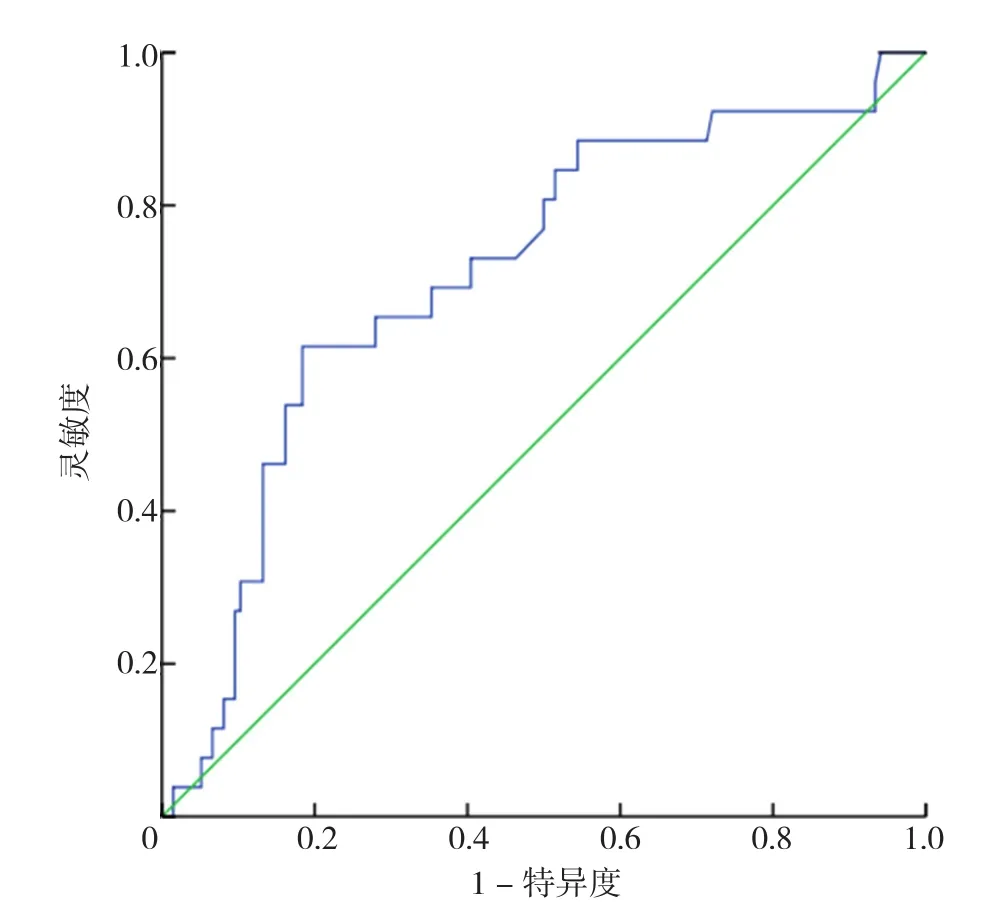
图4 血清肌酐诊断CAEs风险的ROC曲线Figure 4 ROC analysis of Scr in predicting the risk of CAEs
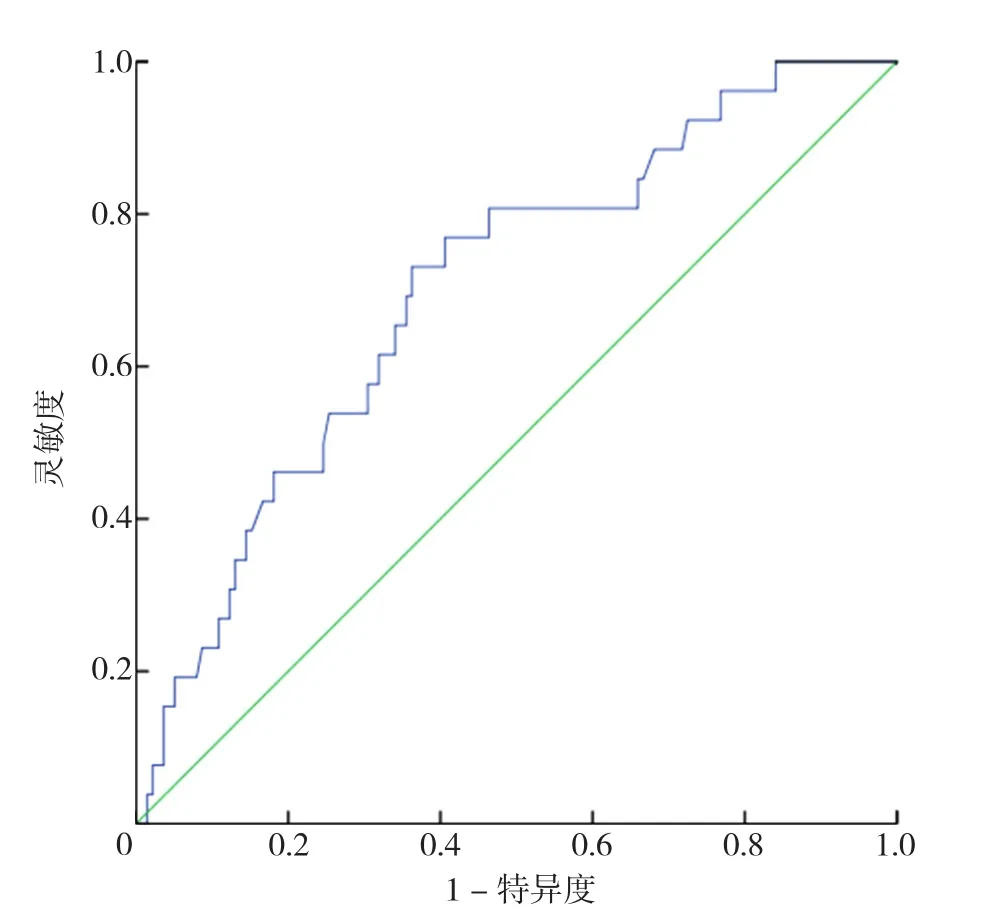
图5 乳酸脱氢酶诊断CAEs风险的ROC曲线Figure 5 ROC analysis of LDH in predicting the risk of CAEs
然后以上述有意义的指标年龄(赋值:<66岁=1,≥66岁=2);吸烟(赋值:无=1,有=2);心脏病史(赋值:无=1,有=2);心力衰竭(赋值:无=1,有=2);高血压(赋值:无 =1,有 =2);HGB(赋值:≥ 76 g/L=1,<76 g/L=2);Scr(赋值:<176 μmol/L=1,≥ 176 μmol/L=2);LDH(赋值:<173 U/L=1,≥ 173 U/L=2)为自变量,以是否发生 CAEs为因变量(赋值:是=1,否=0),进行多因素Logistic回归分析,结果显示,年龄≥66岁、吸烟、HGB<76 g/L、Scr≥176μmol/L、LDH≥173 U/L是应用硼替佐米治疗期间发生CAEs的危险因素(P<0.05,见表5)。

表4 应用硼替佐米治疗期间发生CAEs的单因素Logisitic回归分析Table 4 Univariate regression analysis of associated factors of CAEs in newly diagnosed multiple myeloma patients with bortezomib treatment
2.6 转归 患者用药期间无1例心脏骤停事件发生,根据CTCAE.4.0,3级或4级CAEs发生率为61.5%(16/26)。急性CAEs亚组患者预后最差,有4例因心力衰竭难以控制在2周内死亡。非急性CAEs亚组中无短期死亡病例。
经对症支持治疗后,26例CAEs患者中有6例(23.1%)继续原剂量1.3 mg/m2应用硼替佐米,15例(57.7%)减量至1.0 mg/m2并调整为周方案(每疗程的第1、8、15、22天)应用后,CAEs未再复发。
2.7 生存分析 CAEs组与对照组的中位OS分别为28个月与77个月,两组比较差异有统计学意义(χ2=66.563,P<0.01,见图6)。急性CAEs亚组与非急性CAEs亚组中位OS分别为9个月与36个月,两组比较差异有统计学意义(χ2=7.229,P<0.01,见图 7)。
3 讨论
自2005年APEX研究[13]首次监测应用硼替佐米发生CAEs以来,近十余年关于硼替佐米是否有心脏毒性一直存在争议。2016年,一项Meta分析报道了在临床试验中硼替佐米没有显著增加心脏毒性的风险[14]。然而,2017年的真实世界研究结果则完全相反,认为硼替佐米可增加CAEs的发生率(16.0%)[15]。近年来,硼替佐米相关心脏毒性事件备受关注,欧洲骨髓瘤网络(EMN)联合意大利动脉高压学会(SIIA)以及欧洲肿瘤内科学会(ESMO)推出了化疗相关心脏不良反应的管理指南[16-17]。因此,本研究通过分析NDMM患者应用硼替佐米期间CAEs的发生情况,探究其对OS的影响及相关危险因素,旨在寻找预防措施,降低硼替佐米治疗期间CAEs发生率,改善NDMM患者的预后。
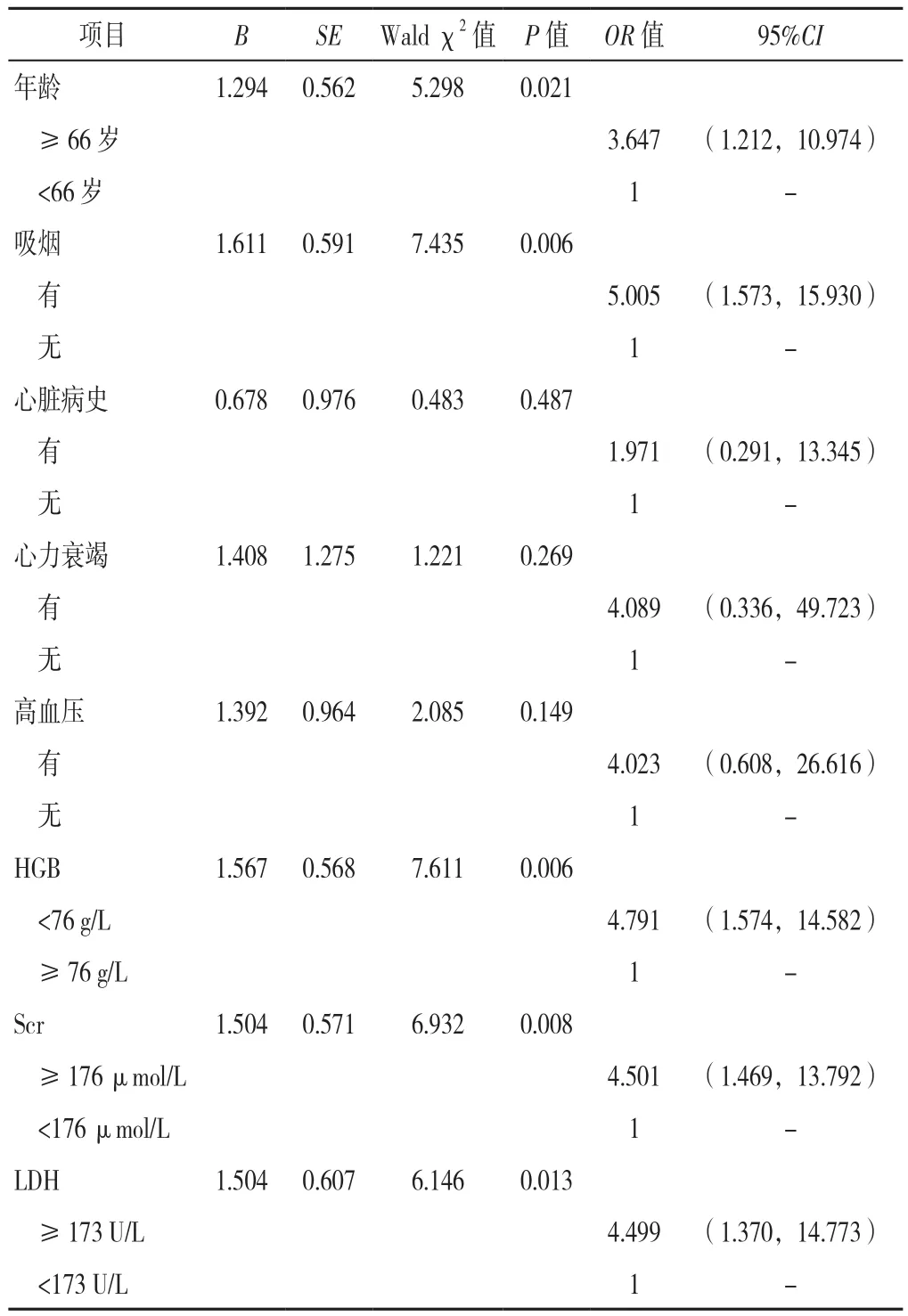
表5 应用硼替佐米治疗期间发生CAEs影响因素的多因素Logisitic回归分析Table 5 Multivariate regression analysis of associated factors of CAEs in newly diagnosed multiple myeloma patients with bortezomib treatment
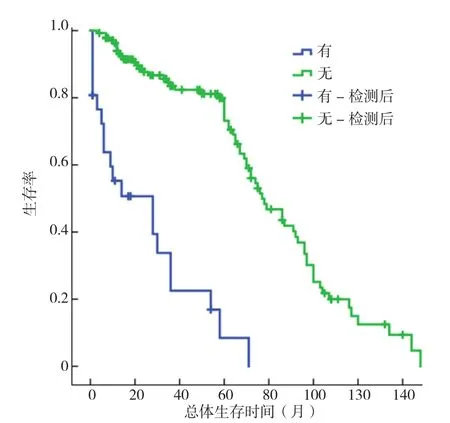
图6 CAEs组与对照组Kaplan-Meier生存曲线Figure 6 Kaplan-Meier survival between CAEs and control groups
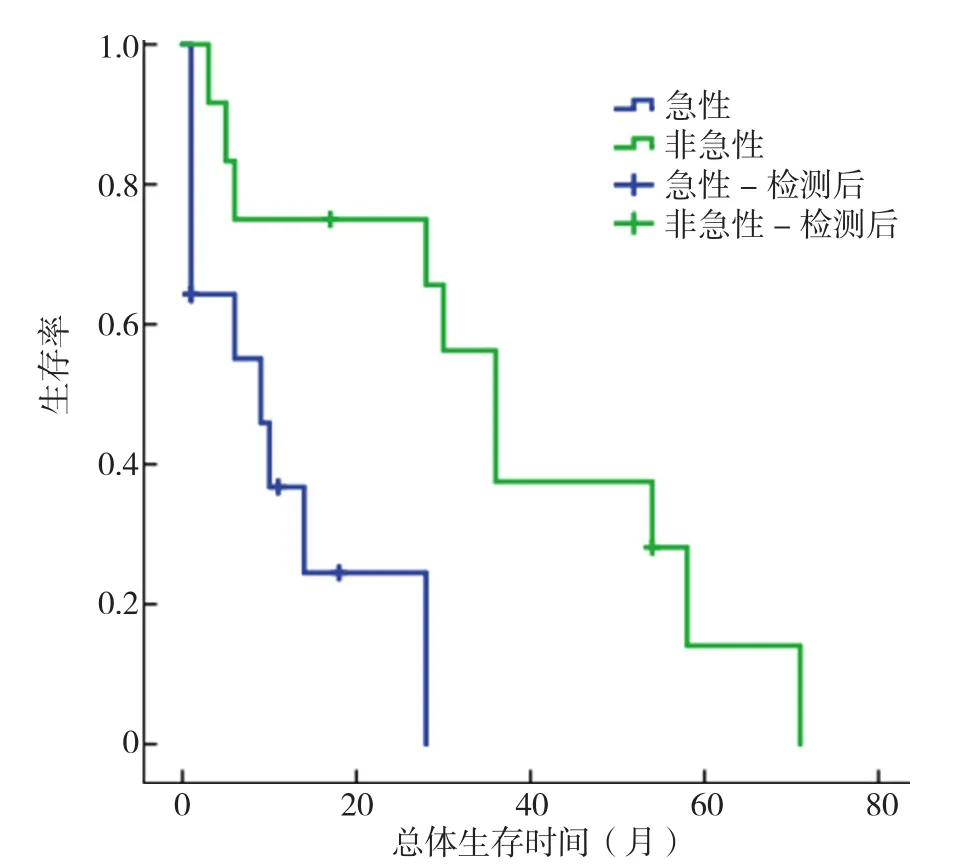
图7 急性CAEs亚组与非急性CAEs亚组Kaplan-Meier生存曲线Figure 7 Kaplan-Meier survival between acute and non-acute CAEs subgroups
本研究结果显示,CAEs发生率为15.9%,其中心力衰竭为11.0%,与一项真实世界倾向匹配性研究的结果很接近,MM患者心力衰竭的发病率为12.7%,而同期正常人群中心力衰竭的发病率仅为2.1%[18],提示硼替佐米相关性CAEs与心力衰竭的发生有关。本研究CAEs的发生率略低于另一项报道[15],硼替佐米治疗期间CAEs的发生率为16.0%,心力衰竭的发生率为13.6%,原因可能与纳入群体中包含CAEs发生率较高的另一种蛋白酶体抑制剂卡非佐米有关,而本研究则全部来自一种蛋白酶体抑制剂硼替佐米。
本研究CAEs发生时间的分布规律显示,第1个疗程出现CAEs最多,占53.8%,且14例全部为心力衰竭;其次为第4疗程前后,占23.1%,提示不同于蒽环类呈现的剂量依赖性心脏毒性,硼替佐米治疗期间的CAEs的发生率与累积剂量无关,该结论与程军等[19]的研究类似,发生CAEs集中分布在硼替佐米治疗第1个疗程与第4个疗程[19]。多项个案报道可逆性急性心力衰竭均发生于硼替佐米第1个诱导化疗周期[20-22]。值得一提的是,本研究中21例(80.8%)患者在CAEs症状控制后再次应用硼替佐米无CAEs发作,提示硼替佐米相关CAEs或是可逆性的,该观点符合欧洲肿瘤内科学会对化疗药物所致心脏不良反应的分类:以蒽环类为代表的传统化疗药物造成不可逆的心脏损伤呈现剂量依赖性,定义为Ⅰ类;而新型靶向药物造成可逆的心功能障碍与累积剂量无关,定义为Ⅱ类[17]。其机制可能与细胞内蛋白质降解主要受泛素-蛋白酶体途径调控,如果蛋白酶体的活性被改变,细胞就会停止生长,细胞凋亡的速率也会增加。但蛋白酶体抑制剂致心脏毒性的发生机制目前尚不明确,一种理论是蛋白酶体抑制剂会抑制心肌肌动蛋白转化,进而导致心肌细胞死亡[23];其他假说则认为受损蛋白质的降解会进一步导致心肌细胞功能及结构的异常。
本研究发现NT-proBNP在监测CAEs过程中的阳性率为100.0%,远高于其他辅助检查如cTnI、心电图、心脏超声及胸部影像学,是一项灵敏的预测手段,与文献中报道NT-proBNP可作为周期性预测心脏功能的灵敏指标[24]相一致。然而,其干扰因素较多(年龄和肾功能),中国心力衰竭诊断和治疗指南2018指出,NT-proBNP水平需根据年龄和肾功能进行分层:50岁以下的患者>450 ng/L,50岁以上>900 ng/L,75岁以上应>1 800 ng/L,肾功能不全(肾小球滤过率<60 ml/min)时应 >1 200 ng/L[8]。本研究中,CAEs组 65.4%患者年龄>65岁且大部分患者伴随肾功能不全,故NT-proBNP明显高于指南中的界定值,81%的患者NT-proBNP大于2 000 ng/L。因此,尽管受到干扰因素的影响,NT-proBNP仍可作为化疗前后监测CAEs的有效指标。此外,文献指出,若与心内科医师共同管理化疗过程,严密监测心脏功能,可及时中止有风险的化疗进程,有效减少CAEs的发生[15]。
本研究通过多因素分析证实了吸烟、贫血、肾功能异常为CAEs发生的独立危险因素。同时应用ROC曲线法测出临界值:HGB为76 g/L、Scr为176 μmol/L。有文献报道吸烟可以增加心力衰竭患者不良临床结局的风险[25]。而贫血与肾功能不全是MM的典型症状,未经治疗的NDMM常合并贫血与肾功能不全,因此首次化疗过程中CAEs发生率高,提示硼替佐米可能为人体在特殊状态下CAEs出现的诱发因素。相关文献报道,肾功能不全的MM患者应用硼替佐米时易诱发严重不良事件[26],而贫血也被认为是MM患者心血管并发症的危险因素[16]。除上述因素外,本研究结果同时显示出既往心脏病史,尤其是高血压对CAEs的发生也存在一定相关性,相似地,两项MM真实世界研究中均指出合并心脏相关基础疾病对CAEs的发生有着正相关作用[15,27]。
本研究生存分析显示CAEs组中位OS明显短于对照组OS,与文献中类似[28],提示CAEs有着独立于肿瘤因素的生存负性影响。本研究亚组分析结果显示,14例急性CAEs中有4例在2周内死亡,病死率明显高于文献报道[19],而12例非急性CAEs中无短期死亡病例,且急性CAEs亚组中位OS明显短于非急性CAEs亚组。原因之一是非急性CAEs患者经过前期化疗肿瘤负荷有所下降,贫血程度及Scr水平较初治时缓解;第二,在对MM患者长期管理过程中,动态监测心脏指标可提前预知CAEs的风险,早期干预有助于降低CAEs的相关病死率。
综上,本研究单中心NDMM患者应用硼替佐米相关CAEs发生率为15.8%(26/164),其中最常见的是心力衰竭,多发生于首次化疗期间;年龄≥66岁、吸烟、HGB<76 g/L、Scr≥176 μmol/L、LDH≥173 U/L为CAEs独立危险因素,支持硼替佐米为NDMM特殊状态下CAEs的诱发因素;大部分MM患者CAEs控制后再次用药无复发,提示CAEs是可逆性的;CAEs组患者的预后差,对生存有着负性影响,尤其是首疗程出现CAEs组患者,预后更差,死亡率较高。因此,NDMM患者在开始硼替佐米化疗前应加强对CAEs的预防,尽早评估危险因素,尤其是 HGB<76 g/L、Scr≥ 176 μmol/L的吸烟患者在硼替佐米化疗前应予以特别关注,积极给予相应治疗后再接受硼替佐米化疗或可减少治疗相关CAEs的发生。虽然回顾了近10年的患者资料,然而考虑到研究对象来自单中心,难免存在偏倚,仍需要扩大样本量来进一步证实硼替佐米对CAEs的作用。最后,呼吁多学科共同管理MM患者的化疗过程,联合心内科、肾内科医师可最大限度降低CAEs风险,改善NDMM患者预后。
作者贡献:黄仲夏主导了文章的构思、研究的可行性分析、图表的设计、论文的质量控制及审校,对文章整体负责;申曼负责数据收集、整理,研究的实施,论文框架的设计,统计学处理,结果的分析和解释,撰写论文;李新、张佳佳进行临床数据收集与分析;裴晓姣、潘振宇提供了放射影像资料;陈文明对讨论部分提出了重要建议。
本文无利益冲突。
