丹参酮ⅡA磺酸钠注射液对大鼠心肌细胞H9c2氧糖剥夺/复氧损伤模型的修复作用
2021-11-13苏梅娄雅静王姗秦引林
苏梅 娄雅静 王姗 秦引林
冠状动脉粥样硬化性心脏病简称冠心病,主要是由于冠状动脉内脂肪沉积、斑块形成,导致血管狭窄、阻塞,促使心肌缺氧缺血甚至坏死[1]。冠心病患者发病时,会因心肌急剧的暂时或持续性缺血、缺氧诱发心绞痛和心肌梗死等症状。临床上通常对最佳药物治疗有抵抗的患者进行经皮冠状动脉介入治疗(PCI),以解除冠心病患者冠状动脉狭窄、堵塞,恢复缺血区心肌组织的供血[2]。但由于缺血器官内代谢、供需的不平衡会导致严重的组织缺氧和微血管功能障碍,且PCI 治疗后的再灌注会进一步增强先天性和适应性免疫应答并激活细胞程序性死亡,加重组织损伤和炎症反应,这一现象称为缺血再灌注损伤[3,4]。丹参为唇型科植物丹参的干燥根和根茎,常用于活血化瘀,通经止痛。丹参酮ⅡA是丹参提取物中最丰富、结构最具有代表性的活性化合物,具有扩血管、抗氧化、抗炎和降低血液黏滞度等作用[5~7]。丹参酮ⅡA 经磺化后更稳定,起效更快,更适合临床使用。本研究通过观察丹参酮ⅡA磺酸钠(STS)注射液对大鼠心肌细胞氧糖剥夺/复氧(OGD/R)的作用效果,初步验证STS 注射液对心肌缺血再灌注损伤的预防和修复作用。
1 材料与方法
1.1 细胞和鉴定大鼠心肌细胞H9c2 经过复苏后,利用抗横纹肌肌动蛋白抗体(anti-Sarcomeric α-actinin,ab68167,abcam)进行免疫荧光染色鉴定。
1.2 主要实验材料
1.2.1 细胞实验主要材料 完全DMEM 培养基(凯基生物,KGM12800S);DMEM w/o Glucose(Gibco,11966025);胰蛋白酶-EDTA 消化液(Solarbio,T1300);1×PBS(0.01M,pH7.4)(凯基生物,KGB 5001);FBS(Gibco,10099-141);CCK-8 法:细胞增殖检测试剂盒(凯基生物,KGA317);葡萄糖(阿拉丁,G107850);STS 注射液(上海医药,2005310);H9c2 细胞(武汉普诺赛,CL-0089)。
1.2.2 检测实验所用材料 Annexin V-FITC/PI Apoptosis Kit(AP101-100-kit,MULTI SCIENCES 联科生物);CCK8 细胞增殖检测试剂盒(KGA317,凯基生物);改良Masson 三色染色液(G1345,Solarbio);中性树脂(CW0136,CWBIO);PCNA Polyclonal antibody(anti-PCNA,10205-2-AP,Proteintech);Cardiac Troponin T Polyclonal antibody(anti-cTnT,15513-1-AP,Proteintech);Goat Anti-Rabbit IgG-Cy3(As007,ABclonal);Goat Anti-Rabbit IgG-FITC(cw0114s,CWBIO);即用型DAPI 染液(KGA215-50,凯基生物)。
1.3 主要仪器设备
1.3.1 细胞实验主要仪器设备 CO2培养箱(上海一恒科学仪器有限公司,BPN-80CW);倒置荧光显微镜(广州市明美光电有限公司,MF53);洁净工作台(BIOBASE,BBS-SDC);医用离心机(长沙英泰仪器有限公司,TD4A);酶标仪(北京六一生物科技有限公司,WD-2102B);三气培养箱(长沙华曦电子科技有限公司,YCP-10S)。
1.3.2 检测相关实验主要仪器设备 旋涡混合器(XH-C,常州越新仪器制造有限公司);低温高速离心机(TGL-16D,常州中捷实验仪器制造有限公司);NovoCyteTM流式细胞仪[NovoCyte 2060R,艾森生物(杭州)有限公司];电热恒温培养箱(DHP-9054,山东博科生物产业有限公司);显微镜(BX43,OLYMPUS)。移液枪(Research plus 0.5~10μl,eppendorf);移液枪(Research plus 20~200μl,eppendorf);移液枪(Research plus 100~1 000μl,eppendorf);高压锅(YS20ED,苏泊尔)。
1.4 实验方法
1.4.1 药物配制 葡萄糖:称取葡萄糖粉末1.8g,加入10ml 无菌去离子水,溶解得到1M(180g/L)母液,1ml 完全培养基中加入25μl 葡萄糖母液,得到浓度为4.5g/L 的溶液。
STS 注射液:5mg/ml 的注射液中STS 浓度为12.6μmol/ml,向1ml 注射液中加入0.26ml 无菌去离子水得到10μmol/ml 母液,根据不同工作浓度进行稀释即可。
1.4.2 实验分组 ①正常细胞组(常规培养不加干预);②模型组(OGD/R 6h/18h);③模型+低浓度STS 处理组(OGD/R+5μM STS);④模型+中浓度STS 处理组(OGD/R+10μM STS);⑤模型+高浓度STS 处理组(OGD/R+15μM STS)。
1.4.3 细胞实验操作 传代与铺板:弃去细胞培养上清液,用1×PBS 洗两遍,加入0.25%胰酶(含0.02%EDTA)消化,待细胞变圆后加入培养基终止消化并收集细胞悬液至10ml 离心管中,1 000rpm 离心3min,弃去上清液加入培养基重悬细胞;24 孔板每孔铺细胞3×104个,培养基体积为500μl;6 孔板每孔铺细胞5×105个,培养基体积为1.5ml 待细胞完全贴壁后进行药物处理和OGD/R 造模。
细胞药物处理与造模:将模型组、模型+STS 处理各组细胞使用PBS 洗涤2 遍,加入不完全DMEM培养基,模型+STS 处理组分别加入STS 5μM、10μM、15μM,放置在三气培养箱中缺氧处理(缺氧条件:1%氧气+5%CO2+94%N2),6h 后进行复氧、复糖处理,18h 后进行流式凋亡、免疫荧光、Masson 检测。
1.4.4 细胞活性检测(CCK-8 检测) 待细胞密度约80%~90%时,将细胞进行消化、重悬、计数、铺板,待细胞贴壁后,加入不同浓度的STS 处理24h,将待测的96 孔板细胞换成相同的培养基,每孔100μl;每孔加入10μl CCK-8 试剂,置于培养箱中孵育2h;酶标仪在450nm 波长处检测每孔的吸光值。
1.4.5 流式检测凋亡 按照实验分组处理细胞后,消化并收集细胞,加入1ml PBS 后1 500rpm 离心3min,再用PBS 洗2 遍。用双蒸水将5×Binding Buffer 稀释为1×Binding Buffer。取300μl 预冷的1×Binding Buffer 重悬细胞。每管各加入3μl Annexin V-FITC 和5μl PI-PE 或3μl Annexin V-APC 和5μl 7-ADD。轻微混匀后,室温避光孵育10min。再向每管中加入200μl 预冷的1×Binding Buffer。混匀后上流式细胞仪检测。
1.4.6 细胞Masson 染色 将细胞去上清后做常规固定,切片浸入Bouin 液,置于温室过夜进行媒染,蒸馏水冲洗至切片上的黄色消失。使用天青石蓝染液滴染3min 后稍水洗,再用Mayer 苏木素染色液滴染3min 后稍水洗,随后用酸性乙醇分化液分化数秒,流水冲洗10min。加入丽春红品红染液滴染10min,蒸馏水稍冲洗。再用磷钼酸溶液处理10min。弃去上清,切片不用水洗,直接滴入苯胺蓝染液染5min。随后用弱酸溶液处理2min。染完色后用95%的乙醇快速脱水。无水乙醇脱水3 次,每次10s。用二甲苯透明3 次,每次2min。最后用中性树脂封固。
1.4.7 细胞免疫荧光双染 细胞固定:在培养板中将已爬好细胞的培养皿用PBS 浸洗3 次,每次3min;用4%的多聚甲醛固定15min,PBS 浸洗培养皿3次,每次3min;细胞通透:0.5% Triton X-100(PBS配制)室温通透20min。封闭:PBS 浸洗培养皿3次,每次5min,移液枪吸干PBS,在培养皿上滴加5%BSA,37℃封闭30min。一抗孵育:移液枪吸掉封闭液,不洗,每个培养皿滴加足够量的、稀释好的一抗anti-cTnT(1∶200),4℃孵育过夜;加荧光二抗:PBS 浸洗培养皿3 次,每次3min,移液枪吸干培养皿内多余液体后滴加稀释好的荧光二抗Goat Anti-Rabbit IgG-Cy3(1∶100),37℃孵育30min,PBS浸洗培养皿3 次,每次3min;从加荧光二抗起,后面所有操作步骤尽量在较暗处进行;二次封闭:PBS浸洗培养皿3 次,每次5min,移液枪吸干PBS,在培养皿内滴加5%BSA,37℃封闭30min。一抗孵育:移液枪吸掉PBS,每个培养皿内滴加足够量的、稀释好的一抗anti-PCNA(1∶200),37℃孵育3h。加荧光二抗:培养皿复温至室温后,PBS 浸洗培养皿3 次,每次5min,移液枪吸干培养皿内多余液体后滴加稀释好的荧光二抗Goat Anti-Rabbit-FITC(1∶100),37℃孵育45min,PBS 浸洗切片3 次,每次5min;复染核:滴加DAPI 避光孵育5min,对标本进行染核,用PBS 浸洗多余的DAPI;封片:用20%甘油封闭培养皿,然后在荧光显微镜下观察采集图像。染色结果判读:FITC 绿色荧光指示PCNA 定位,Cy3 红色荧光为cTnT 定位,蓝色荧光为细胞核。
1.5 数据分析所得数据用 GraphPad Prism 软件作图,采用SPSS 19.0 软件包进行处理,以均数±标准差(±s)表示,P<0.05 表示差异有统计学意义。
2 结果
2.1 细胞鉴定冻存的大鼠心肌细胞H9c2 经过复苏和培养后,利用特异性抗体anti-Sarcomeric α-actinin 进行免疫荧光鉴定。检测其胞内横纹肌肌动蛋白表达量。结果如图1所示,在不同视野下细胞生长形态均正常,胞内有特异性的横纹肌肌动蛋白表达且呈现典型的细胞骨架样分布。
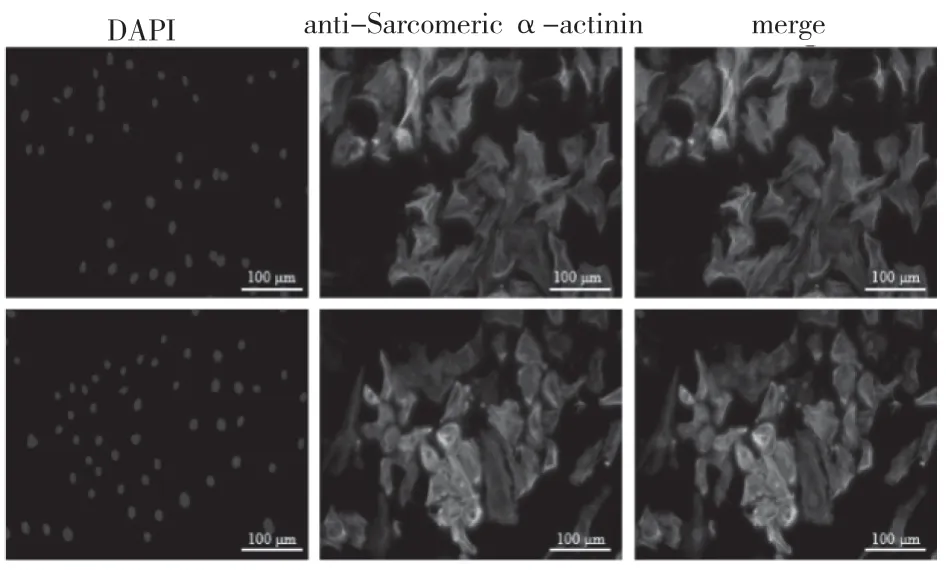
图1 免疫荧光检测大鼠心肌细胞H9c2 横纹肌肌动蛋白的表达和分布
2.2 药物处理细胞的适宜浓度范围在所培养的细胞中加入不同浓度的STS,以摸索药物处理细胞适合的浓度范围。结果表明,STS 浓度≤15μM 时未出现对细胞活力的显著干扰,但是随着药物浓度的增加,在20μM 时细胞活力呈下降趋势(P<0.05)。因此确定药物的适宜处理浓度≤15μM,见图2。
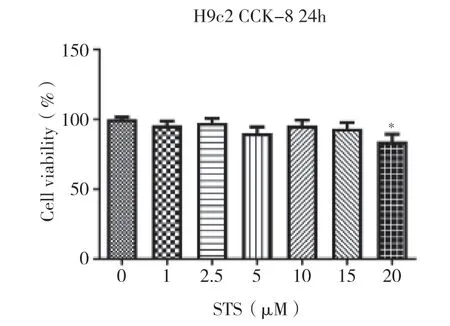
图2 CCK-8 法检测各浓度STS 处理后细胞的活力变化
2.3 不同浓度STS 对细胞OGD/R 模型的药效在确定了STS 的适宜处理浓度后,在处理组中设置了5μM、10μM 和15μM 3 个浓度。细胞在无糖培养基中孵育并加入上述浓度的药物后,置于三气培养箱模拟低氧环境(1%O2+5%CO2+94%N2)培养6h。在1.5ml 的培养基体系中补充150μl FBS 和37.5μl 葡萄糖(1M),并置于常规CO2培养箱以实现复糖复氧培养,从而建立细胞糖氧剥夺后复氧复糖所造成的损伤模型。经过18h 的常规培养后,利用细胞凋亡检测试剂盒对细胞染色,并利用流式分析仪检测细胞的凋亡率。结果如图3所示,正常组细胞的自然凋亡率为8.59%,模型组的细胞凋亡率为52.87%。表明经过氧糖剥夺和复氧复糖之后,细胞出现了显著的损伤,模型构建成功。在3 个处理组中,不同浓度的STS 均能显著下调细胞的凋亡率,且与药物处理浓度呈现剂量依赖的趋势,表明经过STS 处理后能显著预防因氧糖剥夺和复氧复糖所造成的细胞损伤,其中以15μM 的STS 浓度处理细胞后效果最好,凋亡率为12.1%。

图3 流式仪检测不同浓度STS 对OGD/R 模型中细胞凋亡的抑制效果
2.4 Masson 染色检测在使用上述药物浓度处理细胞后,利用Masson 染色来检测经造模和药物干预后细胞形态和纤维化的程度。染色结果如图4所示,分别选取3 个视野观察。结果表明正常组细胞Masson 染色后主要呈现蓝色,说明其胶原纤维居多,模型组染色后呈红色,为肌纤维,不同浓度STS 处理后与模型组比较其红色减弱,表明STS 能一定程度地减轻细胞因造模导致的纤维化。
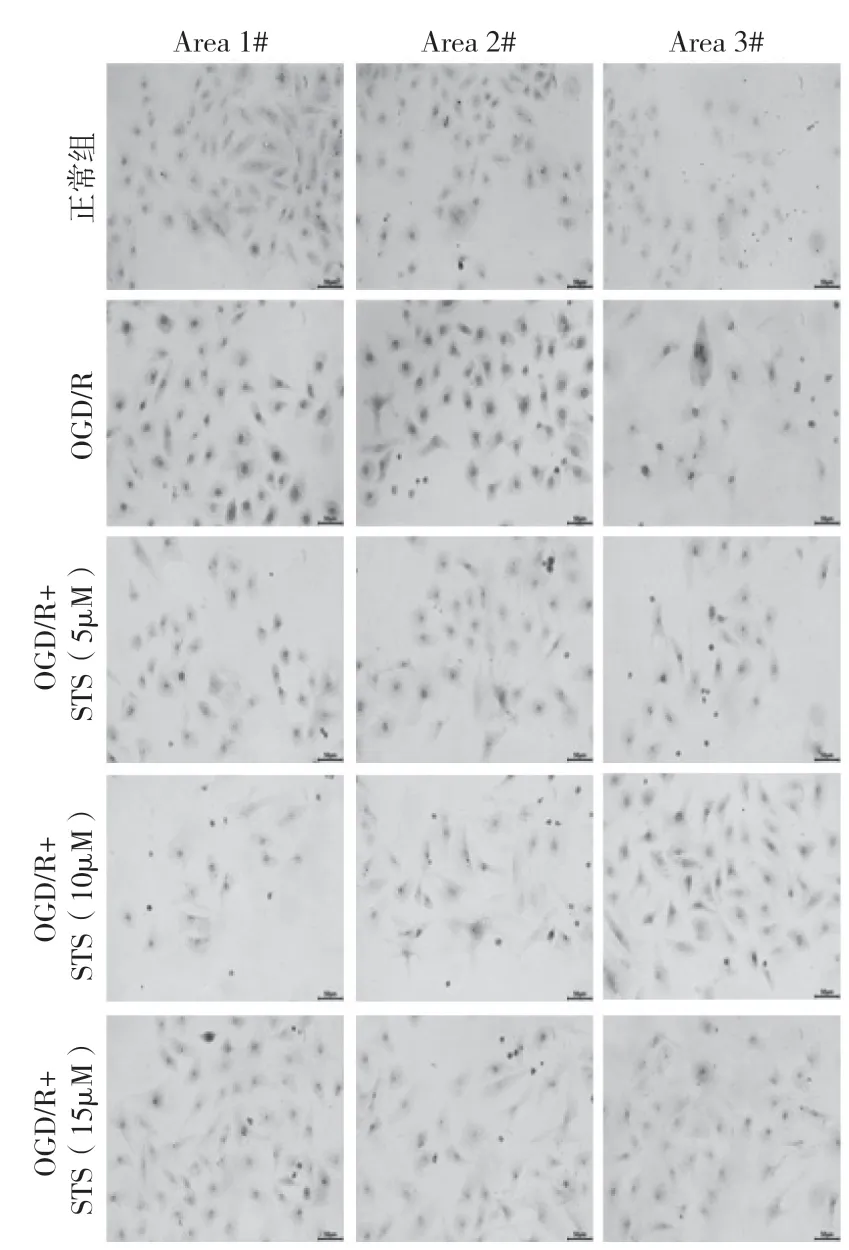
图4 Masson 染色检测心肌细胞形态和纤维化程度
2.5 免疫荧光检测胞内PCNA 和cTnT 表达量在各组细胞中均能检测到PCNA 和cTnT 的表达。但是细胞经过OGD/R 造模后密度显著降低,其胞内的PCNA 和cTnT 免疫荧光染色信号也有所减弱。经过不同浓度的STS 处理后,细胞密度有所升高,细胞形态也有所改善(见图5)。通过对免疫荧光信号强度分析,OGD/R 造模后细胞的PCNA 表达量有所降低,但是经过15μM 的STS 处理后其表达量显著上调(P=0.005)。OGD/R 造模后,细胞的cTnT 表达量降低,经10μM 的STS 处理后,其表达量显著上调(P=0.013)(见图6)。
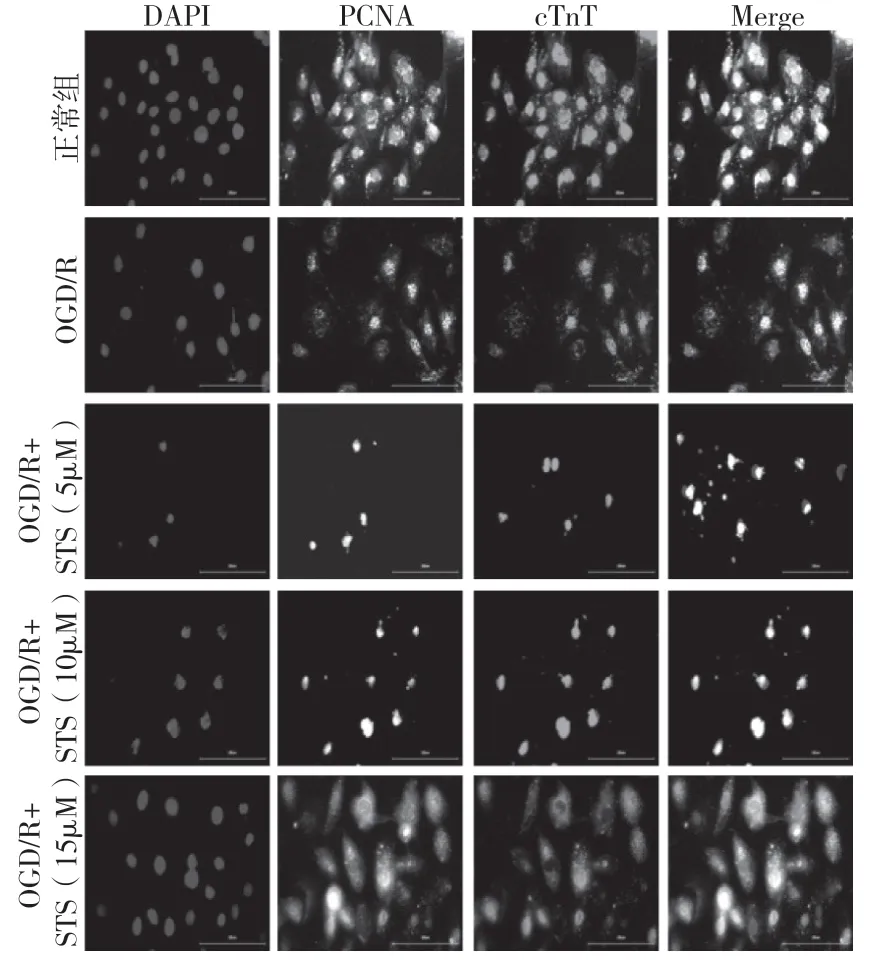
图5 免疫荧光双染检测细胞内PCNA 和cTnT 表达量变化
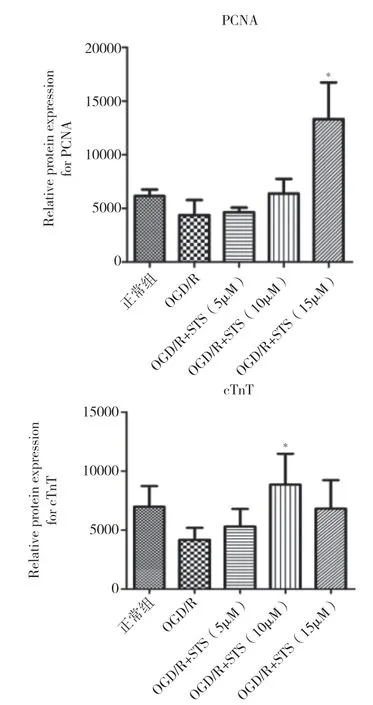
图6 定量分析免疫荧光双染检测细胞内PCNA 和cTnT 表达量变化
3 讨论
冠心病的发作往往是由于冠状动脉内斑块的侵蚀或易损斑块的破裂,使动脉粥样硬化斑块的脂质核心中高度促凝成分暴露于循环的血小板和凝血蛋白中,最终导致冠状动脉内血栓形成[8]。冠心病早期治疗可以降低心肌损伤的程度。因此,快速诊断和早期治疗是冠心病治疗的中心原则[9]。由于疾病会损害细胞膜的完整性,心肌坏死伴随着结构蛋白和其他细胞内大分子向心脏间质的释放。心肌坏死的生物标志物包括心肌肌钙蛋白I 和T(cTnI和cTnT)、肌酸激酶、肌红蛋白、乳酸脱氢酶。其中,cTnT 是检测心肌损伤的首选生物标志物。研究表明,cTnT 浓度升高不仅与病变的程度、心肌组织受损有关,还与血管成形术中不良预后有关[10]。临床上cTnT 的检测有助于早期排除心肌梗死[11]。PCNA 是存在于增殖细胞中且呈阶段性表达的蛋白质。PCNA 表达增强,常常代表着DNA 复制和修复[12]。本研究中对PCNA 和cTnT 的检测能够反映STS 对心肌细胞损伤的保护和修复作用。
本研究采用了惰性气体N2对大鼠心肌细胞H9c2 造模,体外模拟冠心病、心肌梗死等治疗后产生的心肌缺血再灌注损伤,该造模方法操作简单易复制,较为环保[13]。此模型可以直接观察STS 对细胞凋亡的抑制、生长形态等方面的影响,从OGD/R模型组可以看出心肌细胞H9c2 经过OGD/R 后,细胞凋亡、损伤以及纤维化明显,可广泛用于该类试验的造模,此与既往研究相一致[14~16]。
STS 注射液是主要成分为STS 的红色澄明液体,STS 是丹参酮ⅡA 经磺化后得到的衍生物,改善了丹参酮ⅡA 水溶性和生物利用度较低的缺陷[17]。研究表明,STS 能够降低患者的QT 离散度,提高左室射血分数,从而改善患者的心功能,降低心肌梗死再灌注治疗患者室性心律失常的发生率[18]。还能通过抑制心肌细胞增生、降低胆固醇的含量、提高NO含量、抗炎等作用有效缓解心绞痛等症状[19]。从本实验结果可看出,10μM 和15μM 浓度的STS 能显著预防和改善由造模所引起的细胞凋亡和形态异常,显著上调细胞内cTnT 和PCNA 表达水平。发生心肌梗死和心绞痛的时候,由于缺血缺氧等原因,持续的细胞坏死和凋亡共同主导患者心肌细胞的死亡过程[20]。而STS 能够促进OGD/R 模拟的心脏梗死后仍有活力的心肌细胞增殖来改善心脏功能。
本研究通过验证STS 对OGD/R 细胞的保护作用,进一步证明了STS 治疗冠心病、心绞痛等疾病的有效性,并为临床用药提供数据支持。但后续仍需做深入研究,探讨可能的作用机制。
