辅助能量物质与谷胱甘肽协同作用促进环磷酸腺苷发酵生产
2021-10-24李志刚张朝辉卢南巡张中华常景玲
李志刚,张朝辉,谭 海,卢南巡,张中华,常景玲,
(1.现代生物育种河南省协同创新中心,河南新乡 453003;2.河南科技学院生命科技学院,河南新乡 453003)
环磷酸腺苷(cAMP)是生命体中的第二信使,对细胞的糖、蛋白质以及核苷酸等物质代谢具有重要的调节作用[1−2]。作为药物具有提高心肌细胞收缩力以及提高机体抗病毒、免疫力的作用,主要用于心血管疾病的治疗;作为饲料添加剂广泛用于畜禽产品的生产中,具有重要的应用价值[3]。
在微生物细胞中,cAMP以ATP为底物直接环化形成,强化能量代谢和ATP合成有利于产物的快速持续积累。以柠檬酸盐为代表的辅助能量物质,一方面能够直接作为碳源为细胞提供能量,一方面调节糖酵解与三羧酸循环间的碳流分配,有利于核苷酸的形成,广泛用于各类高耗能产物的发酵生产中[4−7]。Wang等[8]利用Candida utilis. CCTCC 209298发酵生产腺苷蛋氨酸时添加柠檬酸钠,细胞能量代谢得到强化,与对照相比,产物浓度提高了27.5%。Chen等[9]利用柠檬酸钠抑制糖酵解途径,使更多碳流分配到磷酸戊糖途径显著提高了cAMP产量和生产效率。Xia等[10]通过Strptomyces albulusPD-1发酵合成聚赖氨酸时添加柠檬酸,显著提高了产物浓度。但是,在上述报道中,柠檬酸盐添加导致发酵后期产物合成停滞或发酵周期不同程度缩短的现象。本实验室前期开发了利用柠檬酸钠促进cAMP合成的发酵工艺,发酵后期也存在产物合成停滞的现象[11]。
活性氧(ROS)是由于电子呼吸链运行时出现电子泄漏而产生的,几乎所有好氧型微生物细胞内都会产生[12]。由于细胞具有一定的抗氧化能力,少量ROS产生不会影响细胞正常代谢活动。但是,细胞内能量代谢水平提高,电子呼吸链泄漏电子的量也会增加,导致更多ROS产生。如果细胞长时间处于高浓度ROS条件下,细胞膜、酶蛋白以及遗传物质就会造成损伤,影响细胞活性、生长以及产物的合成[13−14]。
添加辅助能量物质导致cAMP发酵后期产物合成停滞,限制了产物的合成以及产量的进一步提高。针对这一问题,本文对分别添加柠檬酸钠和丙酮酸钠的cAMP发酵过程的发酵动力学、菌体活性、能量代谢以及活性氧等的变化规律进行研究,阐明导致产物合成停滞的原因,并提出了耦合添加辅助能量物质和谷胱甘肽的发酵工艺,为进一步促进产物积累以及提供参考。
1 材料与方法
1.1 材料与仪器
节杆菌Arthrobactersp. CCTCC2013431 本实验室筛选并保藏的;NADH、NAD+、AMP、ATP、cAMP、TAB(硫代巴比妥酸)、氯化碘硝基四氮唑(分析纯)、NADH/NAD+与NADPH/NADP+测定试剂盒 北京索莱宝科技有限公司;乙腈、甲醇、三乙胺、磷酸 分析纯,国药集团化学试剂有限公司;AlamarBlue细菌活性检测试剂盒、DHE-ROS活性氧检测试剂盒 上海贝博生物科技公司;其他试剂均为分析纯。
BIOTECH-7BG发酵罐 上海保兴生物设备有限公司;752N紫外分光光度计 上海仪电科学仪器股份有限公司;F-280型荧光分光光度计 天津港东科技股份有限公司;VC150超声波破碎仪 美国Sonics & Materials公司;Aglient 1260 Infinity液相色谱仪 美国安捷伦科技有限公司;Multiskan GO全波长读数仪 赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 培养基配制 发酵培养基(g/L):葡萄糖50,K2HPO410,KH2PO410,尿素10,生物素0.005,CoCl20.01,蛋白胨5,次黄嘌呤2,调pH至7.2,121 ℃高温灭菌20 min。
1.2.2 培养方法 发酵罐培养方法参考文献[11]。发酵罐装载5 L发酵培养基,接种量10%,培养温度30 ℃,初始pH7.4,当pH降至6.8时维持不变。在发酵0、12、19、26、36、43、50、60、67和72 h进行取样,用于发酵动力学参数、关键酶活性、辅因子以及活性氧水平等的测定。柠檬酸钠、丙酮酸钠和谷胱甘肽添加方式:发酵0 h添加到发酵液中,添加量分别为3、3和2 g/L,即添加后发酵液中浓度分别达到3、3和2 g/L。对照批次为不添加柠檬酸钠、丙酮酸钠和谷胱甘肽的发酵批次。
1.2.3 指标测定
1.2.3.1 菌体浓度测定 采用光密度法测定,发酵液稀释适当倍数测定600 nm波长下吸光度,测定值乘以稀释倍数即为菌体浓度OD600;菌体干重(DCW)通过关系式0.46×OD600计算得出[15]。
1.2.3.2 cAMP浓度测定 使用高效液相色谱进行测定[16],发酵液9000 r/min离心10 min,上清液经0.45 μm水相膜过滤待用。色谱柱为Lichrospher C18柱(300 mm×4.6 mm),进样量2 μL,有机相为甲醇,水相为磷酸三乙胺缓冲液,水相与有机相体积比70:30,流速0.8 mL/min,柱温30 ℃,波长254 nm。
1.2.3.3 CO2含量测定 尾气中CO2含量由尾气分析仪在线测定。
1.2.3.4 细胞活性测定 使用AlamarBlue细菌活性检测试剂盒,通过荧光分光光度计测定荧光强度表示细胞活性,激发波长540 nm,发射波长590 nm,具体操作方法见说明书。
1.2.3.5 胞内辅因子含量测定 根据cAMP浓度和合成速率的变化规律,选择26、36、50和60 h等能够很好反映细胞生理状态的样品,对辅因子含量进行测定,后面ROS、MDA水平以及呼吸链脱氢酶活性的测定同样选择这4个时间的样品进行测定。取5 mL发酵液在4 ℃条件下,9000 r/min离心10 min,所得菌体于液氮中处理2 min终止菌体代谢,保存于−70 ℃超低温冰箱中待用。胞内ATP、AMP使用HPLC进行测定,菌体洗涤两次,悬浮于5 mL PBS缓冲液中,冰浴条件下超声波破碎10 min,破碎液在低温条件下12000 r/min离心15 min,上清液经0.22 μm滤膜过滤后待测。色谱柱为LaChrom C18-AQ柱(250 mm×4.6 mm),有机相为乙腈,水相为NaH2PO4、Na2HPO4和四丁基溴化铵混合溶液,水相与乙腈体积比为92:8,流量0.5 mL/min,柱温30 ℃,检测波长258 nm[16]。胞内NADH与NAD+浓度采用试剂盒测定,具体方法见说明书;胞内NADPH与NADP+浓度采用试剂盒测定,具体方法见说明书。
1.2.3.6 呼吸链脱氢酶活性 采用氯化碘硝基四氮唑(INT)显色反应测定[17]。
1.2.3.7 胞内ROS、MDA含量测定 ROS通过DHEROS活性氧检测试剂盒使用荧光分光光度计测定的荧光强度表示,具体方法见说明书;丙二醛(MDA)含量采用TBA法进行测定,MDA与硫代巴比妥酸在高温酸性条件下反应生成红棕色物质,测定532和600 nm波长下吸光度,计算得出,具体方法参照文献[14,18];蛋白浓度采用考马斯亮蓝染色法测定[19]。
1.2.3.8 生长速率和cAMP合成速率的计算

式中:RX和RP分别表示相临取样点间隔时间内的平均细胞生长速率和cAMP合成速率,g/(L·h);t1表示起始发酵时间,h;t2表示节点发酵时间,h;c(X)和c(P)分别表示细胞浓度(OD600)和cAMP浓度,g/L;参数取三次测定值得平均值。
1.3 数据处理
发酵罐培养实验定时取样,测定发酵指标时每个样品测三次。用Excel进行数据处理,应用Origin 8.5软件作图。
2 结果与分析
2.1 添加辅助能量物质对cAMP发酵性能的影响
在7 L发酵罐上进行了分别添加柠檬酸钠和丙酮酸钠的发酵实验,分析辅助能量物质对cAMP发酵性能和细胞代谢的影响,探寻进一步促进产物合成的方法。如图1A所示,三个发酵批次的菌体终浓度相差不大,但是,与对照相比,添加柠檬酸钠、丙酮酸钠批次的菌体浓度在50 h前明显处于较高水平,50 h后这两批次的菌体生长停滞,而对照批次仍保持缓慢增长的状态。图1B结果显示,三批次的菌体生长速率在24 h均达到最大值,此时添加柠檬酸钠、丙酮酸钠发酵批次比对照的分别提高了43.5%和60.2%,之后迅速下降,32 h至发酵结束一直低于对照批次,55 h后这两批次的生长速率变为负值。cAMP测定结果表明,添加柠檬酸钠、丙酮酸钠批次的cAMP浓度在50 h达到最大值3.68和4.02 g/L,分别比对照提高10.8%和21.1%,50 h后cAMP浓度不再增加,而对照仍保持不断增加的状态(图1C)。另外,三批次的cAMP合成速率在32 h均达到最大值,与对照相比,添加柠檬酸钠、丙酮酸钠批次的合成速率分别提高了48.2%和61.6%,之后迅速下降,40 h后一直低于对照,55 h后合成速率变为负值(图1D)。这表明,辅助能量物质能够有效促进菌体生长和cAMP合成,使菌体和产物浓度迅速积累,但在发酵后期细胞生长变的缓慢,产物合成开始停滞,前期的良好状态不能继续维持。相关报道表明,柠檬酸盐和丙酮酸盐[20−21]作为辅助能量物质可以强化能量代谢,具有促进菌体快速生长,促进肌苷、聚赖氨酸及腺苷蛋氨酸等多种发酵产物积累的作用,但也存在发酵周期缩短以及后期产物合成停滞的现象[7−10]。因此,阐明辅助能量物质导致发酵后期细胞生长缓慢、产物合成停滞的原因,对进一步促进这些产物合成与积累具有重要意义。

图1 添加辅助能量物质对细胞生长和cAMP发酵合成的影响Fig.1 Effects of auxiliary energy substances on cells growth and cAMP fermentation synthesis
尾气中CO2含量反映了细胞呼吸代谢的强度,而利用AlamarBlue检测试剂盒测得的荧光强度则反映了菌体细胞的活性。对上述发酵批次中菌体的呼吸强度和细胞活性进行测定,结果如图2所示。三个批次的CO2含量和细胞活性均呈现先升后降的变化规律,对照批次的变化趋势相对平缓,而添加柠檬酸钠、丙酮酸钠发酵批次的CO2含量和细胞活性在发酵前期快速提升,明显高于对照批次,在发酵36 h后迅速下降,在50 h后明显低于对照批次。这表明辅助能量物质在前期可以明显提高细胞活性,但此状态未能长时间维持,可能是细胞受到损伤,导致细胞活性下降,进而使菌体生长和产物合成能力弱化。

图2 辅助能量物质对细胞活性及呼吸代谢的影响Fig.2 Effects of auxiliary energy substances on cell viability during fermentation period
2.2 添加辅助能量物质对细胞能量代谢的影响
对反映细胞能量代谢水平的胞内辅因子含量和电子呼吸链活性进行了测定,结果如图3所示。与对照相比,添加柠檬酸钠、丙酮酸钠发酵批次的NADH/NAD+得到极显著(P<0.01)提高(60 h前),ATP/AMP在发酵前期明显高于对照,但50 h后剧烈下降,明显低于对照;同时呼吸链脱氢酶活性也表现出与ATP/AMP相同的变化趋势。柠檬酸盐和丙酮酸盐作为辅助能量物质,能够提高三羧酸循环的代谢水平,提高胞内NADH/NAD+比例,进而促进ATP的合成[20,22]。电子呼吸链能够接受NADH的电子,将其氧化形成NAD+,电子经呼吸链传递释放能量,催化磷酸化反应合成ATP,电子呼吸链是细胞ATP合成的重要途径[23−24]。因此,可以推测,发酵前期辅助能量物质有效提高了NADH/NAD+,在电子呼吸链高效运行的情况下大量合成ATP,为菌体生长和产物合成提供了有利条件;但由于呼吸链高速运行增加了电子的泄漏,产生大量的活性氧自由基,造成细胞组分损伤和呼吸链相关酶活性的降低,导致发酵后期ATP/AMP极显著低于对照(P<0.01),进而影响菌体活性和产物合成。

图3 添加辅助能量物质对细胞能量代谢的影响Fig.3 Effects of auxiliary energy substances on cell energy metabolism
2.3 添加辅助能量物质对细胞内活性氧和丙二醛水平的影响
对菌体细胞内的活性氧(ROS)含量及脂质过氧化标志物丙二醛(MDA)的浓度进行测定,结果如图4所示。在对照批次中,胞内ROS和MDA浓度随发酵的进行逐渐增加,但提高幅度很小,未对细胞产生大的损伤,菌体生长和产物合成在72 h的发酵周期内一直进行(图1)。然而,在添加辅助能量物质的批次中,胞内ROS和MDA浓度随发酵的进行快速增加,在26~36 h增加幅度尤为明显,而且在26 h后ROS和MDA浓度与对照相比,有极显著(P<0.01)的提高。此外,还对胞内NADPH/NADP+进行了测定,如图4C所示,添加辅助能量物质批次的NADPH/NADP+在发酵过程中变化幅度很大,26 h明显高于对照批次,36 h及以后与对照批次相比,有极显著(P<0.01)的下降,最终比例仅为0.6左右的低水平。NADPH主要为细胞物质合成提供还原力以及维持氧化还原平衡,NADPH/NADP+大幅下降可能是细胞内出现氧化胁迫导致的[25−26]。以上现象表明,发酵后期,强氧化性的活性氧自由基大量积累[27],导致氧化还原失衡,超出细胞的承受能力,细胞膜等遭到损害,细胞活性降低,最终导致发酵后期产物合成停滞的现象。

图4 辅助能量物质激发氧化胁迫造成细胞物质损伤Fig.4 Addition of auxiliary energy substances triggered oxidative stress causing cell damage
2.4 谷胱甘肽与辅助能量物质耦合添加促进cAMP发酵合成
谷胱甘肽(GSH)是一种发酵工业中常用的抗氧化剂,具有清除氧自由基的作用[28−29]。针对添加辅助能量物质导致氧化胁迫的问题,进行了谷胱甘肽与辅助能量物质耦合添加的发酵实验,结果如图5所示。耦合添加批次的菌体浓度和cAMP产量明显高于单独添加GSH批次,由于GSH的作用,发酵后期菌体和产物浓度持续增加,没有停滞和下降的趋势。柠檬酸钠耦合GSH与丙酮酸钠耦合GSH批次的cAMP产量分别达到4.05和4.32 g/L,比单独添加GSH批次分别提高了15.2%和22.7%,与图1中对照相比分别提高了21.9%和30.1%。此外,与仅添加GSH批次相比,耦合添加批次的CO2含量和细胞活性明显处于较高水平;与相应未添加GSH的批次相比,耦合添加批次的细胞活性也明显得到提高(图2)。这表明添加GSH有效解决了由辅助能量物质导致的氧化胁迫问题,菌体活性得到明显提升,产物在发酵后期能够持续合成。
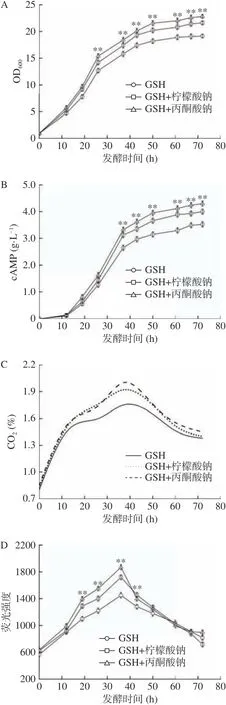
图5 谷胱甘肽提高细胞活性促进cAMP发酵合成Fig.5 Exogenous glutathione enhanced cells viability and cAMP production
3 结论
单独添加柠檬酸钠、丙酮酸钠批次的产物合成和菌体生长速率在发酵前期均明显高于对照,约30 h后快速下降,降至低于对照批次的低水平;菌体活性、ATP/AMP以及电子呼吸链活性在发酵36 h后剧烈下降,下降幅度远远大于对照批次。添加辅助能量物质导致ROS和丙二醛在发酵36 h后迅速积累,而NADPH/NADP+却快速下降,表明辅助能量物质导致活性氧大量产生,造成细胞组分损伤以及细胞生长和产物合成的停滞。耦合添加辅助能量物质和谷胱甘肽的发酵批次中,发酵后期细胞和产物浓度持续增加,细胞活性也得到较大提升,cAMP产量得到进一步提高。
