茶多酚对馒头品质的影响及机理初探
2021-10-24曾维才
陈 南,陈 龙,何 强,孙 群,曾维才,,
(1.四川大学食品工程系,四川成都 610065;2.四川大学食品科学与技术四川省高校重点实验室,四川成都 610065;3.四川大学生命科学学院,四川成都 610064)
淀粉是植物通过光合作用产生的一种碳水化合物,也是食品工业中一种重要的生产原料。根据结构的差异,淀粉可大致分为直链淀粉和支链淀粉。其中,直链淀粉主要由α-D-吡喃葡萄糖通过α-1, 4糖苷键连接形成;支链淀粉在直链淀粉结构的基础上,分子中还具有由α-1, 6糖苷键连接形成的侧链分支[1]。在淀粉制品的加工及储运中,淀粉理化特性的改变以及它与食品中其他组分的相互作用,对其品质和感官有较大影响[2]。同时,淀粉理化特性的变化可能会使其风味、质地和营养价值在加工和贮藏过程中发生褪变。相关研究表明,通过添加聚丙烯酸钠和偶氮二甲酰胺等淀粉改良剂可改善和保护馒头、面包及饼干等淀粉类食品的营养和品质[3]。但是,随着人们对化学合成类淀粉改良剂对人体潜在毒性的认识,使其在食品加工中被逐渐限制或禁止使用。因此,从食物资源中筛选出安全、高效的淀粉改良剂已成为食品相关领域的研究热点[2−3]。
茶多酚是茶叶中酚类化合物的总称,是茶叶中主要的生物活性物,主要包括表儿茶素、表没食子儿茶素、表儿茶素没食子酸酯和表没食子儿茶素没食子酸酯等4种成份[4]。研究表明,茶多酚具有抗氧化、抗辐射、抗菌、抗肿瘤等多种有益人体健康的生物活性。同时,茶多酚还对改善和提高食品的质量与感官品质有积极的作用,在食品、生物及医药行业展现出广阔的应用前景[4]。
分子动力学模拟是一种分析分子在微观反应体系中运动状态的有效技术,能系统观察各种微观分子在反应过程中的运动轨迹,适用于探讨分子水平上的相互作用机理[5−6]。近年来,通过与波谱分析技术的耦合,分子动力学模拟已被用于分析化合物之间的分子相互作用[7−8],进而揭示相关反应机理。本文研究茶多酚对馒头品质及淀粉理化特性的影响,并进一步通过分子动力学模拟,从分子水平上初步探究茶多酚与淀粉在热加工条件下的分子相互作用,为茶多酚在食品工业中的进一步开发和高值转化利用提供理论与实验基础。
1 材料与方法
1.1 材料与仪器
金龙鱼低筋粉 益海嘉里食品工业有限公司;干酵母 安琪酵母股份有限公司;茶多酚 来源于绿茶,纯度≥99%,西安通泽生物科技有限公司;实验用水为蒸馏水;所有其他试剂均为分析纯。
MM-ESC1510型面包机 美的集团股份有限公司;JYL-350型搅拌机 九阳股份有限公司;UV-1800BPC紫外可见分光光度计 上海美谱达仪器有限公司;DSC-1型差示扫描量热仪 梅特勒-托利多公司;TA.XT.Plus型质构仪 英国Stable Micro Systems有限公司。
1.2 实验方法
1.2.1 馒头的制作 将100 g低筋粉、1 g干酵母以及不同添加量(1%、2%、3%、4%和5%,w/w,基于低筋粉的质量)的茶多酚混合均匀,然后向混合后的干粉中加入50 g蒸馏水,使用面包机的和面程序与发酵程序完成面团的搅揉与发酵。随后,以50 g/个的标准对面团进行分割、滚圆及松弛。将整形后的面团置于100 °C条件下蒸制20 min[9]。将蒸制好的馒头冷却至25 °C,分别测定其比容、质构、硬化速度和α-淀粉含量。
1.2.2 比容的测定 采用油菜籽等体积置换法测定馒头的体积[10]。用烧杯量取250 mL的油菜籽,倒出油菜籽后将馒头样品放入该烧杯,接着将倒出的油菜籽缓缓放入,至总体积达到250 mL为止,剩余油菜籽的体积即为馒头的体积。通过下式计算馒头的比容:

式中:S为比容,单位mL/g;v为馒头体积,单位mL;m为馒头的质量,单位g。
1.2.3 质构的测定 将馒头切割成厚度为2 cm的均匀薄块,取中间面积最大的一块用于测定样品的硬度、黏度、胶粘性和咀嚼性等质构参数[11]。测试模式为TPA二次咀嚼模式,测试探头为P/36R柱形探头,触发力为5 g,下压速度为1 mm/s,压缩形变量为50%。每个样品选取3个测试点,每个测试点重复测定3次,测定结果取平均值。
1.2.4 硬化速度的测定 将馒头储存在4 °C条件下,分别取保存0和24 h的馒头,对其硬度进行测定[8],测试方法同1.2.3。硬化速度计算公式如下:

式中:R为硬化速度,单位g/h;H24为储存24 h后的馒头的硬度,单位g;H0为储存0 h的馒头的硬度,单位g。
1.2.5α-淀粉含量的测定 取储存24 h后的馒头,去除外表皮后用搅拌机将其打成均一的粉末。取400 mg粉末加入30 mL蒸馏水中,在25 °C条件下连续搅拌20 min,随后于4000 r/min、25 °C条件下离心10 min,收集上清液。取5 mL上清液与1 mL碘试剂(2% 碘化钾和0.2%碘单质的混合溶液,w/v)混匀,于25 °C下避光孵育15 min,测定反应混合溶液在620 nm波长下的吸光度。溶液的吸光度值越大,α-淀粉含量越高[12]。
1.2.6 小麦淀粉的制备 将75 g低筋粉与40 g蒸馏水混匀,充分揉捏使其形成面团,随后将面团置于含有100 mL蒸馏水的烧杯中,25 °C静置20 min,然后用手轻轻揉洗,而后多次用蒸馏水对面团进行冲洗,直至将淡黄色面筋组分分离。把揉洗和冲洗所得的乳浊液保留并过30目筛,将所得滤液于4000 r/min、25 °C条件下离心10 min,取下层沉淀于45 °C条件下干燥12 h,所得干物质即为小麦淀粉[13]。
1.2.7 碘结合能力的测定 将0.1 g小麦淀粉与不同添加量的茶多酚(0%、5%、10%和20%,w/w,基于淀粉质量)加入50 mL蒸馏水中,置于沸水浴中加热30 min,其间不断搅拌。随后置于冰水浴中将其迅速冷却至25 °C。取2.5 mL上述溶液与0.5 mL碘试剂(组成同1.2.5)混匀,并将混合溶液用蒸馏水稀释至50 mL,25 °C避光孵育15 min,于500~900 nm范围内测定混合溶液的吸光度,以吸光度值反映样品的碘结合能力[4]。
1.2.8 溶解度和膨胀势的测定 向2%(w/w)的小麦淀粉悬浊液中加入不同添加量的茶多酚(0%、5%、10%和20%,w/w,基于淀粉质量),将混合溶液置于沸水中加热30 min,其间不断搅拌,接着于冰水中快速冷却至室温(25 °C)。然后,将其于5000 r/min、25 °C条件下离心20 min,分别收集上清液和下层沉淀,将上清液于105 °C条件下干燥至恒重,记录所得干物质的质量;称量并记录下层沉淀质量。淀粉的溶解度和膨胀势分别按下列公式计算[14]:

式中:M0为所加淀粉总质量,单位g;M1为上清液中干物质的质量,单位g;M2为下层沉淀的质量,单位g。
1.2.9 热特性的测定 在铝坩埚中加入2 mg淀粉,随后加入4 μL的茶多酚溶液,使得茶多酚的最终浓度为0%、5%、10%和20%(w/w,基于淀粉质量)。将铝坩埚密封,并在20 °C下孵育24 h,随后置于差式量热扫描仪内,从20 °C加热至100 °C,升温速率为10 °C/min。记录淀粉糊化的起始温度、峰值温度、终值温度以及糊化焓。然后将坩埚迅速冷却至20 °C,并于4 °C条件下储存5 d,储存结束后再将坩埚置于仪器内,从80 °C加热至100 °C,升温速率为5 °C/min,记录样品的回生焓[15]。样品的回生程度(%)按下式计算:

式中:ΔHr为回生焓,单位J/g;ΔHg为糊化焓,单位J/g。
1.2.10 分子动力学模拟 在分子动力学模拟中,分别以短链葡萄糖(SGS,由12个α-D-吡喃葡萄糖通过α-1,4糖苷键连接构成的左手螺旋链糖链)、表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)和水溶剂盒子(TIP3PBOX,65×46×49 A3)作为淀粉、茶多酚和反应溶剂的模型开展后续的实验。实验前,SGS、EGCG和TIP3PBOX的化学结构分别用GLYCAM网站(https://www.glycam.org)、ChemBio3D Ultra 软件(version 12.0 for Windows,PerkinElmer Inc., Waltham, Massachusetts, USA)、Discovery Studio 软件(version 4.5 for Windows,BIOVIA Inc., San Diego, CA, USA)和AMBER软件(version 18.0 for Linux, University of California.,San Francisco, CA, USA)进行构建和优化[16]。然后,对SGS和EGCG分别加载GLYCAM-06j-1力场和GAFF小分子力场,之后载入TIP3PBOX水溶剂盒子对SGS和EGCG进行溶剂化处理[17]。接着,通过AMBER软件的能量最小化程序分别对水溶剂盒子及整个反应体系的能量进行优化,之后采用加热程度将反应体系的温度由0 K升高至370 K,升温时间为5×10−11s,再对反应体系的状态(包括分子常数、压力和温度)进行平衡,平衡时间为5×10−11s[18]。最后,在稳定的反应体系下,对EGCG和SGS在370 K下的相互作用进行共计4×10−9s(2000帧轨迹)的观察,记录和分析实验过程中SGS空间结构的变化、结合位点的数量和变化、结合力的类型和强度等。同时,采用SHAKE规则限制氢原子的作用,并将步长设置为2×10−15s。所有轨迹的可视化图形均通过Visual Molecular Dynamics软 件(version 1.9.3 for Windows, Beckman Institute., Urbana, IL, USA)获取,轨迹中数据的处理由AMBER软件中的CPPTRAJ程序完成[19]。
1.3 数据统计与分析
每组实验重复3次,结果以“平均值±标准差”的形式表示。实验结果用SPSS 22.0(version 22.0 for Windows, SPSS Inc., Chicago, IL, USA)进行统计分析,显著性差异P<0.05。
2 结果与分析
2.1 茶多酚对馒头品质的影响
2.1.1 茶多酚对馒头比容的影响 由图1可知,茶多酚的添加对馒头的比容没有显著的负面影响,比容值呈现一定的波动变化(数值维持在2.2 mL/g上下)。结合相关研究分析,该波动变化可能与茶多酚与面粉中的淀粉和面筋蛋白两者间不同程度的相互作用有关。相关研究指出,馒头的蒸制过程中,面筋蛋白网络结构的形成和淀粉的糊化这两个过程的发生与发展是影响馒头比容的主要因素。一方面,茶多酚与面筋蛋白的相互作用对面筋蛋白网络结构的形成有抑制作用,会降低面制品的比容[20]。另一方面,茶多酚又能与淀粉发生相互作用,提高淀粉颗粒的吸水膨胀能力,进而促进淀粉的糊化,有利于提升面制品的比容[21]。因此,图1所示馒头比容的波动可能是不同浓度茶多酚与淀粉和面筋蛋白两者间相互作用强度的差异所致。

图1 茶多酚对馒头比容的影响Fig.1 Effect of TP on the specific volume of steamed bun
2.1.2 茶多酚对馒头质构的影响 由表1可知,茶多酚的添加降低了馒头的硬度(1212.42±9.24~889.46±13.81 g)、胶粘性(1130.77±13.48~799.00±6.29)及咀嚼性(877.66±5.24~644.33±7.12),增大了馒头的黏度(5.07±0.98~35.15±0.23),且茶多酚的添加对馒头质构的影响呈现明显的剂量效应。有研究表明,茶多酚能够与淀粉糊化所形成的三维网状含水胶体发生氢键作用,对淀粉食品的质地和口感产生影响[22−23]。此外,在馒头等淀粉类食品的加热过程中,其中大量的淀粉颗粒吸水膨胀,晶体结构被破坏,其中的淀粉分子与水分子结合并彼此交联形成胶状物,这一过程对馒头的质构具有显著影响[10],而酚类物质会改变淀粉的溶胀能力,影响淀粉的糊化过程,并通过分子间作用力影响淀粉分子的缠绕、排列及结合,使得其含水胶体的硬度、黏度、胶粘性和咀嚼性发生变化。实验结果表明,茶多酚的添加能够赋予馒头更加柔软和粘牙的口感,改善馒头的质构特性。

表1 茶多酚对馒头质构的影响Table 1 Effect of TP on the texture properties of steamed bun
2.1.3 茶多酚对馒头硬化速度和α-淀粉含量的影响淀粉食品在储存过程中,由于直链淀粉的重新取向排列以及支链淀粉的重结晶,淀粉易发生老化现象,使得食品的硬度显著增加,降低了食品的口感和可食用价值。此外,短期储运过程中,直链淀粉的重新取向排列表现为可溶性α-淀粉含量的降低。因此,抑制α-淀粉的减少可在一定程度上延缓淀粉的老化,抑制淀粉食品的硬化[24]。
茶多酚对馒头硬化速度及α-淀粉含量的影响如图2所示。由图2a可见,茶多酚的添加显著降低了馒头的硬化速度,当茶多酚的浓度达到5%时,其硬化速度由194.55 g/h下降至137.14 g/h。由图2b可见,茶多酚的添加显著提高了馒头中可溶性α-淀粉的含量。实验结果表明,在短期储存过程中,茶多酚可以提高样品中可溶性α-淀粉的含量,从而阻碍淀粉的老化,延缓淀粉类食品的回生,以延长食品的储存时间。
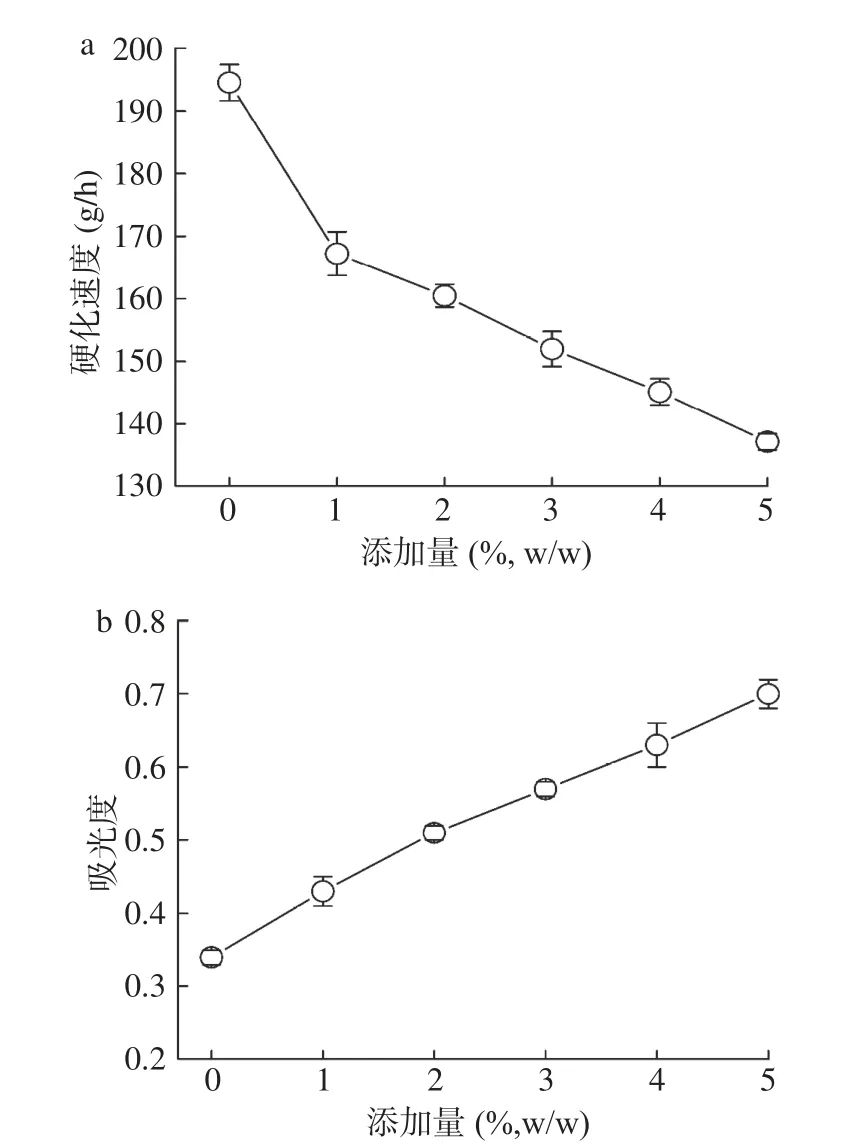
图2 茶多酚对馒头的(a)硬化速度及(b)α-淀粉含量的影响Fig.2 Effect of TP on(a)hardening rate and(b)α-starch content of steamed bread
2.2 茶多酚对小麦淀粉理化特性的影响
2.2.1 茶多酚对小麦淀粉碘结合能力的影响 由图3可知,茶多酚的加入导致了减色效应,降低了淀粉-碘复合物在500~900 nm波长范围内的吸光度,当茶多酚浓度达到20%时,复合物在500~900 nm波长范围内的吸光度值趋近于0。有研究表明,多酚可以通过氢键与淀粉链连接,占据淀粉羟基基团的结合位点,并通过疏水相互作用占据淀粉螺旋的空腔,从而阻止碘-淀粉复合物的形成[25−26]。实验结果表明,茶多酚能竞争性抢夺碘分子与淀粉结合的位点,并形成更为稳定的茶多酚-淀粉复合物,而复合物的形成会占据淀粉分子间的结合位点,影响淀粉分子间的缠绕组合,使得其形成的水胶体的微观结构发生变化,从而影响其加工制品(如:馒头硬度及硬化速度的降低)的品质。

图3 茶多酚对淀粉碘结合能力的影响Fig.3 Effect of TP on the iodine binding power of starch
2.2.2 茶多酚对小麦淀粉溶解度和膨胀势的影响淀粉的溶解度和膨胀势反映了淀粉结构的致密程度和结晶胶束区的强度[27]。由图4可知,随着茶多酚浓度的增大(0%~20%),淀粉溶解度从8.38%提高到38.0%,而膨胀势也由11.43%升至13.83%,且呈现剂量-效应关系。有文献报道,多酚的酚羟基可与淀粉分子的羟基形成大量的分子间氢键,竞争性地抑制淀粉分子内氢键的形成[22]。同时,相关研究表明,酚类化合物可以削弱淀粉的结晶胶束结构的结合强度,使得水分更易进入淀粉颗粒,从而提高淀粉的吸水溶解能力与溶胀能力[28]。研究结果表明,茶多酚可以提高淀粉的吸水膨润能力,影响其三维网状含水胶体的形成,从而改变淀粉加工制品的品质。

图4 茶多酚对淀粉(a)溶解度和(b)膨胀势的影响Fig.4 Effect of TP on the (a) solubility and (b) swelling power of starch
2.2.3 茶多酚对小麦淀粉特性的影响 糊化是指淀粉颗粒在高温下破裂、吸水及膨胀,形成均一的溶液的过程;老化(回生)是指淀粉分子在糊化后重新排序形成有序的结晶结构的过程[1]。这两个热力学过程是淀粉重要的理化性质,对淀粉食品的质量和感官品质具有明显的影响。
由表2可知,随着茶多酚浓度的增大,淀粉糊化的起始温度、峰值温度、终值温度及糊化焓值都降低,且呈现剂量-效应关系。据报道,淀粉的糊化可能是由支链淀粉双螺旋的破裂和结晶层的熔化导致,这一过程需要高温和足够的热能去破坏淀粉分子之间强烈的相互作用[29]。因此,糊化温度和糊化焓的降低表明淀粉的糊化更易发生。茶多酚中存在大量的活性酚羟基,有研究表明,酚类化合物的酚羟基可通过氢键与淀粉链结合,削弱淀粉分子之间强烈的相互作用,有利于淀粉内部晶体结构的破坏,使得淀粉的糊化在相对较少的热能下便可进行[30]。此外,茶多酚还对淀粉的老化特性有较为明显的影响。从表2所示数据可知,茶多酚的添加降低了淀粉的回生焓和回生率,当茶多酚浓度达到20%时,在5 d的储存周期内并未出现淀粉的老化现象。有研究表明,多酚与淀粉之间的氢键相互作用能竞争性地抑制淀粉中直链淀粉分子的重排和缠绕,延缓淀粉中双螺旋结构的形成[31]。研究结果表明,茶多酚的添加可以促进淀粉的糊化,影响淀粉凝胶的形成,从而改变其加工制品的质构。此外,茶多酚能够显著抑制淀粉的老化,从而延缓淀粉类食品的硬化,延长其货架期。

表2 茶多酚对淀粉糊化特性和老化特性的影响Table 2 Effect of TP on the gelatinization and retrogradation of starch
2.3 茶多酚与淀粉的分子相互作用
2.3.1 模型的构建及优化 分子模型的合理构建及结构优化对于后续实验结果的准确性有显著的影响。在参考相关文献的基础上[17],实验构建并优化了茶多酚与淀粉在热加工过程中的各个反应组分的分子模型,结果如图5所示。其中,SGS的结构模型(图5a)是由12个D-葡萄糖分子以α-1,4糖苷键连接而成,每6个D-葡萄糖分子形成一个左手螺旋;EGCG(图5b)是茶多酚中含量最高的组份,同时也因其结构中6个邻位酚羟基的存在而使得它的活性优于其它茶多酚组分;TIP3PBOX水溶剂盒子(图5c)是一个适用于观察小分子与多糖之间相互作用的反应溶剂模型[32]。同时,有研究表明,分子模型的结构张力所造成的高能量,可能会导致整个模拟系统的崩解[33]。因此,实验在模拟升温及正式反应前采用能量最小化程序来释放这种结构张力,以优化构建的EGCG与SGS的相互作用反应体系。

图5 分子模型Fig.5 Molecular model
2.3.2 相互作用轨迹的可视化与模拟体系的评价淀粉的糊化是高温加热过程。因此,使用加热程序将温度由0 K升温至370 K,整个过程中SGS与EGCG的结合轨迹如图6所示。由图6可知,EGCG和SGS先处于分离状态,之后EGCG与SGS的链尾通过形成氢键而发生短暂的结合,随后由于氢键的断裂与新氢键的不断形成,EGCG被牵引至SGS的链首处并与它稳定结合。同时,当EGCG与SGS之间的分子相互作用处于相对稳定的状态时,二者之间的结合形式会出现动态变化,具体表现为:EGCG局部与SGS结合或EGCG包埋进SGS螺旋空腔内。这两种结合形式的动态变化可能是由两个分子之间所形成的氢键数量和位置在不断变化所导致。
为了评价模拟体系的合理性和稳定性,实验进一步考察了EGCG与SGS分子相互作用的质心距离和RMSD值(均方根偏差),结果如图7所示。由图7A可知,在2000帧的轨迹中,EGCG与SGS之间的质心距离先下降,后增加,最后呈现整体下降的趋势,该结果与图6所示结合轨迹一致。质心距离常用于表征模拟反应中分子间的结合状态,质心距离的减小表明分子间逐渐靠近,相互作用顺利进行。此外,如图7B所示,RMSD值先增加,最后保持在11~13 ai的范围内,RMSD值的平稳表明EGCG和SGS分子间的相互作用达到平衡状态[34]。

图6 SGS和EGCG的相互作用轨迹Fig.6 Interaction trajectory between EGCG and SGS

图7 模拟体系的评价Fig.7 Evaluation of simulation system
2.3.3 EGCG对SGS空 间 构 象 的 影 响 EGCG对SGS空间构型的影响如图8所示。由图8可知,在未添加EGCG的反应组中(图8a),随着作用时间的延长,SGS的空间构象由起始的左手螺旋结构变成了一个随意盘绕的不闭合圆环(3.0 ns),最后形成一条结构更松散的螺旋链,从而导致SGS分子的伸展(4.0 ns);添加EGCG的反应组中(图8b,未显示EGCG分子),SGS受到EGCG的影响,空间结构呈现出与图8A不同的动态变化,最终形成一个开放的环。有研究表明,葡萄糖链的空间构型主要依赖于两种分子内氢键,包括匝间氢键(O6-O2和O6-O3)和相邻葡萄糖单元之间的匝内氢键(O2-O3)[35]。然而,EGCG分子具有许多结合位点与SGS形成分子间氢键,并且可以竞争性地抑制SGS分子内氢键的形成,从而导致其空间构型发生变化。

图8 EGCG对SGS空间构型的影响Fig.8 Effect of EGCG on the spatial configuration of SGS
2.3.4 EGCG与SGS的分子间作用力 相互作用过程中EGCG与SGS的分子间作用的变化情况如表3~表5所示。由表3可知,未添加EGCG的反应组内,SGS的分子内氢键占比最高的氢键是由氢原子(4GA_9@H3O)和氧原子(4GA_10@O2)形成,占比为19.8%,在2000帧轨迹中出现了396帧,这表明该类氢键可能在保持SGS的空间构型方面起着重要的作用。同时,该体系中共有三种类型的氢键占比超过10%。由表4可知,添加了EGCG的反应组内,SGS的分子内氢键占比最高的氢键是由氢原子(4GA_12@H3O)和氧原子(4GA_13@O2)形成,占比为18.7%,在2000帧轨迹中出现了374帧。同时,该体系中共观察到5类占比大于10%的氢键。与表3的结果相比,SGS的分子内氢键中对于维持SGS空间构型较为重要的氢键(氢原子:4GA_9@H3O,氧原子:4GA_10@O2)的占比由19.8%下降至10.9%,表现出明显的差异。实验结果表明,EGCG对SGS分子内氢键的形成具有显著的影响。此外,实验进一步观察了EGCG和SGS之间分子间氢键的分布情况,结果如表5所示。EGCG的酚羟基可以与SGS形成分子间氢键,其中,占比最高(5.6%,2000帧中出现112帧)的分子间氢键是由氢原子(EGCG_1@H18)和氧原子(4GA_12@O2)形成。实验结果表明,EGCG可以通过占据SGS的氢键结合位点,从而影响SGS的分子内和分子间氢键的形成,进而改变SGS的空间构型。同时,淀粉分子(SGS)空间构型与淀粉的理化特性及加工特性密切相关,茶多酚主成分EGCG通过氢键与SGS结合,改变了淀粉分子的空间构型,影响淀粉分子(SGS)间的缠绕、排列,从而改变淀粉类制品(如:馒头)的品质。

表3 未添加EGCG的SGS分子内氢键分布情况Table 3 Intramolecular hydrogen bonds within SGS without EGCG

表4 添加EGCG组的SGS分子内氢键分布情况Table 4 Intramolecular hydrogen bonds within SGS with EGCG

表5 SGS和EGCG之间的分子间氢键Table 5 Intermolecular hydrogen bonds between SGS and EGCG
3 结论
茶多酚对馒头的品质及淀粉的理化特性有显著影响。茶多酚的添加对馒头的比容未产生负面影响(数值维持在2.2 mL/g),并改变了馒头的质构,降低了馒头的硬度(1212.42±9.24~889.46±13.81 g),使其口感更加柔软。同时,茶多酚的添加阻碍了淀粉与碘分子的结合,提高了淀粉的溶解度(8.3%~38.1%)和膨胀势(11.4%~13.8%)。此外,茶多酚降低了淀粉的糊化焓值(17.70±0.10~1.99±0.27 J/g)及回生率,促进了淀粉的糊化,并延缓了淀粉的老化。此外,茶多酚主要通过氢键作用力在加热过程中与淀粉分子发生相互作用,并在相互作用过程中通过改变淀粉分子的分子内氢键和分子间氢键的形成,从而改变淀粉分子的空间构型,进而影响淀粉的特性和淀粉食品的品质。研究工作从分子相互作用层面初步揭示了茶多酚对馒头品质及淀粉理化特性影响的机理,为茶多酚在食品工业中用于提高淀粉食品的品质与质量提供了实验基础。
