基于体外药效学结合网络药理学和分子对接对人参-桑椹改善骨质疏松的机制研究
2021-10-24李春楠吴孟雅边学峰
刘 玲,李春楠,兰 梦,吴孟雅,张 辉, ,边学峰,
(1.长春中医药大学,吉林省人参科学研究院,吉林长春 130117;2.吉林省东北亚生物科技有限公司,吉林长春 130117)
骨质疏松症(osteoporosis,OP)以骨代谢紊乱、微结构损坏为主要特征,并且由于骨量流失及强度降低,日后容易并发主要部位的脆性骨折[1]。OP的发病率随着人口老龄化的加重而逐年上升。现已经成为世界上第七大最常见的疾病[2]。研究显示,中药及其复方具有整体调节作用,调节激素水平,提高机体免疫力,促进骨密度增加,改善和修复受损的小梁骨微结构,治疗OP患者的疾病[3−4]。中药及其复方在预防和治疗OP方面具有较高的安全性和独特的优势,但其具体作用机制尚不清楚。随着网络药理学的发展和应用,从靶向生物信号网络的角度进行深入分析,对中医药防治OP具有重要意义。
人参为五加科植物(Panax ginsengC. A. Mey)。2020版药典记载,其具有大补元气,强精补肾之功效。桑椹为桑科植物桑(Morus albaL.)的干燥果穗,2015版药典记载归心、肝、肾精,具有治疗肝肾阴虚,关节不利之功效。肾虚是骨质疏松症的主要病因,而肾精的升降决定了骨的强弱,因此补肾中药被广泛应用于骨质疏松症的防治[5]。中医认为,肾藏精,精生髓,髓养骨。从生理上讲,肾脏储蓄先天的精华,可以转化为骨髓。骨髓储存在骨头里,骨髓充实则骨骼生长强硬;病理上,肾精亏虚,骨髓不足,骨质流失,导致各种骨病。近年来,大量研究表明人参、桑椹都具有改善骨质疏松的作用,但目前研究主要集中于单味药的药性,二者联合用药后改善骨质疏松的研究未见报道,且人参、桑椹药食同源,对于食品开发的研究具有广阔前景,相比于西药治疗毒副作用小。
网络药理学自2008年发出以来[6],其成为一门新兴学科,在调控水平上揭示了中药在人体调节网络中的作用。由于其整体性,系统性的研究方法以及药物与中药的多靶点,多病理特征共同作用的特点,已成为系统分析多靶点,多路径机制的有效工具[7]。多项研究利用网络药理学探索中药作用机制已经取得成功[8−9]。
本实验主要通过人参水提液(GW)、桑椹水提液(MW)、人参醇提液(GC)、桑椹醇提液(MC)、人参和桑椹水提物配伍(GMW)、人参和桑椹醇提物配伍(GMC)六个试验组及以H2O2溶液组为睾丸间质细胞实验对照组,地塞米松为成骨细胞分化实验对照组,采用细胞实验并结合网络药理学方法,探究人参、桑椹单味药与药对水提物及醇提物治疗骨质疏松作用的效果及其分子机制,为其后续开发应用提供参考。
1 材料与方法
1.1 材料与仪器
小鼠睾丸间质细胞TM3、小鼠成骨细胞MC3T3-E1 中国医学科学院基础医学研究所细胞资源中心;人参、桑椹 共二味药材,吉林敖东世航药业,经长春中医药大学张辉教授鉴定,均为《中国药典》2020年版收载品种;胎牛血清 美国Gibco公司;胰蛋白酶、噻唑蓝(MTT) 美国Amresco公司;MEM细胞培养液、双抗(100 μg/mL的链霉素和100 U/mL的青霉素) 美国Hyclone公司;二甲基亚砜 天津市光复精细化工研究所;小鼠睾酮(T)酶联免疫吸附检测试剂盒 美国Rad公司;地塞米松索莱宝;BCA法蛋白定量试剂盒 中国碧云天;碱性磷酸酶(ALP)试剂盒 中国南京建成。
BSA124S-CW电子天平 德国Sartorius;KS-5200DB型清洗器 昆山洁力美超声仪器有限公司;Microfuge.22RCentrifuge型高速低温离心机 美国Beckman Coulter公司;BIO Memory −86 ℃超低温冰箱 法国Froilabo公司;YZ-875超净工作台 苏州净化设备厂;多规格培养皿 美国Corning公司;HERAEUS HERA cell 150二氧化碳培养箱 日本三洋公司;Milli-Q超纯水仪 美国Bedford公司;Mode1680型酶标仪 日本Takara公司。
1.2 实验方法
1.2.1 样品制备 人参、桑椹单味药及药对1:1比例加入10倍量水,浸泡0.5 h,提取2次,每次提取1 h,合并2次滤液,得到人参水提液(GW)、桑椹水提液(MW)、人参和桑椹水提物配伍(GMW)药液。再将人参、桑椹单味药及药对1:1比例加入8倍量乙醇,浸泡0.5 h,提取2次,每次提取2 h,合并2次滤液,得到人参醇提液(GC)、桑椹醇提液(MC)、人参和桑椹醇提物配伍(GMC)药液。将六种样品分别减压浓缩再进行烘干制成干膏,置4 ℃冰箱保存待用。
1.2.2 细胞培养 冻存的MC3T3-E1细胞和TM3细胞复苏后,在37 ℃恒温条件下,5% CO2培养箱中培养含10%胎牛血清和MEM培养基的细胞。当细胞贴壁后,取出培养基,用PBS洗涤三次,直至无漂浮细胞。再次加入培养基继续培养。当细胞被80%~90%覆盖时,用0.25%胰蛋白酶传代,每2~3 d传代一次。取对数生长期细胞用于实验。
1.2.3 单味药及药对不同组分对TM3细胞增殖率和睾酮分泌的影响 实验分为给药组GW、MW、GC、MC、GMW、GMC,模型组(MS)和空白组(Control)。将给药组成分溶于少量二甲基亚砜中,用培养基稀释成12.5、25、50、100、200 μg/mL,对照组加入相同体积的培养基。将TM3细胞接种于96孔板中,每孔加入200 μL细胞悬液(4×103细胞/孔),每组5复孔。培养24 h后,弃去培养基,分别加入12.5、25、50、100、200 μg/mL浓度样品,对照组加入3.125 μmol/L的H2O2溶液。培养24 h后,收集细胞上清进行睾酮检测。每孔加入MTT(5 mg/mL),37 ℃暗孵4 h,于490 nm处检测,根据吸光度计算各组细胞增殖率和睾酮分泌量。
1.2.4 MC3T3-E1细胞增殖试验 MC3T3-E1细胞接种于96孔板中,24 h后加入不同浓度的样品,使各组的终浓度分别为12.5、25、50、100、200 μg/mL。每组5个复孔。将其置于37 ℃的5% CO2培养箱中连续培养。24 h后,每孔加入MTT(5 mg/mL)试剂,37 ℃暗孵4 h。根据测定的吸光度,计算各组细胞增殖率。
1.2.5 MC3T3-E1细胞分化试验 用ELISA法检测细胞ALP活力。以加入地塞米松(100 μmol/L)作为模型组(MS),以12.5、25、50、100、200 μg/mL浓度的GMW和GMC作为给药组,MC3T3-E1细胞为空白组。将细胞转移到12孔板并培养24 h后加入不同浓度的样品,使各组的终浓度分别为12.5、25、50、100、200 μg/mL。24 h后,进行检测。具体方法按照BCA法蛋白定量试剂盒说明及ALP试剂盒说明操作进行测定。
1.3 网络药理学分析
1.3.1 人参-桑椹成分筛选、靶点预测及网络构建在TCMSP[10](http://tcmspw.com/tcmsp.php)数据库以“人参”、“桑椹”、“RenShen”、“SangShen”为关键词,收集人参-桑椹中化学成分,并以口服生物利用度(Oral bioavailability,OB)及类药性(Drug-likeness,DL)的筛选条件(OB≥30%,DL≥0.18)[11]进行筛选作为吸收、分布、代谢、排泄参数筛选出符合条件的化学成分作为活性成分并得到相关靶点,借助疾病靶点标准化数据库(Universal protein,UniProt)(https://www.uniprot.org/)查询相关靶点对应的基因名,并利用Cytoscape3.7.0软件构建成分-靶点网络图,并对网络拓扑参数进行了分析,确定关键节点,分析人参-桑椹改善骨质疏松症的物质基础。
1.3.2 骨质疏松症靶点收集 应用GeneCards数据库(https://www.genecards.org/)OMIM数据库(https://www.omim.org/)输入关键词“Osteoporosis”收集骨质疏松症相关靶点,并通过Uniprot(http://www.uniprot.org/)数据库将靶点转换为Uniprot Entry格式。应用Venny 2.1在线软件作图工具平台(http://www.Venn.org/)将活性成分作用靶点与骨质疏松症相关靶点取交集,得到人参-桑椹药对治疗骨质疏松症关键靶点。
1.3.3 关键靶点蛋白相互作用(protein-protein interaction,PPI)网络构建 将关键靶点导入蛋白质相互作用分析数据库STRING(https://string-db.org/),选择“Homo sapiens”,设定置信度≥0.400,分析关键靶点的相互作用,并将收集的数据导入Cytoscape3.7.0软件构建PPI网络。
1.3.4 GO功能富集和KEGG通路富集 为探索关键靶点的生物功能和作用通路,将关键靶点输入到DAVID数据库[12](https://david.ncifcrf.gov/),进行GO(Gene Ontology,基因本体)和KEGG(Kyoto Encyclopedia of Genes and Genomes,京都基因与基因组百科全书)分析,并以P<0.05为条件进行筛选,选取基因数目排名前20的通路,利用imageGP(http://www.ehbio.com /ImageGP/)工具绘制气泡图。利用Cytoscape3.7.0软件构建“成分-靶点-通路”网络图。
1.3.5 分子对接验证 通过检索TCMSP数据库获得活性成分MOL2格式化学结构,再利用 Pubchem数据库(https://www.pubchem.org/)转换为PDB格式。检索RCSB PDB数据库(http://www.rcsb.org/)获得蛋白晶体结构,运用Autodock[13]软件进行去水、加氢等操作后保存为PDB格式,应用Pymol软件对“活性成分-作用靶点”网络中的度值大于平均值的化学成分和PPI网络中的重要蛋白进行分子对接。
1.4 数据处理
实验数据使用SPSS23.0统计软件进行统计分析。所有数据用±s表示,多组间比较采用单因素方差分析。使用GraphPad Prism 8.0绘制统计结果图。
2 结果与分析
2.1 人参、桑椹单味药及药对对小鼠睾丸间质细胞及成骨细胞的作用
2.1.1 单味药及药对对小鼠睾丸间质细胞TM3增殖率的影响 见表1,与空白组比较,模型组睾丸间质细胞增殖率极显著降低(P<0.01),表明小鼠肾衰模型建立成功。与模型组比较,当浓度为100、200 μg/mL时GW、MW、GMW、GC、MC、GMC组增殖率显著升高(P<0.01),并且呈浓度依赖性。GMW、GMC的增殖率明显高于GW、MW、GC、MC的增殖率(P<0.05,P<0.01)。
表1 单味药及药对不同组分对小鼠睾丸间质细胞的增殖作用(±s,n=3)Table 1 Proliferation effects of single drug and drug pair on mouse testicular TM3 cells (±s, n=3)

表1 单味药及药对不同组分对小鼠睾丸间质细胞的增殖作用(±s,n=3)Table 1 Proliferation effects of single drug and drug pair on mouse testicular TM3 cells (±s, n=3)
注:与空白组比,#P<0.05,##P<0.01;与模型组比,*P<0.05,**P<0.01。
?
2.1.2 GMW、GMC对小鼠睾丸间质细胞TM3睾酮分泌量的影响 通过TM3细胞增殖率的实验可知,药对增值率大于单味药增值率,所以对药对睾酮分泌进行分析。见图1,与空白组比较,模型组睾酮分泌显著降低(P<0.01),表明小鼠肾衰模型建立成功。与模型组比较,GMW、GMC组在25~200 μg/mL睾酮分泌显著升高(P<0.01),并且呈浓度依赖性。
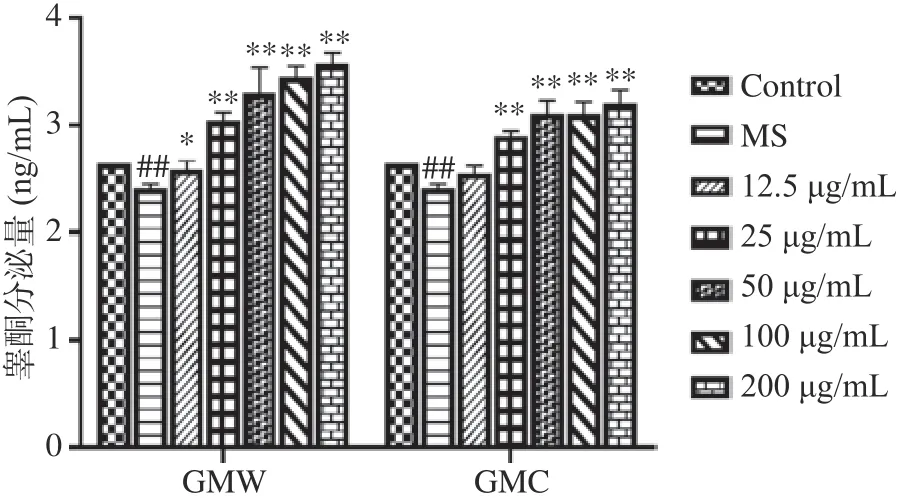
图1 药对水提GMW和药对醇提GMC对TM3细胞睾酮分泌量的影响(±s,n=3)Fig.1 Effects of water extraction of GMW and alcohol extraction of GMC on testosterone secretion of TM3 cells
2.1.3 GMW、GMC对小鼠成骨细胞MC3T3-E1增殖率的影响 见图2,与空白组比较,GMW、GMC组的细胞增殖率显著升高(P<0.05,P<0.01)。在GMW组中200 μg/mL浓度的细胞增殖率极显著高于其他浓度组(P<0.01)。GMC组中100 μg/mL浓度的细胞,增殖率极显著高于其他浓度组(P<0.01)。

图2 药对水提GMW和药对醇提GMC对MC3T3-E1细胞增殖率的影响(±s,n=3)Fig.2 Effects of water extraction of GMW and alcohol extraction of GMC on proliferation rate of MC3T3-E1 cells
2.1.4 GMW、GMC 对小鼠成骨细胞 MC3T3-E1 ALP活力的影响 见图3,与空白组比较,模型组ALP活力极显著降低(P<0.01)。与模型组比较,GMW中25 μg/mL浓度时ALP活力极显著高于其他浓度的ALP活力(P<0.01)。GMC中200 μg/mL浓度时ALP活力极显著高于其他浓度ALP活力(P<0.01)。

图3 药对水提GMW和药对醇提GMC对MC3T3-E1细胞 ALP 活力的影响(±s,n=3)Fig.3 Effects of water extraction of GMW and alcohol extraction of GMC on ALP activity of MC3T3-E1 cells
2.2 网络药理学分析
2.2.1 人参-桑椹活性成分筛选及“成分-靶点”网络构建 通过检索TCMSP数据库,在TCMSP数据库检索到人参化学成分190种,桑椹中化学成分91种;通过设置OB≥30%,DL≥0.18,人参中筛选出活性成分22种,桑椹中活性成分6种,其中两者共有活性成分28种,见表2。并获得活性成分相关作用靶点99个。将28种活性成分与2.2.2中所得到的交集69个关键靶点通过Cytoscape 3.7.0软件构建“活性成分-靶点”网络,见图4。图4中共有节点(Node)97个,边(Edge)137条,绿色四边形节点为人参-桑椹两者共有成分,蓝色三角形节点为靶标蛋白。通过分析网络性质,活性成分M04、M14、M16、M27、M28的度值(Degree)高于平均值,M04、M14、M16是人参的活性成分,M27、M28是桑椹的活性成分,说明这些成分可能是人参-桑椹治疗骨质疏松症关键成分。

图4 人参-桑椹药对活性成分-靶点网络图Fig.4 Compound-target network of herbal pair ginseng and mulberry

表2 人参-桑椹中活性化合物的基本信息Table 2 Basic information of active compounds in ginseng-mulberry
2.2.2 药物靶点基因筛选及关键基因获取 通过检索GeneCards数据库、OMIM数据库删除重复项后得获骨质疏松症相关靶点4204个,与活性成分相关靶点取交集后共获得69个关键靶点,见图5。蓝色圆形为活性成分靶点,红色圆形为骨质疏松症靶点,两者交集为关键靶点。

图5 活性成分靶点和骨质疏松症靶点Venn图Fig.5 Venn diagram of bioactive compound targets and Osteoporosis related targets
2.2.3 PPI网路构建与分析 将69个关键靶点,导入STRING数据库,基因类型改为“Homo sapiens”,并将置信度设置为medium confidence 0.400,获得PPI网络图TSV格式文件,将其导入Cytoscape 3.7.0软件进行可视化处理,其中有4个蛋白没有互作关系,见图6。图6中共涉及65个节点(Node),638条边(Edge)。PPI网路图中,节点颜色从淡黄色渐变至深蓝色表示Closeness Centrality从小到大变化。共有30个蛋白度值高于平均值(19.6),见表3,其中度值前五的蛋白为IL6、ALB、MAPK8、VEGFA、CASP3说明这5种蛋白在网络中与其他蛋白相互作用较多,在网络中发挥了重要作用。

表3 30个关键靶蛋白Table 3 30 key target proteins

图6 65个关键靶点PPI网络图Fig.6 PPI network of 65 key targets
2.2.4 GO功能富集和KEGG靶点通路富集分析经过DAVID数据库分析,以P<0.05为条件共收集到257个生物过程(biological process),34个分子功能(cell compound),62个细胞组分(molecular function)和109条KEGG通路,将GO功能富集排名前30的生物过程、分子功能、细胞组分及前20的KEGG通路绘图从数据库导出。见图7。所包含基因数最多的前20的通路详细信息结果,见表4。将DAVID分析结果导入Cytoscape 3.7.0构建“活性成分-靶点-通路”网络图,见图8。图8中蓝色(左图)菱形节点为两者共有成分,绿色(中图)四边形节点为关键靶标蛋白,紫色(右图)长方形为通路。共有117个节点,406个边,平均Degree值为6.719(该值是表示与该节点相连的边的条数,节点度越高,其参与的生物过程越多),≥6.719的有44个,其介数(Betweenness Centrality)、接近中心性(Closeness Centrality)、平均最短路径长度(Average Shortest Path Length)表明了其重要性,网络拓扑参数,见表5。由此可知,相同成分可对应一个或多个靶点,而不同成分又可作用于同一靶点,具有协同作用。

表5 网络拓扑参数(Degree≥6.719)Table 5 Network topology parameters (Degree≥6.719)

图8 活性成分-靶点-通路网路图Fig.8 Active ingredient target pathway network diagram

表4 基因数目前20的KEGG通路基本信息Table 4 Basic information of the top 20 pathways with the most genes

图7 GO功能富集和KEGG通路富集Fig.7 GO analysis and KEGG pathways
GO功能富集表明,人参-桑椹药对可正调控RNA聚合II启动子转录(positive regulation of transcription from RNA polymerase II promoter)、凋亡过程负调控(negative regulation of apoptotic process)、肿瘤坏死因子细胞反应(cellular response to tumor necrosis factor)、血管生成的正向调节(positive regulation of angiogenesis)、神经元凋亡过程(neuron apoptotic process)、上皮细胞增殖的阳性调节(positive regulation of epithelial cell proliferation)等生物过程。KEGG通路分析表明人参-桑椹药对可能通过PI3K-Akt信号通路(PI3K-Akt signaling pathway)、乙型肝炎通路(Hepatitis B)、前列腺癌通路(Prostate cancer)、MAPK 信号通路(MAPK signaling pathway)、糖尿病并发症中的AGE-RAGE信号通路(AGERAGE signaling pathway)等信号通路发挥治疗骨质疏松症的作用。“成分-靶标-通路”网络图分析结果显示,槲皮素(quercetin)、山奈酚(kaempferol)、β-胡萝卜素(beta-carotene)、β-谷甾醇(beta-sitosterol)四种化合物在网络图中度值高于平均度值,提示这些化合物可能在人参-桑椹药理作用的发挥中扮演重要角色。

2.2.5 分子对接验证 利用Autodock软件,选取“活性成分-靶点-通路”网络图中度值高于平均值的四个化合物(kaempferol、quercetin、beta-carotene、beta-sitosterol),与PPI网络中度值排名前四的靶点(CASP3、ALB、IL6、MAPK8)对接,除beta-carotene与靶点对接后binding energy大于0 kcal/mol外,其余结果均小于0 kcal/mol,说明活性成分和靶蛋白能形成较为稳定的结合,见表6。利用Pymol软件对活性化合物结果进行可视化处理结果,见图9。由图可知,A、B、C分别为kaempferol、quercetin、betasitosterol与CASP3蛋白对接模式图,D、E、F分别为kaempferol、quercetin、beta-sitosterol与ALB蛋白对接模式图,G、H、I分别为kaempferol、quercetin、beta-sitosterol与IL6蛋白对接模式图,J、K、L分别kaempferol、quercetin、beta-sitosterol与MAPK8蛋白对接模式图。

图9 活性成分与CASP3、ALB、IL6、MAPK8的分子对接模式Fig.9 Molecular docking pattern of bioactive compounds with CASP3、ALB、IL6、MAPK8 main protease
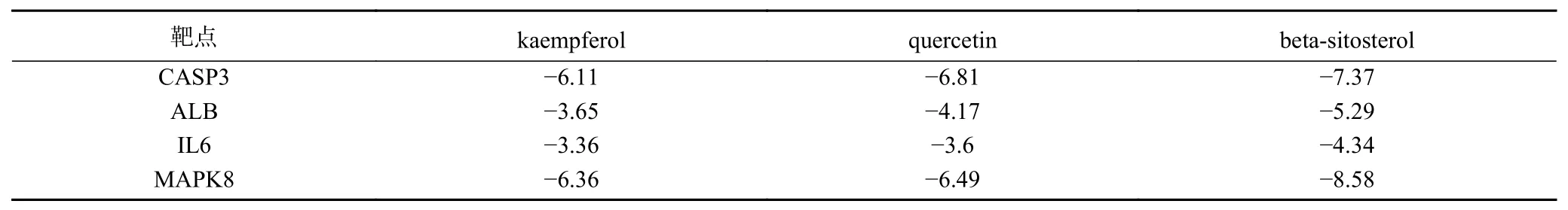
表6 活性成分与关键靶点对接结果(kcal/mol)Table 6 Docking results of active ingredients and key targets (kcal/mol)
3 讨论
人参和桑椹为补气补阴补肝肾的中药。骨质疏松症现已在全球成为非常常见的疾病,并且对于抗骨质疏松症的药物研发迫在眉睫。中医理论中“肾主骨生髓”证实人参-桑椹有改善骨质疏松的作用。然而其作用机制并不明确,同时缺乏分子水平实验研究。本研究以小鼠睾丸间质细胞TM3为模型,考察了人参、桑椹单味药和联合药对对睾丸间质细胞增殖及睾酮分泌的影响。结果显示,联合药对对细胞增殖及睾酮分泌量具有显著增加作用,说明药对比单味药具有明显补肾的作用。以小鼠成骨细胞MC3T3-E1为模型,考察不同组分药对对细胞增殖及ALP活力的影响,结果显示水提取的药对组分具有明显细胞增殖的作用,而醇提取的药对则对ALP活力具有明显增强的作用。
本文基于网络药理学和分子对接技术研究了人参-桑椹改善骨质疏松症的活性成分、潜在作用靶点和作用通路。发现人参-桑椹药对可能通过 kaempferol、quercetin、beta-carotene、beta-sitosterol等 活性产物,作用于 IL6、ALB、MAPK8、VEGFA、CASP3、EGFR等靶点,正调控RNA聚合II启动子转录、凋亡过程负调控、肿瘤坏死因子细胞反应、血管生成的正向调节、神经元凋亡过程、上皮细胞增殖的阳性调节等生物过程,通过PI3K-Akt信号通路、乙型肝炎通路、前列腺癌通路、MAPK信号通路、糖尿病并发症中的AGE-RAGE信号通路等发挥多成分,多靶点、多通路治疗骨质疏松症的药理作用。
PPI网络图参数显示,人参桑椹治疗骨质疏松关键靶点主要有IL6、ALB、MAPK8、VEGFA、CASP3、EGFR等,30种蛋白度值高于平均值,这些结果表明,关键靶点与其它蛋白质关系密切,在PPI网络中具有较强的相互作用。其中,白介素-6(IL-6)与OP密切相关,血清IL-6的升高是OP发病的重要危险因素[14],IL-6能促进成骨细胞释放白介素-1(IL-1)、前列腺素E2(PGE2)等下游信号分子,降低OPG表达,升高RANKL表达,从而促进破骨细胞形成,增强骨吸收[15]。目前认为营养不良是OP发病的重要危险因素[16],而血清白蛋白(ALB)是衡量机体营养状况的重要指标,临床及实验研究显示[17−18],血清中ALB水平降低与骨密度下降呈明显正相关,证实低水平ALB与OP的发病密切相关。徐会金[19]在体外培养人的巨噬细胞实验中发现MAPK可通过调控IRF-3来上调IFN-P基因的表达,从而起到抑制破骨分化,减弱骨吸收作用,对延缓骨质疏松症进程起着重要作用。血管内皮生长因子A(VEGFA)是血管内皮生长因子家族中一种重要的细胞因子,可增加血管通透性,诱导血管生成。研究发现[20],正常健康人群体内VEGF表达较OP患病人群中高的多,证实其在维持骨代谢中起到重要的作用。其治疗骨质疏松症的作用机制可能是通过刺激血管内皮,增强成骨细胞的活性以此促进成骨生成[21],动物实验也已证实了[22]。将表达VEGF的腺病毒载体注射到新西兰兔股骨远端,结果表明,表达VEGF的腺病毒载体能显著增加兔股骨远端的骨量和成骨细胞数量。胱冬酶3(CASP3)是细胞线粒体凋亡通路中的关键蛋白,正常情况下以非活化的形式存在,当细胞凋亡程序启动时,CASP3被蛋白水解酶激活并与下游蛋白级联以促进细胞凋亡[23],因此调节成骨细胞及破骨细胞凋亡是许多中药治疗OP的重要作用机制[24]。EGFR是erbb家族四个成员之一的跨膜糖蛋白,构成酪氨酸激酶受体。EGFR是一种重要的生长蛋白因子,能稳定浅表软骨细胞数量,增加边界润滑剂的分泌,润滑软骨表面,从而增强关节软骨的力学强度[25]。研究[26]表明,EGFR的活化能高度刺激EGR-1、EGR-2和EGR-3的表达,通过促进大鼠成骨细胞和原代颅骨细胞的增殖和抑制其凋亡来维持其数量。
人参桑椹治疗骨质疏松症的KEGG通路富集结果显示,磷脂酰肌醇三激酶/蛋白激酶B(PI3K/Akt)信号通路作为细胞分化、增殖、迁移过程中一个重要的调节者,在骨质疏松病理过程中扮演着重要角色[27]。Adapala等[28]发现抑制PI3K/Akt信号通路活性,将使破骨细胞骨吸收能力减弱,从而达到延缓骨质疏松症进程的作用,其机制可能与激活下游的核因子κB受体活化因子(RANK)和巨噬细胞集落刺激因子受体(c-Fms)信号相关。已有研究证明病毒性肝炎患者骨质疏松症发生率显著增高,且与肝损害的程度呈正相关[29−30]。研究发现去势治疗前列腺癌能降低雄激素,同时经雄激素芳香化而来的雌激素也减少,雌激素通过调节核因子κB体活化因子、核因子κB受体活化因子配体、骨质疏松症G通路,促进破骨细胞增殖、分化,促进骨吸收,从而导致骨质疏松[31−32]。目前对骨重塑机制的深入研究,慢性炎症一定程度上参与了骨质疏松症的发展,而这种慢性炎症状态及相关的氧化应激可以通过激活晚期糖基化终末产物受体抑制WNT、ERK和PI3K信号抑制成骨细胞增殖[33−34]。研究表明,骨关节炎的软骨细胞具有更高的晚期糖基化终产物受体表达。晚期糖基化终产物激活受体可通过激活MAPK和核因子κB信号通路促进软骨细胞的分解代谢。由此可见,糖尿病并发症中的AGE-RAGE信号通路也有可能成为治疗骨质疏松症的潜在靶点。
通过网络药理学筛选,发现kaempferol、quercetin、beta-carotene、beta-sitosterol化合物在“成分-靶点-通路”网络中度值高于平均值。因此将这四种成分与PPI网络中度值前四的分子IL6、ALB、MAPK8、CASP3进行分子对接,结果显示,除beta-carotene与靶点对接后binding energy大于0 kcal/mol外,其余binding energy结果均小于0 kcal/mol,说明人参-桑椹的活性化学成分可以和IL6、ALB、MAPK8、CASP3蛋白进行较稳定的结合。同时,已研究表明[35−38],kaempferol、quercetin、beta-sitosterol均 表现出较好的抗癌、抗炎、抗氧化、抑制肿瘤及清除氧自由基的活性,表明这些成分在人参-桑椹药对改善骨质疏松症作用中扮演了重要角色。
