重组酶聚合酶等温扩增技术在食源性致病菌检测中的应用
2021-10-24付世骞杨鑫焱高平聘代晓斐满朝新姜毓君
秦 雪,付世骞,杨鑫焱,杨 涛,高平聘,代晓斐,苗 超,满朝新,姜毓君
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
食品安全问题关乎民生之大计[1]。据估计,全球每年发生15亿例微生物感染事件,造成460万人死亡[2],如2017年法国沙门氏菌污染事件[3],2018年荷兰奶粉阪崎肠杆菌污染[4],以及后来的法国奶酪大肠杆菌污染事件[5]等,给人们带来严重的生命财产损失。随着食源性疾病在各国频频爆发,食品安全问题受到了广泛重视。食源性致病菌主要有沙门氏菌、致病性大肠杆菌、副溶血性弧菌、金黄色葡萄球菌以及单增李斯特菌等,人们误食了食源性致病菌污染的食物后会产生呕吐、腹泻等症状,严重时会造成生命威胁[6]。因此,食物中食源性致病菌控制是保障食品安全的关键,而检测技术的开发与应用成为食源性致病菌控制的重要监测手段。
传统食源性致病菌检测方法主要依靠平板菌落计数法,但该方法耗时长,操作繁琐,而且灵敏度低,已不能满足我国对致病菌快速检测的要求。目前食源性致病菌的快速检测方法主要有ELISA检测[7]、胶体金免疫层析技术[8−9]以及分子检测技术[10],其中依赖于体外核酸扩增的分子检测技术被认为是一种准确的检测方式。重组酶聚合酶等温扩增(recombinase polymerase amplification, RPA),作为一种新型等温扩增技术,相比于传统的聚合酶链式反应(polymerase chain reaction, PCR)、多重PCR等技术,摆脱了耗时长、操作繁琐以及需要贵重仪器等缺点,实现高效、灵敏、甚至在资源紧缺的现场环境条件下对食源性致病菌的快速检测。
本文将对RPA技术进行全面阐述,包括反应机理、组成成分、引物探针设计方法以及灵敏度特异性等,并介绍了商业RPA反应试剂盒。此外,本文总结近年RPA技术在食源性致病菌检测中的应用以及该技术发展的热点,挖掘目前技术存在的优势与不足,并对RPA技术未来发展进行展望,旨在为RPA技术在食源性致病菌检测领域提供更广阔的思路。
1 RPA简述
重组酶聚合酶等温扩增是一种新型等温扩增技术,于2006年由Piepenburg提出[11],已被广泛用于各种靶标的扩增,例如来自各种生物体和样本的RNA、miRNA、ssDNA和dsDNA。尽管目前RPA技术在等温扩增技术占比不是很大,但近十年来该技术发展最为迅速[12]。与环介导等温扩增(LAMP,loop-mediated isothermal amplification)、滚环扩增(RCA, rolling circle amplification)、链置换扩增(SDA, strand displacement amplification)等等温扩增技术相比,RPA引物设计简单,仅需要两条引物即可实现反应。反应所需温度在37~42 ℃,甚至在室温下也可实现扩增,并且可在20 min内到达检测水平[13−14]。该技术与其他扩增技术应用于致病菌检测方面的比较见表1,结果表明,RPA技术无论是在反应时间,还是反应温度方面都表现出比其他核酸扩增更大的优势,并且具有良好的灵敏度,特别是资源匮乏的现场检测。
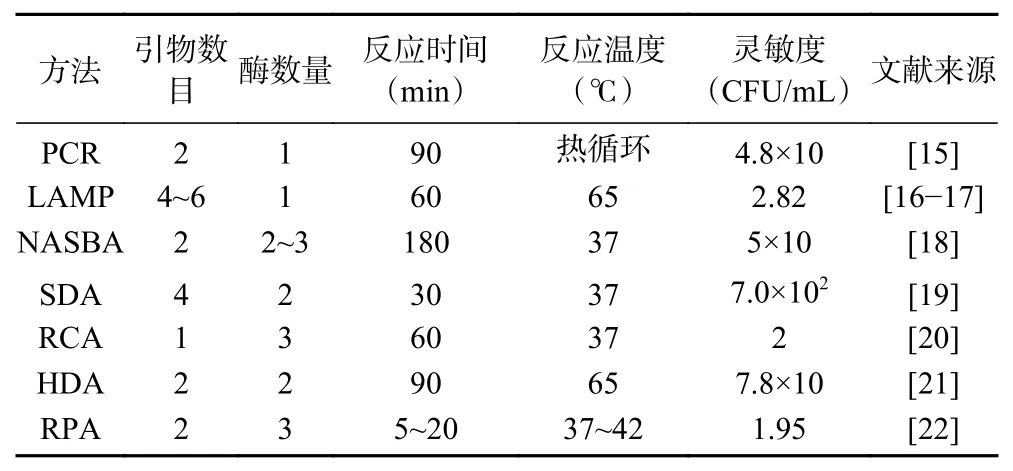
表1 RPA与其他核酸扩增技术比较Table 1 Comparison of RPA and other nucleic acid amplification methods
1.1 反应机理
RPA反应机制依赖于同源重组过程[23],是由TwistDx生物技术公司开发的一种新型体外等温扩增技术。该技术主要包括三种重要组分:重组酶(如T4uvsX等)、单链结合蛋白(如T4 gp32等)以及DNA聚合酶(S. aureusPol等)。重组酶uvsX与引物在ATP存在的条件下结合,形成重组酶-引物复合体,该复合体可以识别目标双链DNA模板上与引物互补的序列。重组酶将此位置的双链DNA打开,发生链置换反应并产生D-环状结构。此时,单链结合蛋白Gp32与被置换单链结合,防止再次形成双链。随后,重组酶-引物复合物主动水解体系中的ATP,导致该复合物构象发生改变,此时引物3’端暴露出来,DNA聚合酶Bsu与引物3’端结合,启动链延伸,形成新的互补链。在反应过程中,上、下游两条引物同时进行该反应,不断重复整个过程,实现产物DNA的指数增长。反应原理如图1。
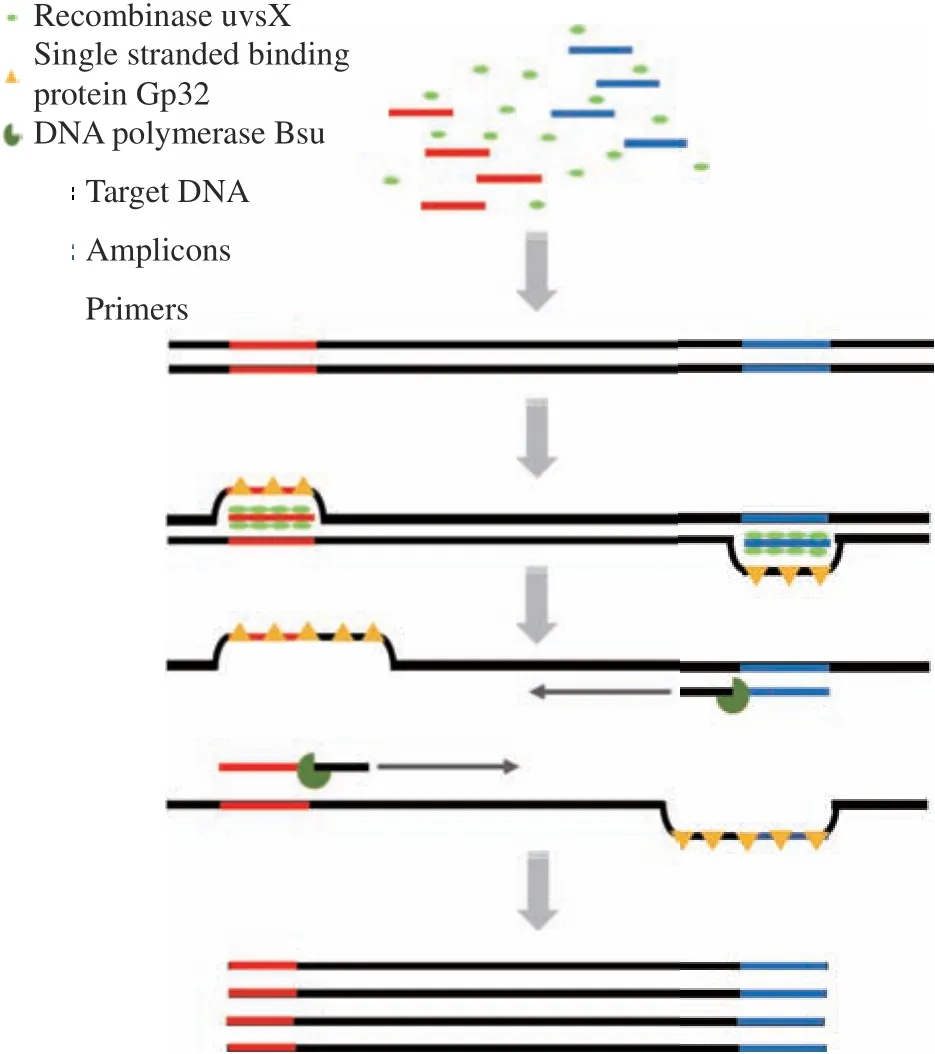
图1 RPA反应原理Fig.1 Principle of RPA
1.2 引物及探针设计
引物设计是RPA的关键技术之一,主要包括三个步骤:选择靶标区域,设计引物,引物筛选。但是迄今为止,还没有可用的软件来设计RPA的引物,因此目前RPA引物设计参考PCR引物设计方法,不同于常规PCR引物设计原则,RPA引物长度设计为30~35 bp,过短则会降低重组酶刺激以及完成RPA反应的能力,影响反应速度及灵敏度,过长易形成二级结构,但目前也有成功应用短的PCR引物(18~25 bp)实现RPA高灵敏度、高特异性扩增的研究,Fuller等[24]设计PCR特异性引物并结合试纸条用于RPA反应,证明了该引物在RPA反应中具有优于PCR反应的灵敏度。大多数已报道的RPA扩增子长度为100~250 bp,同时也存在少数使用过短和过长引物实现扩增方法[11,25]。此外,引物设计要求GC含量40~70%,5’端3~5个核苷酸应避免聚鸟嘌呤,引物浓度范围应在400~500 nmol/L之间[26]。
RPA探针的使用可以实现实时检测、核酸信号放大,探针的位置应处于上下游引物中间,并尽量避免下游引物与探针的重叠,探针浓度一般为120 nmol/L左右,设计方法可以参照TwistAmp™反应套装手册[27]。该公司设计合成了用于荧光检测的Exo探针和Fpg探针。这两种荧光探针合成原理是用荧光基团和猝灭剂对探针标记,通过荧光基团与猝灭剂之间的脱碱基位点上荧光探针裂解而产生荧光。其中,前者结合Exo探针以及核酸外切酶III,实现实时定量RPA,不过该方法终点产物总量有所减少,更适合强荧光信号动力学分析,不适合终点检测;后者添加了核酶fpg,荧光积累较慢,但终点产物总量不会减少,也可进行终点检测。此外,该公司还开发了TwistAmp®nfo技术,加入核酶nfo,并结合横向流动试纸,利用“三明治法”进行终点检测。此外,目前绝大多数PCR探针不可直接用于RPA反应,如聚合酶5’~3’核酸酶活性的探针系统,该酶活性与RPA系统完全不兼容,无法实现反应的完成。
2 RPA技术在食源性致病菌检测中的应用现状
RPA技术应用广泛,目前已有大量该技术与其他方法结合用于食源性致病菌检测的研究出现,如实时荧光定量RPA(real-time RPA,RT-RPA)、RPA-横向流动试纸条(RPA-lateral flow dipstick,RPA-LFD)、RPA-化学发光检测、RPA-电化学检测以及RPA-表面增强拉曼散射检测等,本部分主要简述这些方法在食源性致病菌检测中的应用。
2.1 实时荧光定量RPA
Real-time RPA(RT-RPA),是RPA基础反应体系与荧光探针结合起来的一种联用技术,该技术依赖于核酸外切酶Ⅲ切断Exo-探针中的四氢呋喃(THF),使该探针携带的荧光基团与淬灭基团分离,荧光信号增强,此时,酶切后产生的3’-OH作为DNA聚合酶的靶点,进一步扩增此探针,荧光强度不断增强[28],扩增过程中产生的荧光信号可由荧光信号检测器或扫描仪实时检测[29],Exo-探针应用于RT-RPA反应原理如图2。与RT-PCR比较,二者灵敏度与特异性相同,然而RT-RPA检测时间明显短于RT-PCR。王金凤等[30]针对单增李斯特菌特异性基因LMhly A保守序列设计RPA引物和exo探针,在37 ℃等温条件下20 min内完成扩增,灵敏度达5×10−1pg且特异性良好。Liu等[31]针对ompA特异性基因设计特异性引物,实现了15 min内快速检测乳中阪崎克罗诺杆菌,检测限为2.3×104CFU/mL,与RT-PCR结果相似。Geng等[32]根据空肠弯曲杆菌hipo基因设计引物和exo探针并建立RT-RPA方法,仅在13 min内检测到乳中空肠弯曲杆菌,检测限102拷贝/反应单元。RT-RPA因其灵敏度、特异性良好,反应时间短,已有大量研究利用该方法建立食源性致病菌的检测方法。
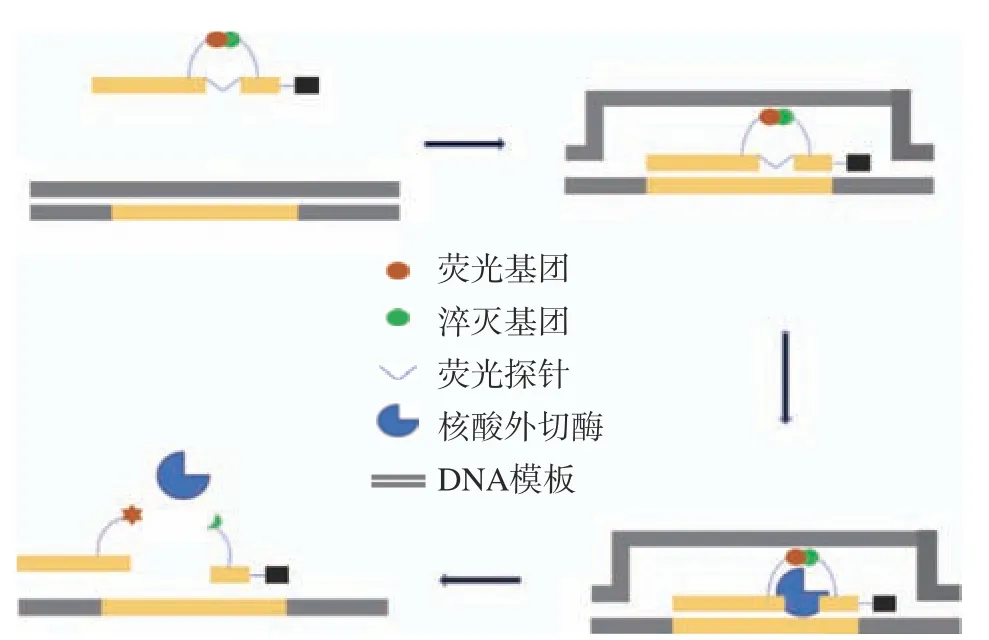
图2 Exo探针用于RT-RPA原理图[33]Fig.2 Principle of Exo probe for RT-RPA[33]
2.2 RPA-侧流试纸(RPA-LFD)检测
侧流试纸是一种简单可视化检测装置,可直接通过观察试纸条检测线、控制线颜色显现情况或读取灰度值来实现简单的定性或半定量。该方法结合了免疫、分子杂交以及胶体金技术,生物素标记的核酸扩增产物与FAM标记的特异性探针杂交。FAM标记的特异性探针与抗FAM抗体的金标物结合,该复合物在试纸的毛细作用下扩散,在检测线处生物素标记的扩增产物被生物素配体捕获,而未被捕获的复合物继续扩散,在质控线处被非特异性抗体捕获,形成具有颜色的检测线和质控线。侧流试纸的应用主要分为两种,对于大分子物质的检测一般采用三明治夹心法,对于小分子物质的检测则采用竞争法(图3)。近年来,RPA-LFD因其操作简单且无需专业仪器逐步成为目前研究较为成熟的一种技术。Liu等[34]、Xu等[35]、Hu等[22]建立了RPA-LFD检测牛奶中的沙门氏菌,检出限分别为1.05、4和1.95 CFU/mL。2019年,高建欣等[36]根据金黄色葡萄球菌保守的nuc基因设计特异性引物,将RPA与乳胶微球试纸条(LMTS)相结合检测金黄色葡萄球菌,检测限为1.2×10 CFU/mL,特异性良好。在实际样品检测中,经过3 h预增菌后,RPA-LMTS检测限可达1.2×102CFU/mL(g)。2020年,Hu等[37]和Wang等[38]利用RPA-LFD分别检测了牛奶中的大肠杆菌和单核增生李斯特菌,检测限达到4.4 CFU/mL和1 CFU/50 μL,结果均低于PCR-LFD方法检测限(1.05×10 CFU/mL)。结果表明,RPA-LFD方法的检出限低、灵敏度高、检测时间短,且结果可直接通过肉眼观察,非常适合资源有限的现场检测,具有良好的应用前景。但是RPA-LFD的缺点是RPA产物需进行稀释,否则产物会对试纸条上的抗体产生干扰,并且反应处于开放环境,容易引起假阳现象。此外,可以使用一些简单的加热设备,以实现更精确的现场检测。

图3 RPA-LFD检测原理图Fig.3 Principle of RPA-LFD
2.3 RPA-化学发光检测
化学发光原理是将氧化或水解反应产生的化学能转变为可见光,与一些基于荧光探针检测方法相比,化学发光检测更灵敏、更稳定,是与便携式检测设备(如智能手机)相结合的良好选择。但是,目前化学发光检测多用于病毒以及临床治疗方面,图4是Kunze等[39]提出的一种基于流式化学发光微阵列的芯片结合RPA方法检测两种病毒以及粪肠球菌,微阵列上的斑点可特异性识别微生物,通过产生的荧光信号对这三种微生物DNA进行定量,48 min内检测限达到5×103GU/μL,灵敏度与qPCR相当,表明RPA-化学发光方法使三种微生物同时检测成为可能。Jonas等开发一种有ED-2003涂层的聚碳酸酯芯片,将现有的基于流动化学发光微阵列测量原理由玻片转移到聚碳酸酯芯片上,使化学发光从微阵列层面走向常规分析,更具有普适性,并采用不对称RPA方法获得更强的发光信号,对嗜肺军团菌检测限为0.35 ng/L[40],与微阵列-ELISA结果一致。目前,RPA-化学发光方法应用于食源性致病菌的检测仍处于发展初期阶段,更多基于化学发光的微型化检测装置有待开发。

图4 RPA-化学发光检测原理图[39]Fig.4 Principle of RPA-Chemiluminescence detection[39]
2.4 RPA-电化学检测
电化学检测是利用电化学活性物产生和放大核酸信号。目前大多数是根据ELISA原理,将可溶性的抗原或抗体吸附到电极上,通过检测电流信号实现定性或定量,整个过程无需电泳和产物纯化,短时间内可完成整个检测。Del等通过ELISA电化学实验证明了电化学检测是光学检测灵敏度的5倍[41]。因此,RPA-电化学检测具有较高的分析灵敏度,检测速度快、成本低,可使用廉价材料如碳电极等以及采用便携式设备(如STAT 400双恒电阻器/恒流器)即可完成信号检测,非常适合现场检测使用。目前已有的电化学-RPA技术主要用于检测抗菌素耐药基因[42]、病毒[43]等,在食源性致病菌检测中的应用鲜有报道。2014年报道了一篇电化学结合固相RPA法检测土拉弗朗西斯菌[41],其原理图见图5,利用辣根过氧化物酶(HRP)催化特性,在过氧化氢存在下将无色TMB氧化为蓝色物质,将化学反应转变为电信号,检测限为4×106拷贝/50 μL,比常规电化学-RPA方法的检测限低,可能是因为受到固相以及基质干扰等的影响,但是该方法具有良好的特异性。未来仍需要大量基于RPA-电化学技术用于对检测食源性致病菌的研究以填补该方面的空缺。
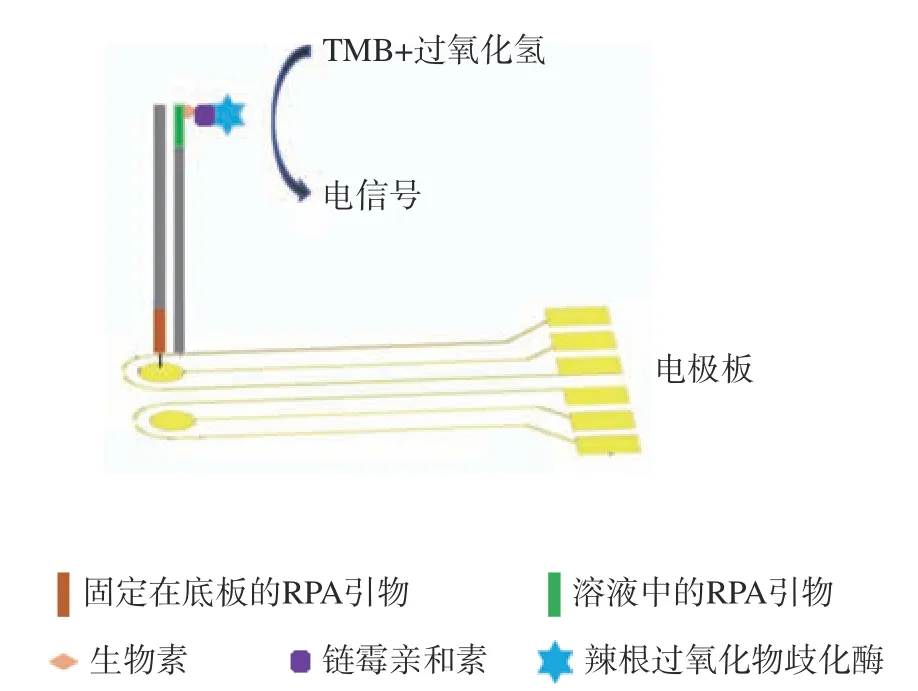
图5 RPA-电化学检测原理图[41]Fig.5 Principle of RPA-electrochemical detection[41]
3 RPA技术在食源性致病菌检测中发展热点
随着RPA技术的快速发展,其应用及检测系统也越来越多样化。本文针对RPA检测的热点应用进行了概述,以期实现真正的现场检测。
3.1 数字RPA
数字RPA原理是将液体分散在油相中从而产生很多液滴,每个产生的液滴充当一个单独的微型反应器,其中包含微型RPA反应的所有试剂,该方法可实现对初始核酸的绝对定量,不依赖校准曲线,与RT-RPA相比可得到更准确的结果。2015年,Schuler等[44]首次实现数字液滴RPA(ddRPA),成功地量化了单核增生李斯特菌DNA(100、215、464和1000拷贝),与数字液滴PCR检测结果一致。Tsaloglou等[45]设计了一种滑动芯片来检测艰难梭状芽胞杆菌,可同时进行8个RPA平行试验,检测限达到103拷贝。而Shen等[46]开发一种可同时进行1550个平行RPA反应的滑动芯片用来检测耐甲氧基西林金黄色葡萄球菌,灵敏度达到300拷贝/mL。由此可见,数字RPA在致病菌检测中正朝着高通量、快速的方向发展。多通道数字RPA与荧光检测集成在一个芯片中就是一个成功的例子,该方法无需建立污染牛奶标准曲线,45 min内即可检测出大肠杆菌O157:H7、单核增生李斯特菌和沙门氏菌,实现了对食源性细菌的快速、多通道、准确检测[47]。
3.2 多重RPA
在一些特定的条件下,单一致病菌的检测已不能满足快速检测的要求。多重RPA检测方法的开发在实现高通量检测致病菌方面具有重要意义。Santiago-Felipe等[48]以一种简单便携的检测系统为例,首次将RPA与光盘技术的结合,其建立了同时检测牛奶中沙门氏菌和克罗诺杆菌的检测方法,可以同时以最低检测成本和最小操作单元实现对不同目标的快速检测。Chen等[49]构建一种离心式芯片,将DNA提取、RPA和荧光检测结合,40 min内同时检测尿液样本中五种主要致病菌。Choi等[50]将碟式微流控芯片与RPA技术结合,将冻干的探针提前预载于反应室中,通过荧光检测装置读取荧光信号,在30 min内成功检测出牛奶中的沙门氏菌、大肠杆菌O157:H7和副溶血性弧菌,整个试验无需样品预处理,灵敏度为1.25细胞/L,节省时间和成本,灵敏度特异性良好,但该技术无法摆脱对荧光仪器的依赖,在资源有限的现场检测中应用受限。目前,多重RPA检测朝着更快速、前处理更简便的方向发展。
3.3 微型化RPA
为了适用于现场(point of care,POTC)检测,检测设备微型化也逐渐成为主流,以实现更加快速、灵敏、特异性高的检测。目前已有大量研究报道将微流体设备与RPA结合,将样品制备、扩增与信号检测集成为一体来检测致病菌。Renner等[2]开发了一种低成本、便携、易操作的荧光RPA微流体系统,同时检测粪肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、铜绿假单胞菌以及肠杆菌,特异性良好。2012年,Oordt等[51]研制出一台全集成微流控设备,从DNA提取到检测整个过程是全自动的,在45 min内可实现对炭疽芽孢杆菌和弗朗西斯氏菌的检测。Kim等[52]开发了一种离心微流体,其集样品裂解、RPA扩增、测定、稀释和侧流条带检测于一体,用于沙门氏菌的检测,30 min内实现在PBS以及牛奶中检测限分别达到10 CFU/mL和100 CFU/mL。Choi等[50]在一个基于箔的微流体上建立了集成RPA方法,直接采用PCR缓冲液裂解细胞,以RPA反应一步检出沙门氏菌、大肠杆菌O157:H7以及副溶血性弧菌,简化了样品前处理的步骤。因此,微流控RPA方法的开发是实现全自动化的一个过渡,更适用于资源匮乏、非专业人员操作等条件下的现场检测。但是样品前处理问题仍然是亟待解决的瓶颈。
4 总结与展望
PCR技术是核酸检测的一次重大革命,而RPA技术因其温度要求低、检测速度快成为未来可能替代PCR技术的技术之一,该技术虽然引入较晚,但发展非常迅速。本文从原理、引物及探针设计,并结合目前针对食源性致病菌检测的实际应用以及研究热点对RPA技术进行综述,提出利于RPA技术未来发展方向的建议。
RPA技术虽然发展之势迅猛,但仍存在明显问题。第一,目前RPA技术大多停留在实验室层面,在现场检测的应用还有所欠缺,因此,RPA的发展应更加关注于样品前处理以及便携式、全自动等问题,以更有利于现场检测,提高检测效率。第二,缺少专门针对RPA反应引物设计的软件或网站以简化引物和探针的设计,因此,在未来的一段时间内RPA技术不会完全取代PCR技术。第三,目前研究基本采用TwistDX公司开发的试剂盒,存在着成本较高的问题,如何降低成本也是RPA未来发展的一大方向。第四,RPA反应由复杂酶系参与,酶活力是保障实验成功的关键因素,但是该酶系易热失活,因此,在现场检测中酶系的储存方式以及酶活力对RPA反应影响有待研究。最后,由于RPA反应温度接近于人的体温,未来可以尝试开发依靠体温进行RPA扩增以实现对食源性致病菌的人体自检。本研究发现,目前RPA技术在食源性致病菌检测中仍存在很多空白有待深入研究,需要更多RPA结合新技术检测致病菌方法的开发,尤其是电化学以及表面拉曼增强散射方法的应用。随着RPA技术的不断完善,其前景将会更加广阔。
