野地瓜茎中3种绿原酸提取工艺的优化及抗氧化活性研究
2021-10-13刘永玲马风伟赵治兵杨怡方丽红谢国芳
刘永玲,马风伟,赵治兵,杨怡,方丽红,谢国芳*
(1.贵阳学院食品与制药工程学院,贵州 贵阳 550005;2.贵州省果品加工工程技术研究中心,贵州 贵阳 550005)
野地瓜(Ficustikoua Bur.)又名过山龙、地果、地瓜藤等,系桑科榕属多年生匍匐木质藤本植物,为食药两用资源,该属植物具有清热利湿、活血通络、解毒消肿、抗菌、抗肿瘤等作用[1]。野地瓜全株富含三萜类、黄酮类、酚酸类等成分[2],课题组前期利用在线高效液相色谱-质谱-二苯基三硝基苯肼技术筛选并鉴定出了野地瓜茎正丁醇相中存在新绿原酸、绿原酸和隐绿原酸3种抗氧化活性成分[3]。目前关于野地瓜中绿原酸类化合物的研究仅报道了不同提取溶剂对绿原酸提取率的影响[4],尚未见野地瓜中其它绿原酸成分及绿原酸类化合物提取工艺的研究。
绿原酸类化合物是分布于植物中的酚酸类化合物,具有保肝、抗炎抗菌、抗氧化、抗肥胖、抗高脂血症及保护神经等的生理功能,现已大量应用到了食品加工、植源性化妆品和医药用品中[5],因此寻找绿原酸类化合物的新来源是必不可少的。近年来研究绿原酸类化合物的提取方法有水提法、有机溶剂提取、分级萃取[6]、超声波辅助[7]、微波辅助[8]、超临界 CO2萃取[9]和生物酶法[10]等,这些方法中仅有有机溶剂提取在工业化生产中可行,且发现提取溶剂中乙醇为首选提取剂[11],响应面法是基于数学与统计学快速建立模型方程得到最佳工艺的分析方法[12]。因此基于响应面设计的回流提取可适用于野地瓜茎中绿原酸类化合物的工业化开发。
基于此,为制备这3种高纯度化合物,本文引入总评归一值(overall desirability,OD)来表达最终效应,通过响应面分析法优化野地瓜茎中3种绿原酸化合物的热回流提取工艺,采用DPPH自由基和ABTS+自由基清除率来评价野地瓜茎提取物的抗氧化活性,为野地瓜中绿原酸类化合物的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
野地瓜茎:于2019年6月采自贵州赫章县白果镇犀牛唐村高桥组,将野地瓜茎上触底生长的不定性根去除,选取粗细略等的棕褐色野地瓜茎,经干燥粉碎过60目筛备用;隐绿原酸、新绿原酸标准品(纯度≥98%):美国斯坦福分析化学品公司;绿原酸标准品(纯度≥98%):北京北纳创联生物技术研究院;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2-azino-bis(3-ethyl-benzothiazoline-6-sulfonic acid)diammonium salt,ABTS]、2,2-联苯基-1-苦基肼基(2,2-diphenyl-1-picrylhy-drazyl,DPPH):美国 Sigma公司;甲醇(色谱纯):天津市大茂化学试剂厂。
1.2 仪器与设备
LC-20A高效液相色谱仪、UV-2550紫外分光光度计、WondaSil C18色谱柱(4.6 mm×250 mm,5 μm):日本岛津公司;R-1001VN旋转蒸发仪:郑州长城科工贸有限公司;DF-101S集热式加热磁力搅拌器:上海越众仪器设备有限公司。
1.3 方法
1.3.1 高效液相色谱仪(high performance liquid chromatography,HPLC)检测条件
色谱柱:WondaSil C18(4.6 mm×250 mm,5 μm)柱;流动相:0.2%冰醋酸溶液(A)-甲醇(B),梯度洗脱程序:0~8 min:80%~75%A;8 min~13 min:75%A;13 min~22 min:75%~65%A;22 min~23 min:65%A;23 min~35 min:65%~40%A;流速1.0mL/min;检测波长300nm;柱温:25 ℃;进样量:10 μL。
1.3.2 供试品溶液的制备
准确称取野地瓜茎粉末1.0 g,加入60%乙醇15 mL,回流提取50 min,提取温度60℃,提取两次,过滤,合并提取液,无水乙醇定容至50 mL,HPLC测定前用0.45 μm有机滤膜过滤,即为供试品溶液。
1.3.3 标准品配制和标准曲线的绘制
1.3.3.1 标准品配制
精密称取新绿原酸、绿原酸、隐绿原酸标准品3.1、3.2、3.0 mg,分别置于10 mL容量瓶中,新绿原酸用70%甲醇溶解并稀释至刻度线,绿原酸、隐绿原酸分别用甲醇溶解并稀释至刻度线,摇匀,配制成浓度分别为310、320、300μg/mL的对照品储备液,4℃下储存备用。
1.3.3.2 标准曲线绘制
精密量取适量新绿原酸、绿原酸和隐绿原酸对照品储备液混合,甲醇定容,制成分别含新绿原酸6.2、12.4、18.6、24.8、31.0 μg/mL,绿原酸 48.0、96.0、144.0、192.0、240.0 μg/mL, 隐 绿 原 酸 6.0、12.0、18.0、24.0、30.0 μg/mL的混合标准溶液,根据“1.3.1”项下的色谱条件进样测定,拟合峰面积(y)和进样浓度(x,μg/mL)作回归曲线,分别得回归方程:新绿原酸y=11 285x-18 905(R2=0.999 8),在 6.2 μg/mL~31.0 μg/mL 范围内呈现良好线性关系;绿原酸y=10 191x-32 565(R2=0.999 1),在 48.0 μg/mL~240.0 μg/mL 范围内呈现良好线性关系;隐绿原酸y=11 590x-18 115(R2=0.999 0),在6.0 μg/mL~30.0μg/mL范围内呈现良好的线性关系。
1.3.3 3种绿原酸得率的计算
取野地瓜茎供试品溶液,用高效液相色谱仪进行测定,将峰面积代入相应的回归方程,即可求出新绿原酸、绿原酸和隐绿原酸的浓度,按式(1)分别计算3种绿原酸的得率。
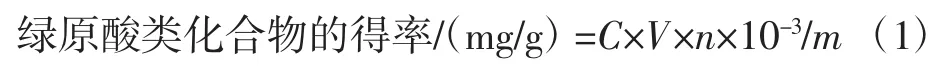
式中:C为绿原酸类化合物的质量浓度,μg/mL;V为定容体积,mL;n为稀释倍数;m为原料质量,g;10-3为质量换算系数。
1.3.4 绿原酸类化合物提取工艺的优化
1.3.4.1 单因素试验
将1.3.2中野地瓜茎供试品溶液的制备参数作为基本工艺条件,控制其单一变量,以3种绿原酸得率的总评归一值(OD)为标准,通过单因素试验考察乙醇浓度 40%、50%、60%、70%、80%;提取温度 50、60、70、80、90 ℃;料液比 1∶10、1∶15、1∶20、1∶25、1∶30(g/mL)3 个因素对3种绿原酸化合物得率的影响。总评归一值(OD)是采用Hassan法对3种绿原酸化合物的得率标准化为0~1之间的“归一值(λ)”,之后对“归一值(λi)”求算几何平均数,即OD=(λ1,λ2,……,λn)1/n(n为指标数)[13]。Hassan法中对取值越小越好的测量指标用公式[λmin=(Imax-Ii)/(Imax-Imin)],对取值越大越好的测量指标用公式[λmax=(Ii-Imin)/(Imax-Imin)],式中Ii为指标测量值,Imax和Imin指每一指标在同系列试验中的最大值和最小值[14],本次试验3种绿原酸得率为有效成分的含量,取值均为越大越好。
1.3.4.2 响应面试验设计
根据单因素试验结果,利用Design-Expert 8.0.6.1软件构建三因素三水平的试验方案,确定3种绿原酸得率最大的最佳提取工艺。
1.3.5体外抗氧化活性测定
精密称取野地瓜茎粉末10.0 g,选取响应面试验方案中归一值OD差别较大的3组工艺条件进行提取(n=3),提取液浓缩后于65℃烘箱下烘干,分别精密称取3组工艺条件下野地瓜茎提取物10.0 mg,无水乙醇定容到25 mL,DPPH自由基清除率试验参考文献[15],ABTS+自由基清除率试验参考文献[16]。
1.3.6 数据分析
IBM SPSS 22.0软件对试验数据进行总评归一值(OD)的计算及相关性分析,Design-Expert 8.0.6.1软件进行响应面试验方案的设计、二次回归方程的求解及结果的统计分析。
2 结果与分析
2.1 野地瓜茎提取物中3种绿原酸的HPLC分析
根据1.3.1项下HPLC检测条件,3种绿原酸的混合对照品及野地瓜茎供试品溶液的HPLC图谱见图1,此条件下可实现3种绿原酸化合物的基线分离。
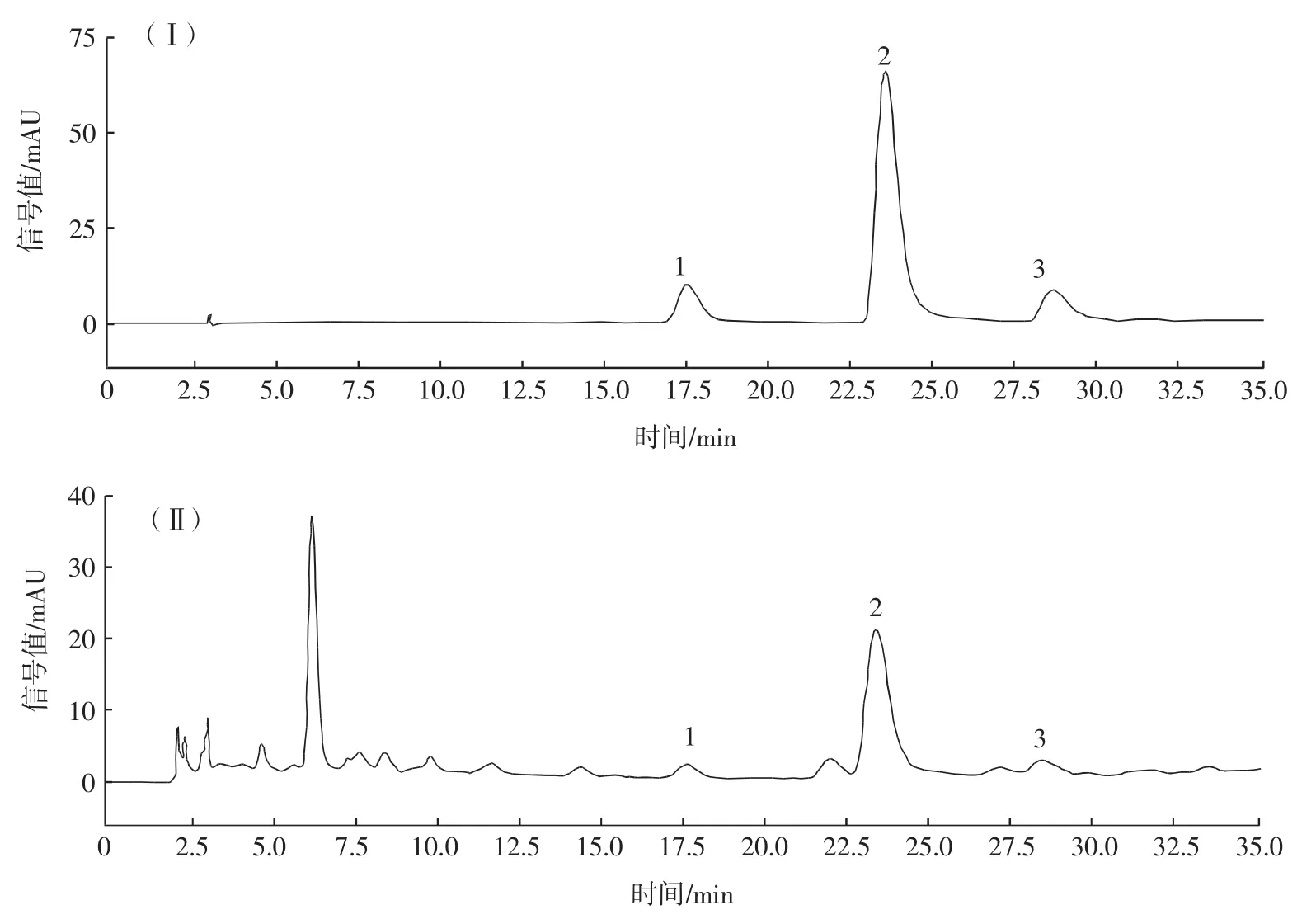
图1 混合对照品和野地瓜茎供试品溶液的HPLC图Fig.1 HPLC of the mixed reference standards and Ficus tikoua Bur.stems test solution
2.2 单因素试验
不同乙醇浓度、提取温度、料液比对3种绿原酸得率与总评归一值(OD)的影响见图2。
由图2可知,新绿原酸、绿原酸、隐绿原酸分别在乙醇浓度为60%、70%、50%时得率最高,总评归一值(OD)先升后降,在乙醇浓度为60%时达最高值,在乙醇浓度为70%~80%时归一值OD下降,其原因可能为乙醇浓度较高时一些非极性物质的溶出率增加,限制了野地瓜茎样品中绿原酸类化合物的溶解[17];由于乙醇浓度在60%、70%时归一值OD差别不大,根据结果后续优化试验中乙醇浓度的选取范围为50%~80%。由图2可知,绿原酸在提取温度为70℃、新绿原酸和隐绿原酸在温度为80℃时得率最高。当提取温度为70℃时归一值OD达最高值,在提取温度为80℃~90℃时归一值OD下降,其原因可能为绿原酸类化合物的同分异构体在较高温度下促进溶出,但温度过高可破坏其稳定性和结构[18],由于提取温度在70、80℃时归一值OD差别不大,根据结果后续优化试验中提取温度的选取范围为60℃~90℃。新绿原酸和绿原酸在料液比 1∶25(g/mL)、隐绿原酸在料液比 1∶30(g/mL)时得率最高,料液比为1∶25(g/mL)时归一值OD最大,随后有所下降,其中新绿原酸和绿原酸在料液比为1∶30(g/mL)时得率下降的原因可能为底物浓度随着提取溶剂用量的增加而使分子间的碰撞机会减少[19]。根据结果后续优化试验中料液比的选取范围为1∶20(g/mL)~1∶30(g/mL)。
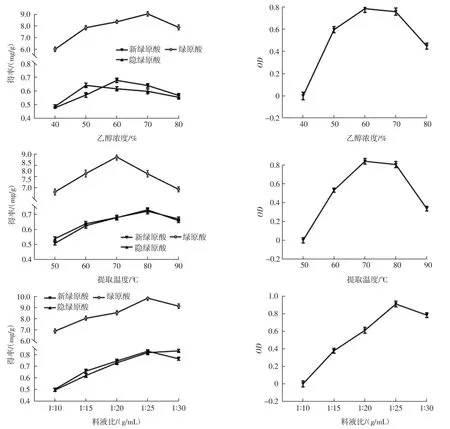
图2 不同乙醇浓度、提取温度和料液比对3种绿原酸得率及总评归一值(OD)的影响Fig.2 Effect of extraction ethanol concentrations,extraction temperature,and solid-liquid ratio on the extraction yield of three chlorogenic acid compounds and OD values
2.3 响应面工艺优化试验
2.3.1 响应面设计与回归模型的建立
在单因素试验基础上,以料液比(A)、乙醇浓度(B)和提取温度(C)为自变量,以新绿原酸、绿原酸和隐绿原酸得率的归一值OD(Y)为响应值,设计三因素三水平的响应面试验,试验因素与水平设计见表1。通过Box-Behnken中心组合的17组试验的响应面分析结果见表2。

表1 因素水平Table 1 Factors and levels
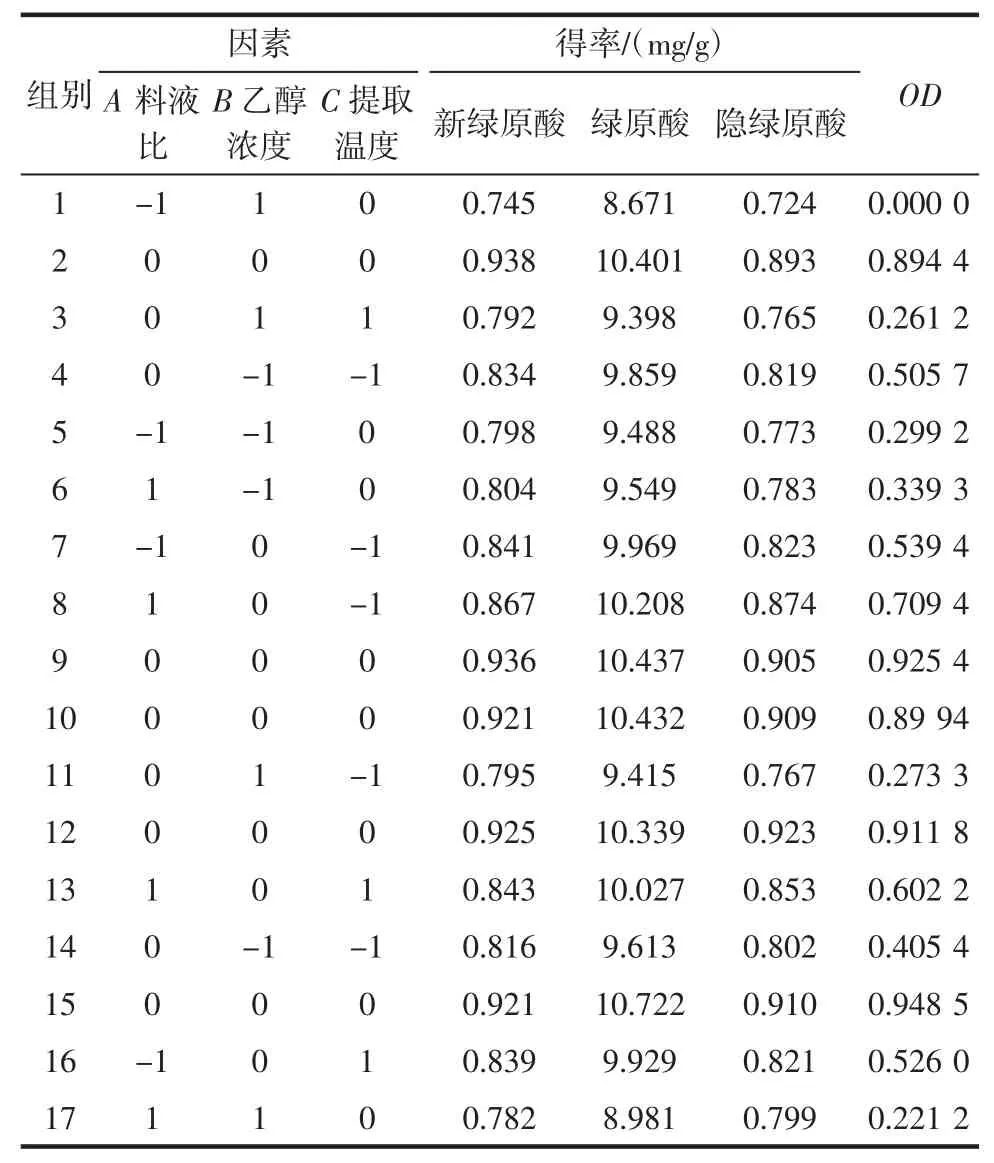
表2 响应面分析方案及试验结果Table 2 Response surface analysis scheme and test results
2.3.2 回归模型的方差分析
以总评归一值(OD)为考察指标,采用Design Expert 8.0.6.1软件对表2试验数据拟合得二次回归方程:Y=0.920+0.063A-0.099B-0.029C+0.045AB-0.024AC+0.022BC-0.230A2-0.470B2-0.088C2。响应面结果的方差分析见表3。
由表 3可知,回归模型极显著(P<0.000 1),调整确定系数RAdj2=0.996 5,说明模型拟合程度良好,失拟项P=0.914 7>0.05,模型失拟度不显著;其中一次项A、B(P<0.000 1)、C(P=0.002 1)和二次项 A2、B2、C2(P<0.000 1)对响应值 OD 的影响极显著(P<0.01);AB(P=0.001 3)对响应值 OD 的影响极显著(P<0.01),AC(P=0.030 8)、BC(P=0.038 0)对响应值 OD 的影响显著(P<0.05),说明各因素对响应值OD的影响并不是单纯的线性关系。由显著性及F值可知,对响应值OD(Y)影响程度的大小依次为乙醇浓度(B)>料液比(A)>提取温度(C)。
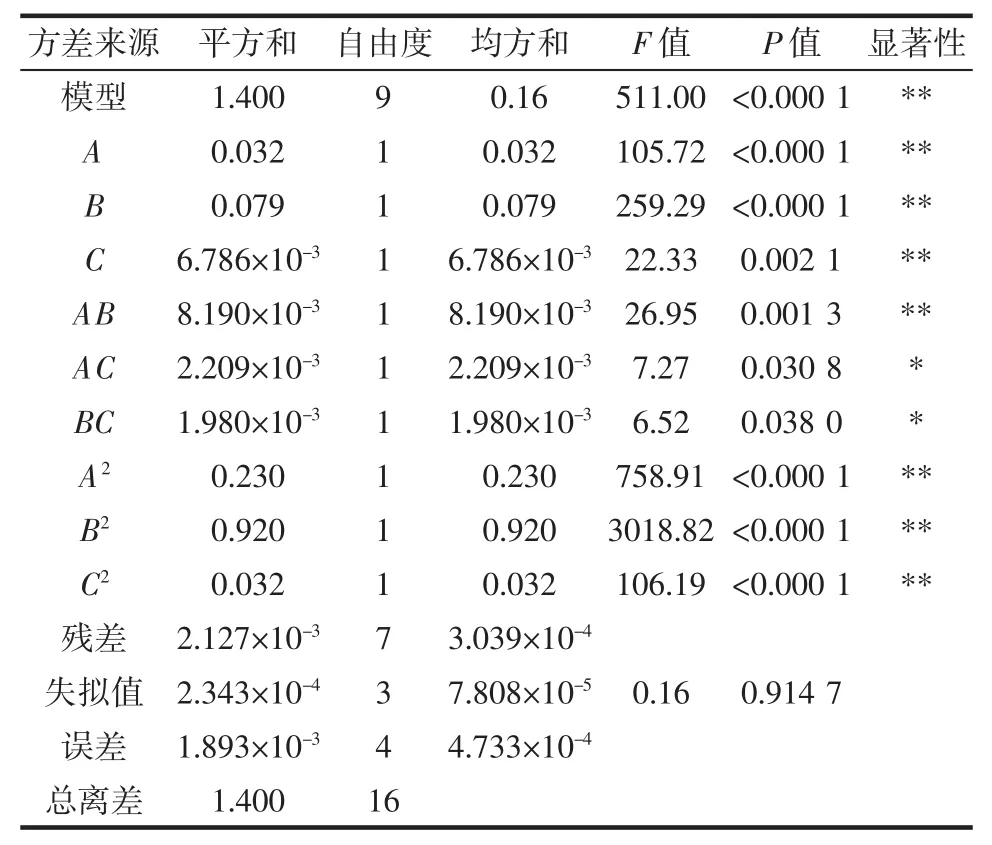
表3 响应面模型方差分析Table 3 Variance analysis of response surface model
2.3.3 响应面工艺优化分析
根据二项式模型回归方程,响应面及等高线图形状可以反映出两因素交互作用的强弱和显著程度,响应面坡度越陡峭、等高线呈椭圆形表明交互作用越显著[20]。各因素交互作用对OD值的曲面图见图3。
由图3可知A、B对响应值OD的影响成抛物线形,在乙醇浓度为62%~68%和料液比在1∶26(g/mL)左右时响应值OD达到最高值,且AB交互作用下等高线图形所呈现的椭圆形极显著,说明乙醇浓度和料液比的交互作用强于其它交互项。由图3可知提取温度对响应值OD的影响相对于乙醇浓度和料液比的影响较小,但AC、BC之间所呈椭圆形显著,表明AC、BC之间的交互作用对响应值OD的影响显著(P<0.05)。
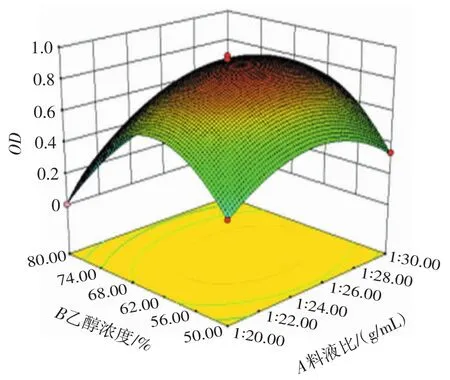
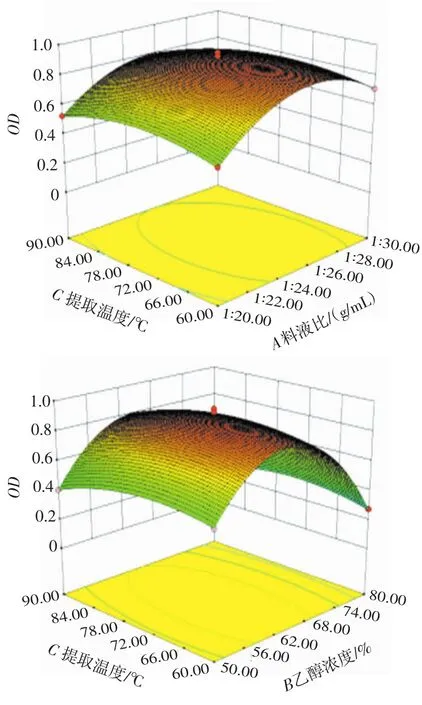
图3 各因素交互作用对OD值的曲面图Fig.3 Response surface plots of interaction of various factors on OD value
2.3.4 最佳提取工艺确定及模型验证
根据模型方程得到野地瓜茎中3种绿原酸提取的最佳工艺为:乙醇浓度为63.43%,料液比为1∶25.68(g/mL),提取温度为72.05℃,此条件下响应值OD的预测值为0.928 0。结合实际试验,设定乙醇浓度为63%,料液比为 1∶26(g/mL),提取温度为 72 ℃,进行提取工艺验证试验(n=3),此条件下实际测得新绿原酸、绿原酸和隐绿原酸的得率分别为(0.933±0.014)、(10.428±0.117)、(0.910±0.012)mg/g,OD 值为 0.920 1±0.023 0,二项式拟合方程预测值与实测值的偏差为0.85%,二项式拟合效果好,可信度高。
2.4 野地瓜茎提取物体外抗氧化作用
根据总评归一值OD,选取表2响应面试验方案中OD最小值(第1组,编号:A组)、OD中间值(第4组,编号:B组)和模型预测最佳工艺组(编号:C组),按1.3.6项下方法进行自由基清除率试验,A、B、C组提取工艺下野地瓜茎提取物和对照组VC对DPPH自由基清除活性的 IC50分别为(27.98±0.57)、(26.80±0.54)、(24.32±0.52)、(15.49±0.46)μg/mL,对 ABTS+自由基清除活性的 IC50分别为(77.10±0.83)、(73.08±0.79)、(67.52±0.89)、(45.03±0.52)μg/mL,由此得到 A、B、C组工艺下野地瓜茎提取物和VC对照组清除DPPH自由基、ABTS+自由基能力的顺序依次为VC>C组>B组>A组。
不同提取工艺下野地瓜茎中3种绿原酸得率变化与抗氧化作用的相关性分析见表4。

表4 不同提取工艺下野地瓜茎中3种绿原酸得率变化与抗氧化作用的相关性分析Table 4 Correlation analysis of three chlorogenic acid contents and antioxidant activities in the Ficu stikoua Bur.stems under different extraction processes
如表4所示,不同提取工艺下野地瓜茎提取物中3种绿原酸成分对DPPH自由基、ABTS+自由基的清除能力贡献显著,使得不同工艺下野地瓜茎提取物的体外抗氧化能力有所差异,且最佳工艺下野地瓜茎提取物的抗氧化活性较强。
3 结论
通过响应面分析法对野地瓜茎中3种绿原酸的热回流提取工艺进行优化,确定的最佳工艺条件为乙醇浓度 63%、料液比 1∶26(g/mL)、提取温度 72℃,此条件下测得新绿原酸、绿原酸和隐绿原酸得率分别为(0.933±0.014)、(10.428±0.117)、(0.910±0.012)mg/g,响应值OD为0.920 1±0.023 0;将总评归一值(OD)作为响应值得到各因素的影响次序依次为:乙醇浓度(B)>料液比(A)>提取温度(C);野地瓜茎提取物经体外抗氧化试验具有较好的抗氧化活性,相关性分析显示野地瓜茎在不同工艺下提取3种绿原酸得率的变化对DPPH自由基、ABTS+自由基的清除能力贡献显著。
另有,本试验采取综合考察模式“归一值”(OD)表达多个有效指标的综合效应,建立的回归模型方程对整体提取工艺的优化与预测更加直观,该工艺试验的优化及抗氧化能力的测定为野地瓜茎中抗氧化化合物的开发提供了依据,也为课题组后期3种化合物的分离制备和活性筛选奠定了基础。
