不同产地白术炮制前后新绿原酸和绿原酸含量变化△
2022-02-18周建新邓哲陈蒙肖苏萍周海燕杜杰王继永
周建新,邓哲,陈蒙,肖苏萍,周海燕,杜杰,王继永
中国中药有限公司,北京 102600
白术是菊科植物白术Atractylodes macrocephalaKoidz.的干燥根茎,具有健脾益气、燥湿利水、止汗、安胎的功效,可用于治疗脾虚食少、腹胀泄泻、痰饮眩悸、水肿、自汗、胎动不安等证[1],主产地有安徽亳州、河北安国、湖北来凤、重庆秀山、湖南邵阳、四川雅安、四川乐山等[2]。
2020 年国家中医药管理局首次公布古代经典名方关键信息[3-4],其中白术处方用药为生白术。白术中含有挥发油、内酯类、多糖、皂苷、酚酸等多种成分,炮制后,化学成分会有一定的变化。近年来对白术炮制前后的化学成分研究偏重于其所含的多糖和内酯类成分。研究发现,白术经炒制后多糖类成分和白术内酯Ⅰ、白术内酯Ⅲ含量均有不同程度的升高,但苍术酮含量明显下降[4-5]。现代药理研究表明,绿原酸类成分具有抗菌、抗病毒、抗氧化、抗肿瘤等药理作用[6-7],是白术发挥药效的关键成分之一,监测炮制前后白术中绿原酸类成分含量的变化很有意义。2021年国家药品监督管理局正式发布了白术配方颗粒质量标准,首次将绿原酸类成分作为其含量测定的指标成分。目前,对炮制前后白术中绿原酸类成分的含量变化相关研究较少,建立的含量测定方法单一[8]。以“白术”“含量研究”为关键词,在中国知网检索到295篇文献,其中对白术药材中的新绿原酸和绿原酸同时测定的文献仅有1篇,其采用超高效液相色谱-二极管阵列检测器法(UPLC-DAD)建立了白术中绿原酸类成分的含量测定方法[9]。但用UPLC建立含量测定方法的成本较高。为全面评价白术药材及生白术饮片的质量,探索白术炮制前后新绿原酸和绿原酸的含量变化,降低含量测定成本,本研究建立用高效液相色谱法(HPLC)同时测定白术中的新绿原酸和绿原酸含量的方法,研究两者在炮制过程中的转移情况,为白术药材及生白术饮片的质量控制提供参考。
1 材料
1.1 仪器
XM-500UGF型双频超声波清洗仪(小美超声仪器有限公司);BX-808 型多功能中药切片机(浙江瑞安市永历制药机械有限公司)。
1.2 试药
对照品新绿原酸(批号:P30N10L104575,纯度:98.0%,上海源叶生物科技有限公司);绿原酸(批号:110753-202018,纯度:96.1%,中国食品药品检定研究院);水为娃哈哈纯净水;乙腈、磷酸为色谱级。
15 批白术药材经中国中药有限公司陈彦琳研究员鉴定为菊科植物白术Atractylodes macrocephalaKoidz.的干燥根茎,均符合《中华人民共和国药典》2020年版规定(表1)。
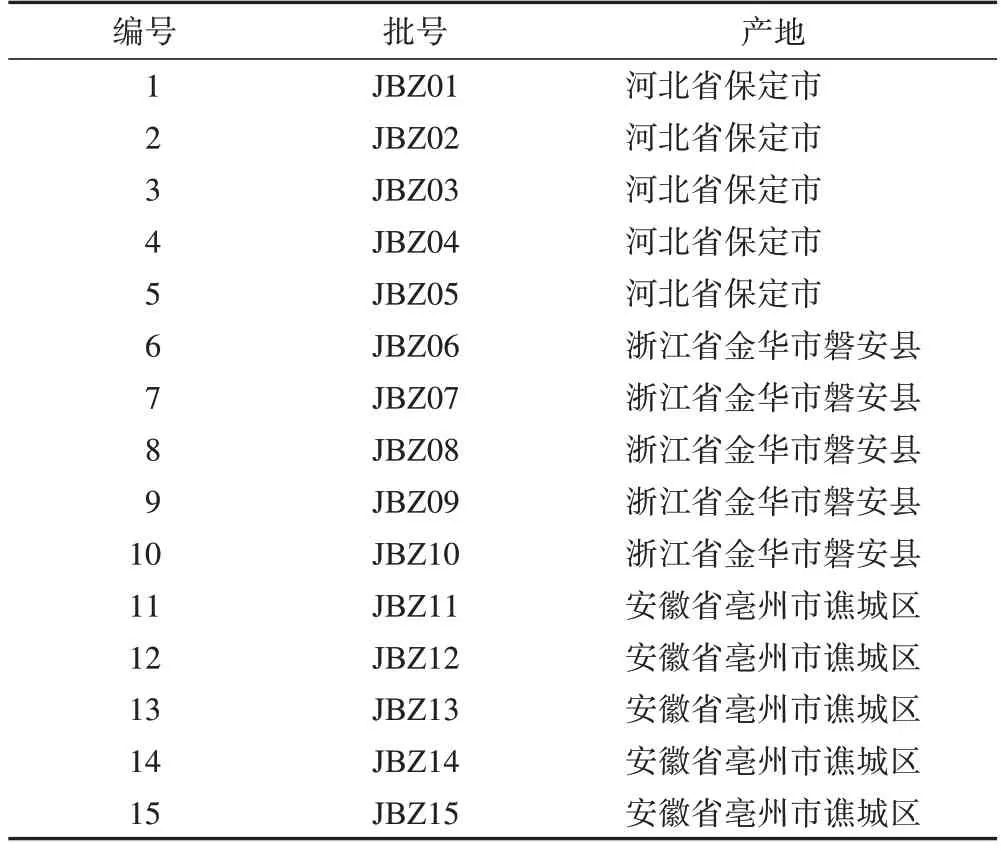
表1 15批白术药材信息
2 方法与结果
2.1 15批白术药材炮制
将每批白术药材拣去杂质及非药用部位,按大小分档。净制后,加水没过,根据不同大小,浸泡8~16 h,中间可翻动数次,至水量降低为加水量的1/2,取出,稍晾至表皮微干,堆润12 h。使用刨片机中速切制成厚度为2~4 mm 的片,50 ℃鼓风干燥6~8 h,收集装袋,备用。
2.2 色谱条件
CAPCELL PAK C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈(A)-0.1%磷酸水溶液(B)梯度洗脱(0~25 min,8%~13%A);柱温:30 ℃;流速:1 mL·min-1;检测波长:325 nm;进样量:10 μL,色谱图见图1。
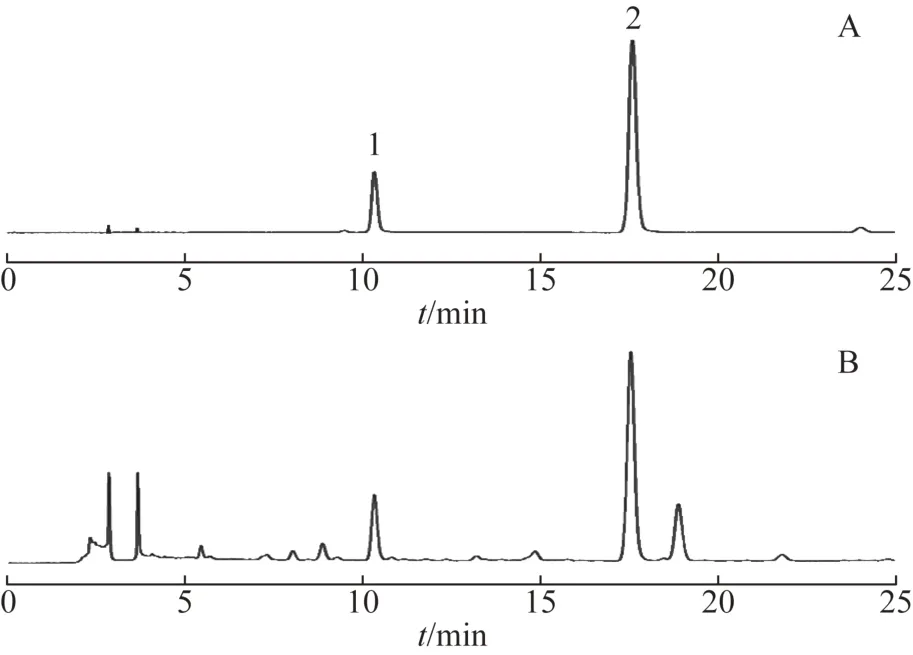
图1 白术中新绿原酸和绿原酸HPLC图
2.3 溶液的制备
2.3.1混合对照品溶液的制备 取新绿原酸对照品适量于100 mL 量瓶中,加甲醇溶解后定容,备用;取绿原酸对照品适量于25 mL量瓶中,加甲醇溶解后定容,备用;分别吸取新绿原酸和绿原酸对照品溶液1 mL 于10 mL 量瓶中,加甲醇定容,制得质量浓度分别为9.75、40.44 μg·mL-1的混合对照品溶液。
2.3.2供试品溶液的制备 称取白术药材粉末(过三号筛)约1 g置50 mL锥形瓶中,精密加入50%甲醇10 mL,称定质量,水浴回流提取60 min,冷却,用50%甲醇补足质量,摇匀,0.45 μm滤膜滤过,取续滤液,即得。
2.4 方法学考察
2.4.1线性关系考察 分别取混合对照品溶液2、4、6、8、10 mL,置10 mL量瓶中,加甲醇至刻度,摇匀,吸取10 μL 注入高效液相色谱仪。以进样量为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,得新绿原酸标准曲线方程:Y=2 299 295.8X+3 151.80(r=0.999 0),线性范围为1.950~9.750 μg·mL-1;得绿原酸标准曲线方程:Y=2 548 975.4X+9 504.20(r=0.999 5),线性范围为8.088~40.440 μg·mL-1。
2.4.2精密度试验 取样品(批号:JBZ06)粉末,按2.3.2项下方法制备供试品溶液,按2.2项下色谱条件连续进样6 次,记录峰面积。结果显示,新绿原酸、绿原酸峰面积RSD 分别为1.18%、0.27%,均低于2%,表明仪器精密度良好。
2.4.3稳定性试验 取样品(批号:JBZ06)粉末,按2.3.2项下方法制备供试品溶液,按2.2项下色谱条件分别在0、4、8、12、24 h 进样1 次,记录峰面积。结果显示,新绿原酸、绿原酸的峰面积RSD 分别为1.74%、0.52%,均低于2%,表明在24 h内供试品溶液稳定。
2.4.4重复性试验 取样品(批号:JBZ06)粉末,按2.3.2项下方法平行制备6份供试品溶液,按2.2项下色谱条件进样,记录峰面积并计算含量。结果显示,新绿原酸、绿原酸的平均质量分数分别为0.009%、0.036%,RSD 分别为2.11%、2.24%,表明该测定方法具有良好的重复性。
2.4.5加样回收率试验 称取已知含量的白术药材,按1∶1 分别加入新绿原酸、绿原酸对照品,平行制备6 份供试品溶液,按2.2项下色谱条件测定,计算回收率及RSD,结果见表2。
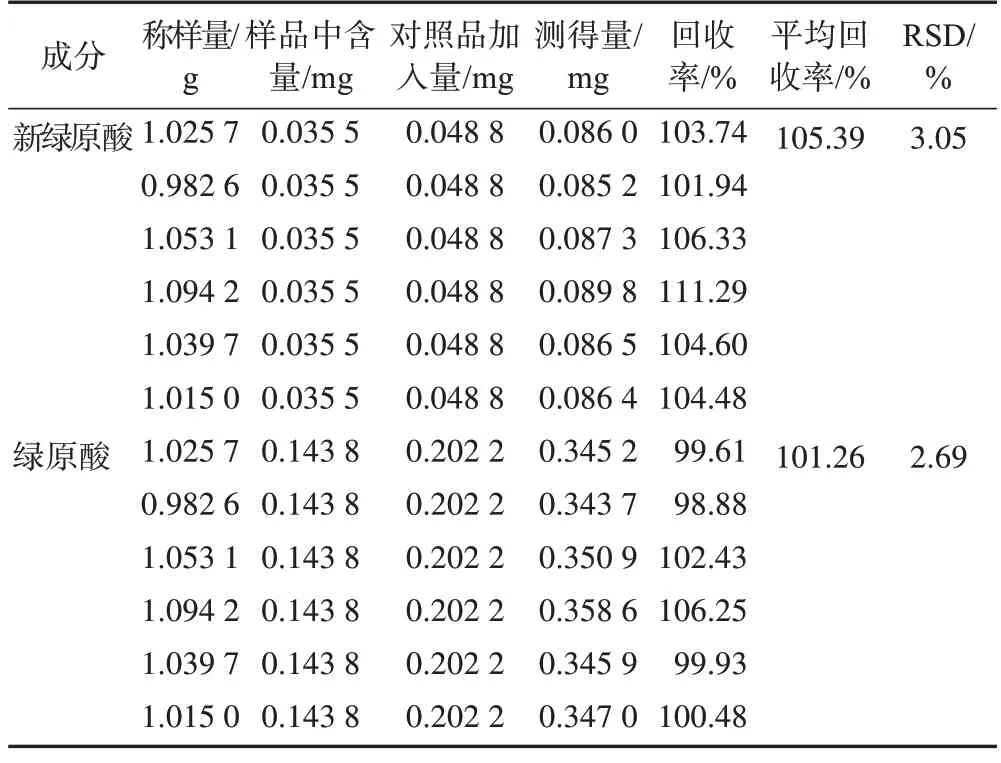
表2 白术药材中新绿原酸和绿原酸加样回收率考察结果
2.5 不同产地白术药材和饮片中新绿原酸和绿原酸含量测定结果
取15批不同产地白术样品,各称取药材和饮片粉末(过三号筛)约1 g置50 mL 锥形瓶中,精密加入50%甲醇10 mL,称定质量,水浴回流提取60 min,冷却,用50%甲醇补足质量,摇匀,0.45 μm 滤膜滤过,取续滤液,作为供试品溶液。按2.2项下色谱条件进行测定,计算2 个成分的质量分数(表3)。15 批不同产地白术药材中绿原酸和新绿原酸含量最高的分别为河北和浙江,其中河北产地白术中的绿原酸平均质量分数为0.216 3%,浙江产地白术中的新绿原酸平均质量分数为0.010 8%,结果见图2~3。通过GraphPad Prism 8软件对各产地药材和饮片炮制前后新绿原酸和绿原酸含量进行单因素方差分析(ANOVA),去除转移率异常情况,结果见图4。转移率最高的是浙江产白术,新绿原酸和绿原酸平均转移率分别为55.68%、55.05%。
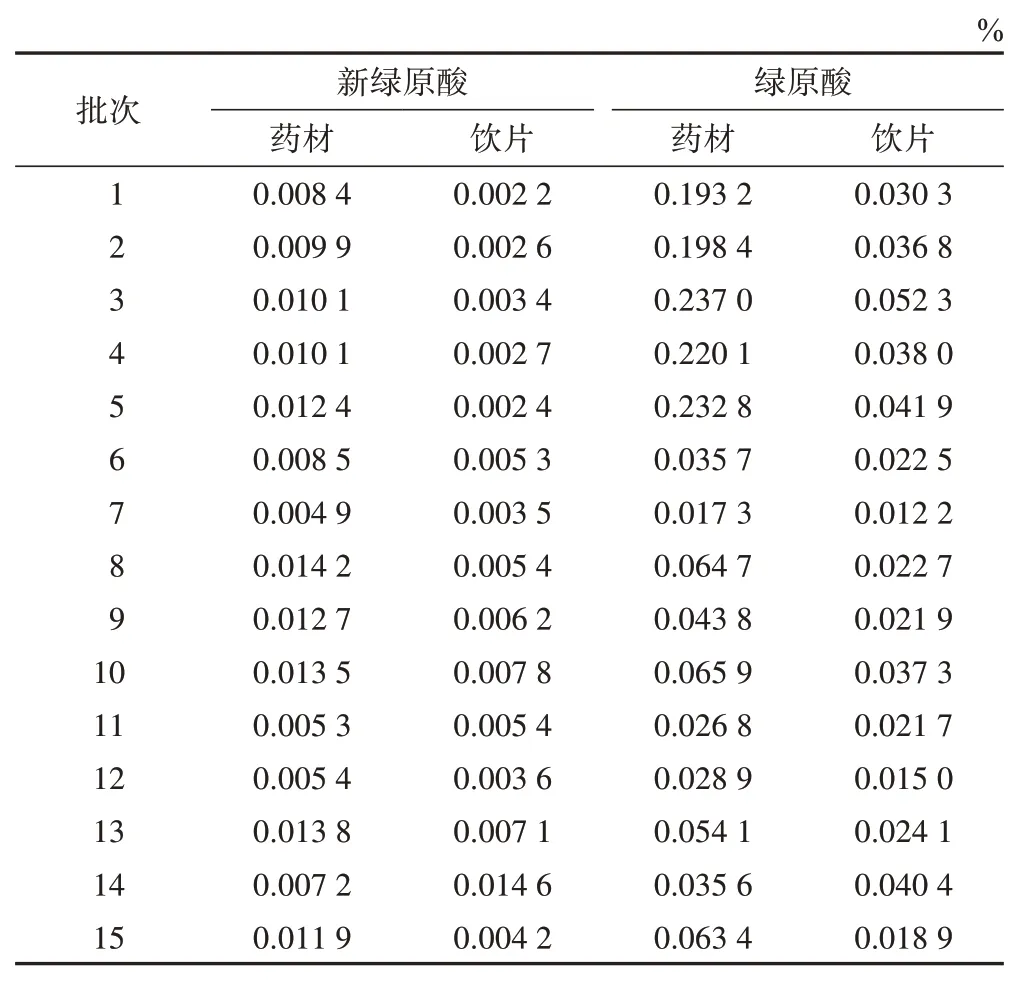
表3 15批白术药材和饮片中新绿原酸和绿原酸质量分数
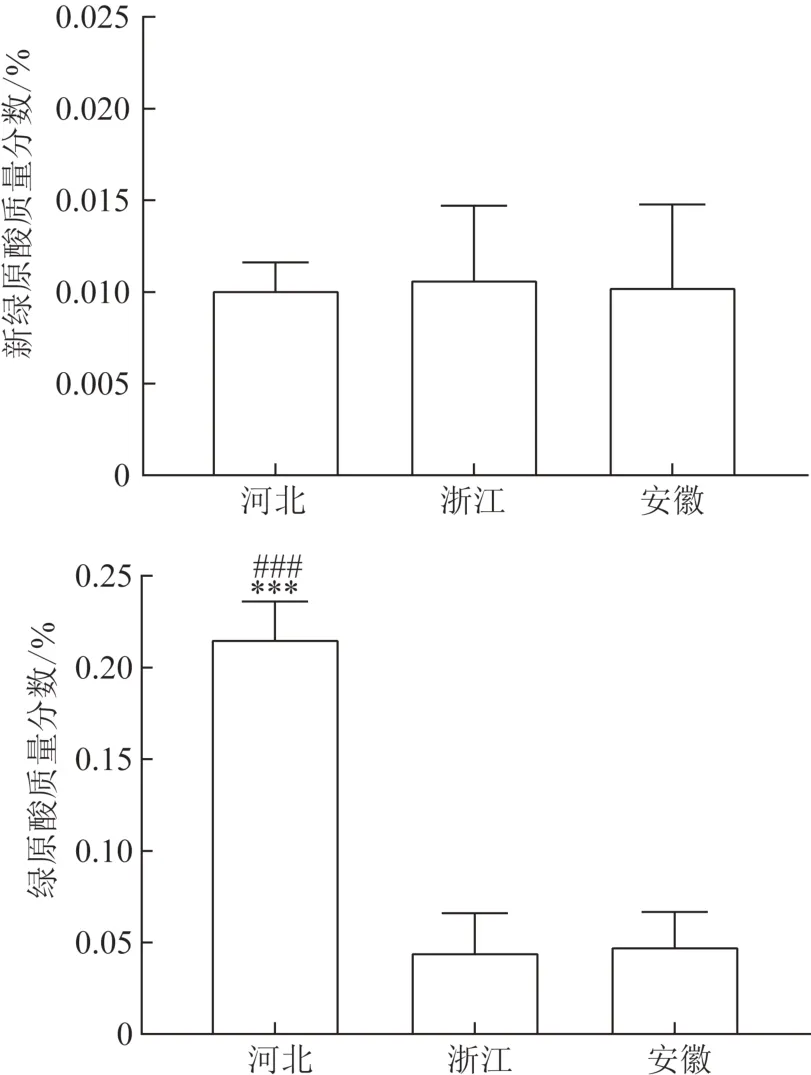
图2 各产地白术药材中的新绿原酸和绿原酸平均质量分数(,n=5)
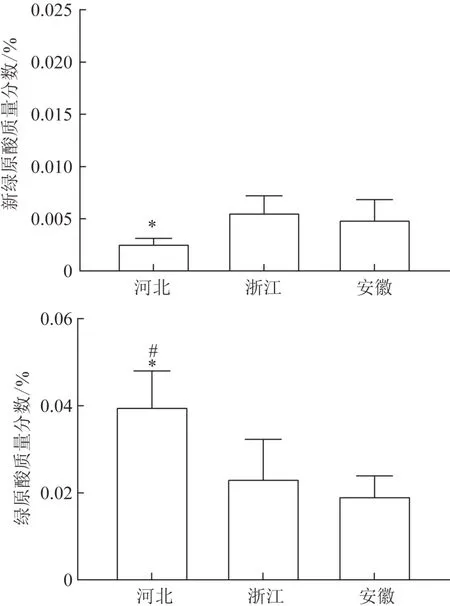
图3 各产地白术饮片中的新绿原酸和绿原酸平均质量分数(,n=5)
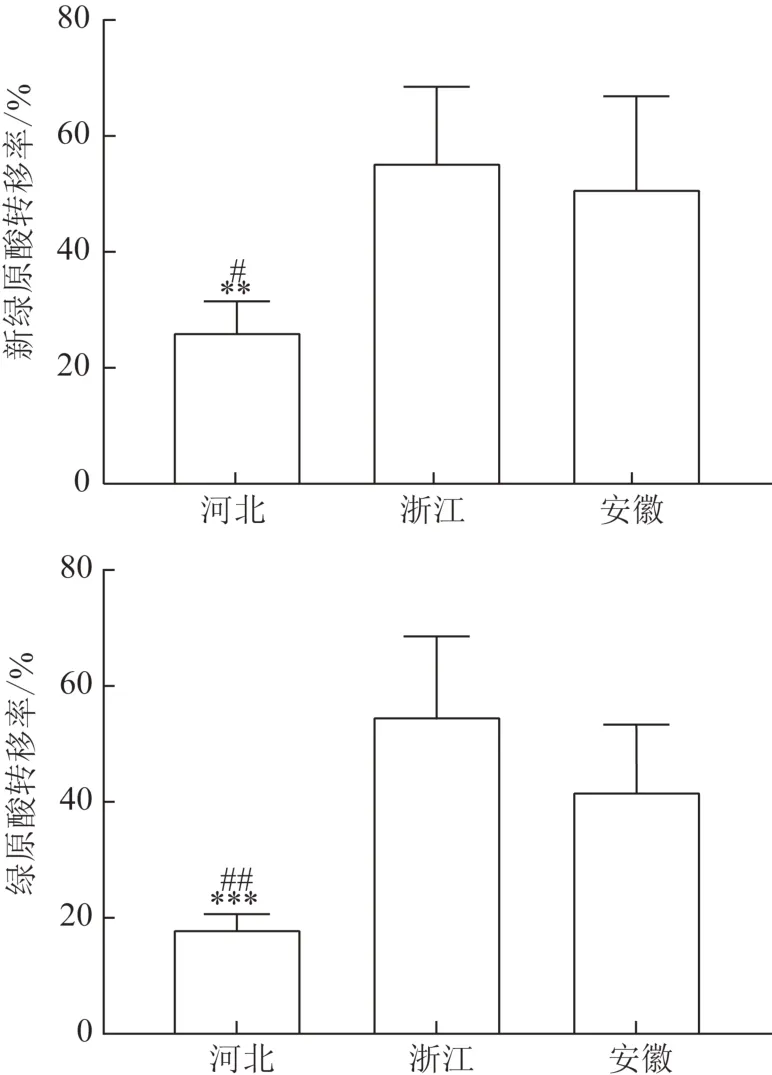
图4 各产地白术炮制前后新绿原酸和绿原酸的转移率(,n=5)
3 讨论
3.1 色谱条件优化
分别考察了不同梯度、流动相、柱温、色谱柱对色谱峰分离效果的影响,最终确定色谱条件。
3.1.1起始梯度的选择 分别考察了乙腈-0.1%磷酸水溶液(5∶95、8∶92、10∶90),其中起始梯度乙腈-0.1%磷酸水溶液为5∶95 条件下分析时间过长,起始梯度乙腈-0.1%磷酸水溶液为10∶90 条件下,新绿原酸保留时间短,考虑该色谱峰容易与杂质峰重叠未分离,故选择起始梯度乙腈-0.1%磷酸水溶液(8∶92)。
3.1.2流动相的选择 分别考察了乙腈-水、乙腈-0.1%磷酸水溶液为流动相的分离效果,发现乙腈-水、乙腈-0.1%磷酸水溶液条件下各色谱峰均能达到很好分离,但乙腈-0.1%磷酸水溶液条件下色谱峰峰形较好,故选择其为洗脱流动相。
3.1.3柱温的选择 分别考察了柱温30、35、40 ℃的分离效果,结果表明柱温对新绿原酸、绿原酸分离无影响,但是随着柱温升高,新绿原酸、绿原酸色谱峰保留时间相对提前。结合实际情况,选择柱温30 ℃为宜。
3.1.4色谱柱的选择 分别考察了色谱柱CAPCELL PAK C18(250 mm×4.6 mm,5 μm)、X-Bridge(250 mm×4.6 mm,5 μm)、Hpresil ODS C18(250 mm×4.6 mm,5 μm)的分离效果,结果显示色谱柱CAPCELL PAK C18(250 mm×4.6 mm,5 μm)、X-Bridge(250 mm×4.6 mm,5 μm)、Hpresil ODS C18(250 mm×4.6 mm,5 μm)均有较好的分离度,表明不同色谱柱的耐用性均较好。
3.2 提取条件的优化
分别考察了不同提取溶剂(甲醇、乙醇、水)、提取溶剂体积分数(25%甲醇、50%甲醇、75%甲醇)、提取方式(超声、回流)、提取时间(30、60、120 min)对白术中新绿原酸和绿原酸提取效果的影响,结果显示50%甲醇回流提取60 min效果最佳。
3.3 炮制前后新绿原酸和绿原酸含量变化
通过比较不同产地的白术炮制前后新绿原酸和绿原酸的含量,发现两者含量均有不同程度的下降趋势,分别计算浙江和安徽产白术新绿原酸和绿原酸转移率,结果表明白术在药材炮制为饮片的过程中成分含量损失50%左右。新绿原酸和绿原酸在植物体内分布广泛,来源于苯丙氨酸代谢途径,两者为同分异构体,分子结构均具邻位酚羟基,易在多酚氧化酶的作用下氧化发生缩合反应[10]。同时,植物中的苯丙酸类及其衍生物大多具有一定的水溶性[11],炮制过程中,白术药材需要浸泡8~16 h,捞出堆润12 h,此过程会溶出部分新绿原酸和绿原酸,降低两者在饮片中的含量。另外,烘干温度也会影响多酚氧化酶的活性,低温可抑制该酶活性,随着温度升高酶活性逐渐增强,达到80 ℃时,酶活性丧失[12]。本研究中,干燥温度设定为50 ℃,酶活性较强,催化白术中酚酸成分的分解,造成新绿原酸和绿原酸转移率下降。
此外,还比较了各产地白术中新绿原酸和绿原酸的转移率,河北产地的白术经过炮制后新绿原酸和绿原酸的转移率显著低于浙江和安徽产白术。本研究中,河北产白术大小明显小于浙江和安徽,推测可能是浸泡和堆润的时间过长导致,后续炮制工艺改进需要调整浸泡和堆润时间。
4 结语
本研究以白术中的新绿原酸和绿原酸作为指标成分建立的含量测定方法可为白术及其炮制品的质量评价提供参考,初步揭示了白术炮制前后新绿原酸和绿原酸含量的变化情况,可为进一步优化白术炮制工艺提供参考。
