基于UPLC-Q-TOF/MS的自发性高血压大鼠血浆代谢组学研究
2021-10-12陆登成韦姗姗
陈 帅,陆登成,王 维,韦姗姗
原发性高血压(essential hypertension,EH)是常见的慢性疾病之一,是多种心脑血管疾病的独立危险因素。EH发病涉及多个环节,但由于其受多基因、多因素影响,遗传和环境因素通过什么途径和环节升高血压,至今尚无确切定论,治疗效果也不尽如人意。
近年来,随着系统生物学的不断完善,对高血压的研究角度逐渐由局部转向整体。代谢组学通过对生物体体液或组织中的代谢物(分子量<1 000)进行检测、确定、定量和分类,并将代谢物与生物过程关联起来。磁共振(NMR)、液相色谱-质谱联用(LC-MS)、气相色谱-质谱联用(GC-MS)等技术是目前应用于代谢组学领域的主流手段。NMR无须前处理,对样本没有损伤,但灵敏度较低[1]。GC-MS具有高精密度、高灵敏度、高耐用性的特点,但对于生物体系中极性比较大的糖类、氨基酸等成分的分析,需要进行衍生化处理才能得到较多的代谢组分信息[2]。LC-MS具有对复杂生物样本的分离能力以及更好的灵敏度,其中超高效液相色谱-串联四极杆/飞行时间质谱(UPLC-Q-TOF/MS)以其高分离度、高灵敏度、对难挥发或热稳定性差代谢物的高分辨率,在分析机体复杂的代谢物中有极大优势。
自发性高血压大鼠(SHR)是目前全球公认最近似于人类EH的动物模型,其血压一般在12周龄达到稳定,8周龄时属血压升高早期。本实验通过UPLC-Q-TOF/MS技术检测早期SHR和Wistar大鼠血浆差异性代谢物,并寻找潜在生物标志物,以期为高血压发病早期的病理过程提供线索。
1 材料与方法
1.1 材料
1.1.1 实验动物 8只无特定病原体(SPF)级SHR,雄性,8周龄,体质量160~180 g;8只SPF级Wistar大鼠,雄性,8周龄,体质量250~280 g,均来源于北京维通利华实验动物技术有限公司[动物合格证:SCXK(京)2016-0006]。动物饲养光暗周期为12 h/12 h,自由饮食进水。所有实验操作符合实验动物管理条例。
1.1.2 试剂与仪器 仪器与耗材:Triple TOF 6600质谱仪(ABSCIEX,美国);Agilent 1290 Infinity LC超高压液相色谱仪(Agilent,美国);低温高速离心机(Eppendorf5430R,德国);色谱柱: A CQUITY UPLC BEH Amide 1.7 μm,2.1 mm×100 mm column(Waters,美国);ACQUITY UPLC HSS T3 1.8 μm, 2.1×100 mm column(Waters,美国);Softron智能无创血压计BP-2010E(北京软隆生物技术有限公司,中国)。
试剂:乙腈(Merck,1499230-935);乙酸铵(Sigma,70221);肝素(BioFroxx,EZ2811F323)等。
1.2 方法
1.2.1 血压检测 适应性饲养3 d后,每日09:00~11:00完成对SHR和Wistar血压的测量,实验期间共监测6次安静状态下大鼠血压。测量前开启预热泵,温度设定为37 ℃,预热10 min后将大鼠放置于固定器中,把无创血压测量尾套放置于大鼠尾部近根部,以未接触尾部白毛为准,测量大鼠安静状态下尾压,连续测量3次取平均值。
1.2.2 血浆收集及样品处理 实验结束后以戊巴比妥钠麻醉心脏取血,将血液放入置有20 μL肝素(10 mg/mL)的1.5 mL离心管中抗凝。离心后收集血浆,用液氮速冻后放入-80 ℃冰箱保存。检测时取出样本,在4 ℃环境下缓慢解冻后,加入400 μL预冷甲醇/乙腈/水溶液(2∶2∶1,V/V)混合,低温超声30 min,-20 ℃静置10 min,14 000×g、4 ℃离心20 min,取上清液真空干燥,质谱分析时加入100 μL乙腈水溶液(乙腈∶水=1∶1,V/V)复溶,涡旋,14 000×g、4 ℃离心15 min,取上清液进样分析。
1.2.3 UPLC-Q-TOF/MS分析条件 样品采用Agilent 1290 Infinity LC超高效液相色谱系统HILIC色谱柱进行分离,柱温25 ℃,流速0.3 mL/min,流动相组成A:水+25 mmol乙酸铵+25 mmol氨水,B:乙腈;梯度洗脱程序如下:0~0.5 min,95%B;0.5~7.0 min,B从95%线性变化至65%;7.0~8.0 min,B从65%线性变化至40%;8.0~9.0 min,B维持在40%;9.0~9.1 min,B从40%线性变化至95%;9.1~12.0 min,B维持在95%。整个分析过程中样品置于4 ℃自动进样器中。为避免仪器检测信号波动而造成的影响,采用随机顺序进行样本的连续分析。样本队列中插入QC样品,用于监测和评价系统的稳定性及实验数据的可靠性。
质谱条件:在正负模式下均使用电喷雾电离(ESI)。ESI源条件设置为:干燥气温度250 ℃,流量16 L/min;鞘气温度400 ℃,流速12 L/min;雾化器压20 psig;毛细管电压3 000 V;锥孔电压0 V;裂解电压175 V;采集频率4 Hz;扫描范围50~1 200;循环时间250 ms。在自动MS/MS采集中设置ESI源条件:雾化气40,辅助气80,气帘气30;源温度650 ℃;源喷雾电压±5 500 V。在高灵敏度模型下对二级离子扫描进行信息依赖采集(IDA)。参数设置:去簇电压±60 V,碰撞能(35±15)eV,排除4 Da以内的同位素,每个循环监测10个离子。数据采集按质量范围进行分段,50~300、290~600、590~900、890~1 200,从而扩大二级质谱的采集率,每个方法每段采取4个重复。所采得数据分别使用自建MetDDA和LipDDA,进行代谢物的鉴定。

2 结 果
2.1 血压水平 SHR组收缩压(160~180 mmHg,1 mmHg=0.133 kPa)、舒张压(120~140 mmHg)及平均压(130~150 mmHg)均高于Wistar组,差异有统计学意义(P<0.05)。详见图1~图3。
2.2 代谢组学分析 血浆样本正离子模式PCA图(见图4)与血浆样本负离子模式PCA图(见图5),两种模式下都能较好区分两组大鼠。

图4 PCA得分散点图(正离子模式)
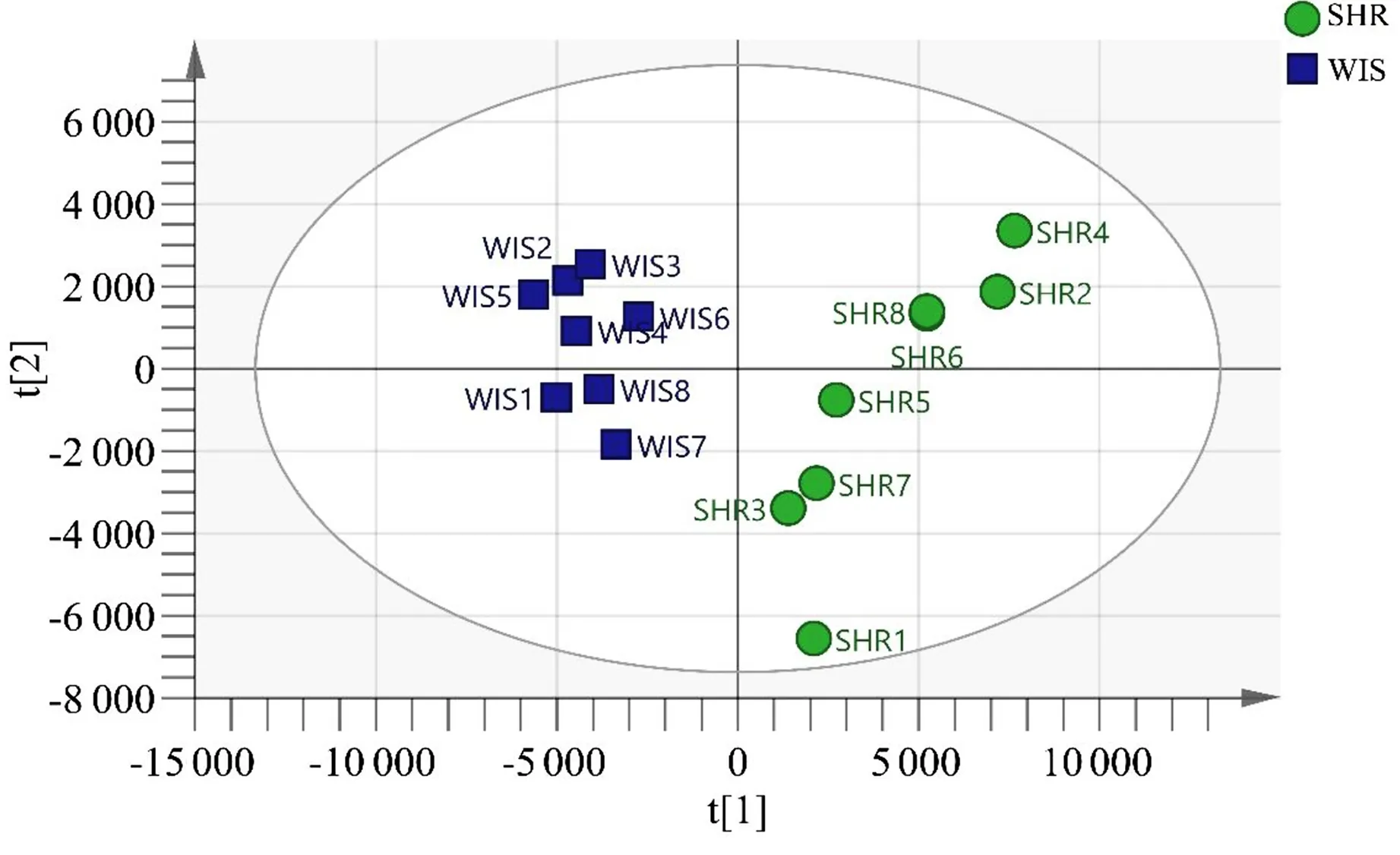
图5 PCA得分散点图(负离子模式)
为了更好地验证两组大鼠血浆样本分离情况,对SHR组和Wisar组数据进行OPLS-DA分析(见图6、图7)。在OLPS-DA分析中两组大鼠血浆样本分离程趋势更加明显,正离子模式R2X=0.947,R2Y=0.999,Q2=0.777,负离子模式R2X=0.78,R2Y=0.998,Q2=0.879,证明该模型可靠。
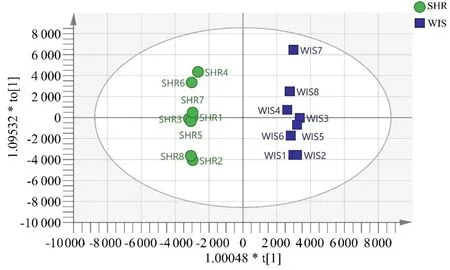
图6 OPLS-DA得分散点图(正离子模式)
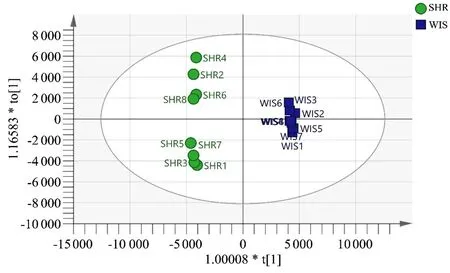
图7 OPLS-DA得分散点图(负离子模式)
在OPLS-DA模型分析中获得SHR和Wistar大鼠S-Plot载荷图(见图8、图9)。载荷图中每一个位点代表一个变量,为造成SHR和Wistar大鼠差异的内在分子。变量的重要程度由VIP值决定,离中心越远的位点其VIP值越大,根据VIP值的大小筛选出差异性变量,VIP值大于1的变量可能为潜在生物标记物。
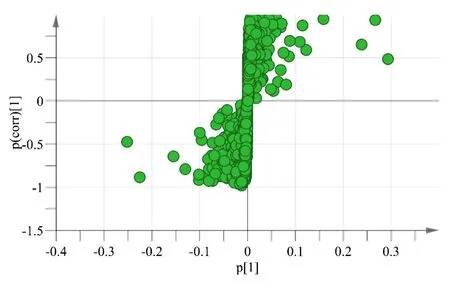
图8 S-Plot载荷图(正离子模式)
图9 S-Plot载荷图(负离子模式)
2.3 差异性代谢物的鉴定 血浆样本中共鉴定出差异性代谢物13种。详见表1。
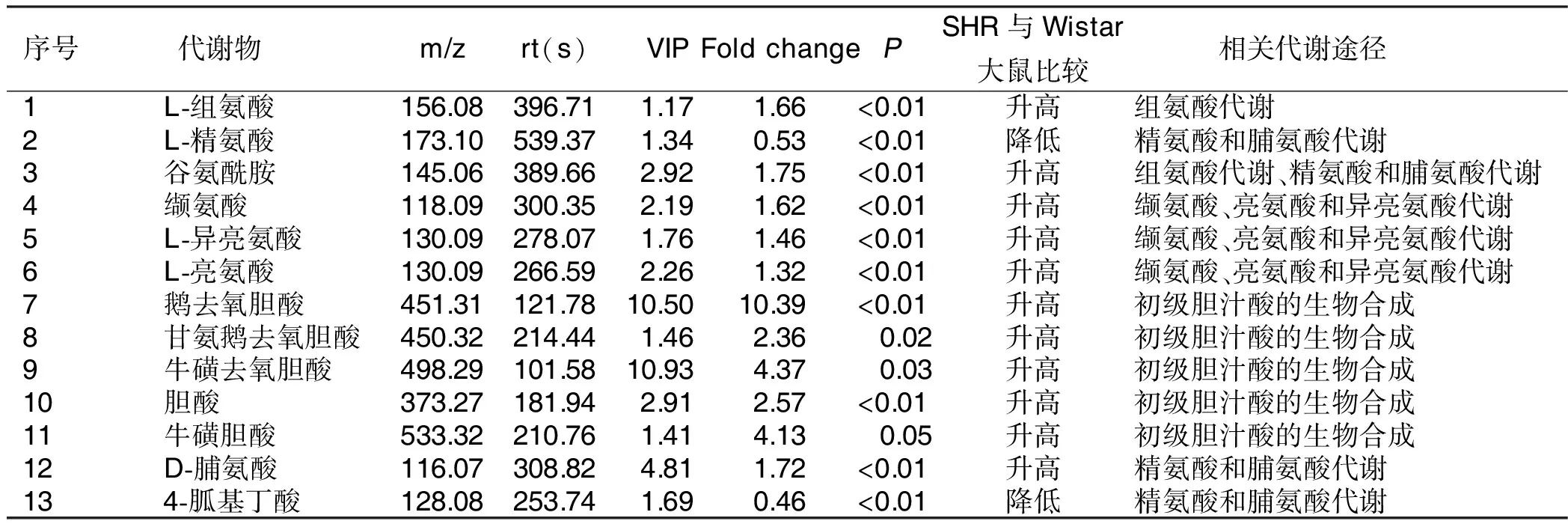
表1 SHR与Wistar大鼠血浆样本中差异性代谢物情况
2.4 潜在代谢通路分析 利用Metabo Analyst数据库及KEGG数据库进行处理分析,选取P<0.05的代谢通路,其中涉及缬氨酸、亮氨酸和异亮氨酸代谢、初级胆汁酸的生物合成、组氨酸代谢、精氨酸和脯氨酸代谢这4种代谢途径。各途径及其相关差异性代谢物见表2,差异性代谢物及相关代谢通路见图10。

表2 各代谢途径及涉及的代谢物
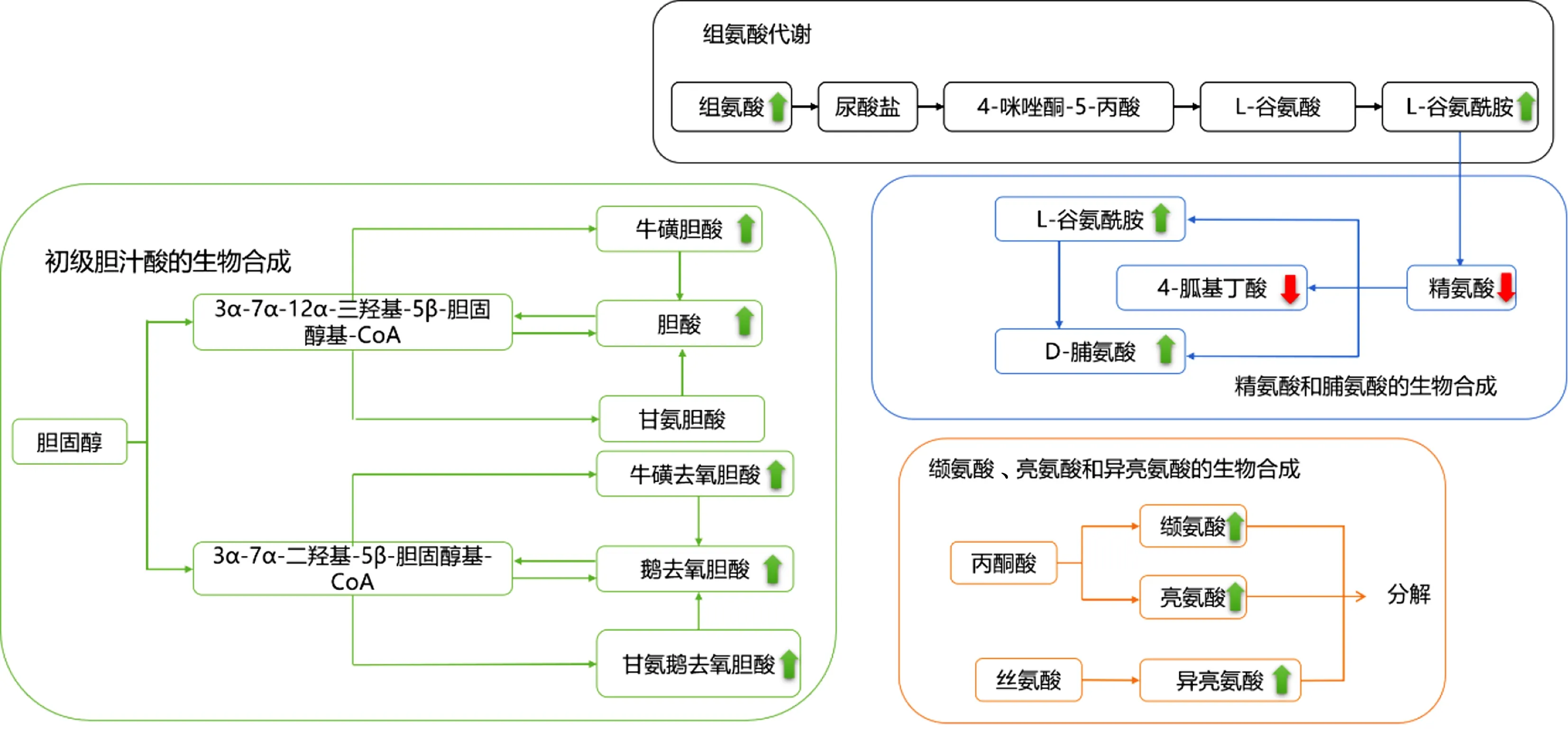
图10 相关代谢通路
3 讨 论
缬氨酸、异亮氨酸和亮氨酸是支链必需氨基酸。这3种氨基酸对人类生活至关重要,主要作用于修复机体肌肉,控制血糖,并给身体组织提供能量[3]。一项前瞻性研究显示,过高的支链必需氨基酸(特别是缬氨酸)的摄入与高血压发病率有较高关联[4],过量的缬氨酸、异亮氨酸和亮氨酸累积会抑制葡萄糖代谢,导致胰岛素抵抗[3]。而胰岛素抵抗可以通过几种机制来升高血压:肾吸收钠增加,交感神经系统的激活,促进成纤维细胞增殖和血管平滑肌细胞合成[5]。反之,高血压通过改变胰岛素和葡萄糖向骨骼肌细胞的输送,导致葡萄糖摄取受损,加剧胰岛素抵抗。L-亮氨酸还可以抑制内皮细胞中L-精氨酸的一氧化氮(NO)合成,6-果糖磷酸氨基转移酶(GFAT)是合成葡萄糖胺(一种抑制内皮细胞合成NO的抑制剂)中的一种速率控制酶。L-亮氨酸通过增强GFAT蛋白表达,从而抑制内皮细胞中的NO合成[6]。本实验中SHR血浆内缬氨酸、L-异亮氨酸、亮氨酸相对含量较高与该研究具有一致性,推测SHR的血压升高或与缬氨酸、L-异亮氨酸和L-亮氨酸的过量堆积导致的胰岛素抵抗及L-亮氨酸抑制NO的合成有关。
L-精氨酸是一种在体内具有多种功能的氨基酸。可用于生成NO、肌酸、L-谷氨酸和L-脯氨酸等化合物[7]。L-精氨酸是合成NO的唯一底物[8],而NO通过扩张血管、抑制血管平滑肌增殖等作用降低血压[9]。精氨酸酶会诱导L-精氨酸分解为鸟氨酸,在病理生理状态下,例如高血压和缺血性再灌注等,内皮精氨酸酶活性增加,促进L-精氨酸分解为鸟氨酸,降低L-精氨酸浓度,进一步导致内皮功能障碍[10]。实验结果表明SHR的L-精氨酸含量低于Wistar大鼠,提示精氨酸的缺乏可能是EH发展的原因之一。
L-谷氨酰胺是精氨酸和脯氨酸代谢中的重要底物。L-谷氨酰胺通过诱导血红素加氧酶-1、热休克蛋白和谷胱甘肽表达在循环中发挥抗氧化和抗炎作用,也可作为L-精氨酸的前体促进NO合成[11]。L-组氨酸是组胺和肌肽生物合成的前体,通过脂肪细胞中的核转录因子-κB(NF-κB)途径抑制促炎性细胞因子的表达[12]。本实验中SHR的组氨酸含量高于Wistar大鼠,提示SHR可能处于炎症状态,SHR中L-谷氨酰胺含量高于Wistar大鼠,并且L-精氨酸含量较低,推测SHR存在以L-谷氨酰胺为前体的L-精氨酸合成障碍。
胆汁酸分为初级胆汁酸和次级胆汁酸。初级胆汁酸是肝细胞以胆固醇为原料直接合成的胆汁酸,包括胆酸、鹅去氧胆酸及相应结合型胆汁酸,次级胆汁酸是初级胆汁酸随胆汁进入肠道,由肠道菌酶催化,经去结合反应,脱去羟基转化而成[13]。鹅去氧胆酸、甘氨鹅去氧胆酸、牛磺去氧胆酸、胆酸、牛磺胆酸都属于初级胆汁酸。胆汁酸是生理性清洁剂,促进脂类的消化吸收,抑制胆汁中胆固醇的析出,调节胆汁流量和脂质分泌,对于膳食脂肪和维生素的吸收必不可少[14]。胆汁酸是11β-羟化固醇脱氢酶Ⅱ型的内源性抑制剂,当胆汁酸代谢发生障碍反流入血,抑制11β-羟化固醇脱氢酶Ⅱ型活性,导致皮质醇激活盐皮质激素受体,引发钠潴留,促进高血压发展[15-16],在临床研究中也发现,高血压病人总胆汁酸水平在服用不同降压药物(氨氯地平和吲达帕胺)后均显著降低[17],而高血压病人总胆汁酸水平相对正常人群较高[18]。本实验结果显示,鹅去氧胆酸、甘氨鹅去氧胆酸、牛磺去氧胆酸、胆酸、牛磺胆酸含量在SHR中均高于Wistar大鼠,可能是因为初级胆汁酸合成过多或者次级胆汁酸合成障碍导致胆汁酸代谢障碍,反流入血以致总胆汁酸水平升高,导致血压升高。
本实验考察早期SHR和Wistar大鼠的血浆代谢物差异,为参与高血压早期阶段的主要代谢物及通路提供初步依据。
