正交设计优化胆膏中胆汁酸的提取工艺
2021-02-22林柏良邓生菊彭健波于美玲王冬英何家康
纪 敏 ,林柏良 ,邓生菊 ,彭健波 ,杜 玮 ,于美玲,王冬英 ,何家康 ,2
(1.广西大学动物科学技术学院,南宁 530004;2.广西兽药制剂工程技术研究中心,南宁 530003;3.广西北斗星动物保健品有限公司,南宁 530003)
动物胆膏是一味使用历史悠久的传统中药材,具有良好的清肝明目、通便解毒、止咳平喘等功效,毒副作用较小,资源丰富且价格低廉[1-3]。国内许多人用中成药、兽用中成药以胆膏与其他中药配制动物胆膏,对风热感冒、肺热咳嗽、热痢、粪便燥结等各种热性病有较好的疗效[4-6]。大量研究表明,动物胆膏的主要化学成分为胆汁酸类,包括水溶性结合型胆酸和脂溶性游离型胆酸[7]。胆汁酸主要包括胆酸、鹅去氧胆酸以及猪去氧胆酸等,这几种胆汁酸都具有广阔的市场发展前景,主要存在于畜、禽胆膏中,一般都以天然提取方式得到[8,9]。传统上中国曾采用乙醇提取法,但此法提取过程较单一,需要多次重复水解、提取、结晶等处理步骤,而且需要使用大量的易燃易爆有机溶剂,且乙醇回收率低,生产周期较长,经济效益不高。还有采用酸沉淀法[10]和盐析法[11]提取粗胆汁酸,也存在提取工艺繁琐、生产周期长等工艺缺陷。为了综合开发利用动物胆膏,廉价高效地得到这几种胆汁酸,使其更好地发挥药用价值和功效,本研究以猪胆膏为试验原料,经单因素筛选后选取1∶1盐酸用量、NaOH用量和纯化时间为考察因素,采用L9(34)正交设计法优化胆膏中胆汁酸的提取工艺,以期建立工艺简单、对环境无污染、高含量、高收率的生产工艺,最终符合工业化生产的需求。
1 材料与方法
1.1 药品与试剂
猪胆膏(批号为20171002),购自泰安广鑫生物科技有限公司;猪去氧胆酸对照品(批号为100087-201610)、鹅去氧胆酸对照品(批号为 110806-201606),均购自中国食品药品检定研究院;甲醇、乙酸均为色谱纯,乙酸乙酯、盐酸均为国产分析纯,购自美国Fisher公司。
1.2 主要仪器
高效液相色谱仪(LC-20A)、自动进样器(SIL-20A),均购自日本岛津制作所;电子分析天平(BP211D),购自德国赛多利斯集团;超声波仪(B3200S-T),购自必能信超声上海有限公司;蒸发光散射检测器(Alltech ELSD 3300),购自美国格雷斯奥泰公司;Waters Symmetry C18色谱柱(4.6 mm×250.0 mm,5 μm),购自北京金欧亚科技发展有限公司;雷磁酸度计,购自上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 酸碱纯化提取法工艺流程 以10 g胆膏为原料,将胆膏敲碎,加入适量去离子水加热搅拌使之完全溶解,冷却,加入适量1∶1盐酸,搅拌均匀,静置纯化一定时间,过滤取沉淀,加入适量去离子水,加入适量固体氢氧化钠,溶解完全后,板框4层滤纸过滤,即得胆膏纯化液。
1.3.2 正交设计优化提取工艺 经单因素筛选后,选择1∶1盐酸用量、NaOH用量、纯化时间3个因素,每个因素分3个水平,因素水平如表1所示。精密称取9份胆膏,每份10 g,根据L9(34)正交试验设计分别进行纯化提取、过滤,加去离子水定容至100mL,测定胆膏纯化液中鹅去氧胆酸和猪去氧胆酸的含量。

表1 正交试验因素与水平
1.3.3 胆膏的含量测定
1)色谱条件。Waters Symmetry C18色谱柱(250.0 mm×4.6 mm,5 μm),以十八烷基硅烷键合硅胶为填充剂;流动相为0.1%冰乙酸∶乙腈=50∶50;流速为1 mL/min;检测器为蒸发光散射检测器;进样量为对照品溶液 5、10 μL,供试品溶液 10 μL;理论板数按猪去氧胆酸峰计算应不低于7 000。
2)对照品溶液的制备。取猪去氧胆酸对照品和鹅去氧胆酸对照品适量,精密称定,加甲醇制成每1 mL含猪去氧胆酸和鹅去氧胆酸0.625 mg的溶液,备用。
3)供试品溶液的制备。精密量取本品续滤液10 mL,置于50 mL锥形瓶中,加NaOH溶液10 mL,用牛皮纸将瓶口密封,置于立式灭菌锅中,120℃,103 kPa,加热 4 h,冷却至室温,用 HCl调节 pH至6~7,移至100 mL容量瓶中,用甲醇稀释至刻度,摇匀,过滤,弃去初滤液,取续滤液作为供试品溶液。
1.4 胆汁酸含量测定方法学考察
1.4.1 标准曲线线性范围试验 分别精密量取猪去氧胆酸和鹅去氧胆酸对照品溶液 2、3、4、5、10 mL至10 mL容量瓶中,用甲醇稀释至刻度,即可。按“1.3.3”色谱条件下进样检测,以猪去氧胆酸和鹅去氧胆酸对照品浓度(mg/mL)的对数x为横坐标,峰面积的对数y为纵坐标,分别绘制猪去氧胆酸和鹅去氧胆酸的标准曲线。
1.4.2 精密度试验 精密吸取猪去氧胆酸和鹅去氧胆酸对照品溶液各 10 μL,按“1.3.3”色谱条件重复进样6次,记录各峰面积,计算方法的精密度。
1.4.3 重复性试验 精密量取样品6份,按“1.3.3”方法制得供试品溶液,并进行高效液相色谱法(HPLC)检测。
1.4.4 稳定性试验 精密量取样品,按“1.3.3”方法制得供试品溶液,分别于 0、2、4、6、8、10、12 h 后,进行含量检测,考察供试品溶液的稳定性。
1.4.5 加样回收率试验 精密量取已知含量的胆膏纯化液10 mL,置于100 mL容量瓶中,加去离子水稀释至刻度线,精密量取5 mL,每份加入猪去氧胆酸和鹅去氧胆酸对照品溶液各2.5 mL,平行6份,混匀后按“1.3.3”方法制得供试品溶液,并进行进样检测,计算猪去氧胆酸和鹅去氧胆酸的回收率。
1.5 乙醇纯化工艺流程
将胆膏敲碎,精密称取胆膏10 g,加入适量去离子水溶解并加热煮沸后制得胆膏水溶液,冷却后加入5倍95%乙醇,搅拌过夜,过滤,收集滤液。回收乙醇后制得浓胆膏液,再加入5倍95%乙醇,搅拌过夜,过滤,收集滤液,回收乙醇后制得胆膏纯化液。加去离子水定容至100 mL。测定胆膏纯化液中猪去氧胆酸和鹅去氧胆酸的含量。
1.6 验证试验
取同一批次胆膏提取物,精密称取6份,每份10 g,分别按乙醇纯化工艺和酸碱纯化工艺最佳条件纯化,纯化液按同样方法处理,分别测得总胆酸含量。采用SPSS 21.0软件,以t检验比较2种提取工艺测量结果间的差异。
2 结果与分析
2.1 酸碱纯化工艺正交试验
采用正交试验分别测得9次试验样品中鹅去氧胆酸和猪去氧胆酸的含量,结果见表2。采用SPSS 21.0软件进行方差分析,结果见表3。
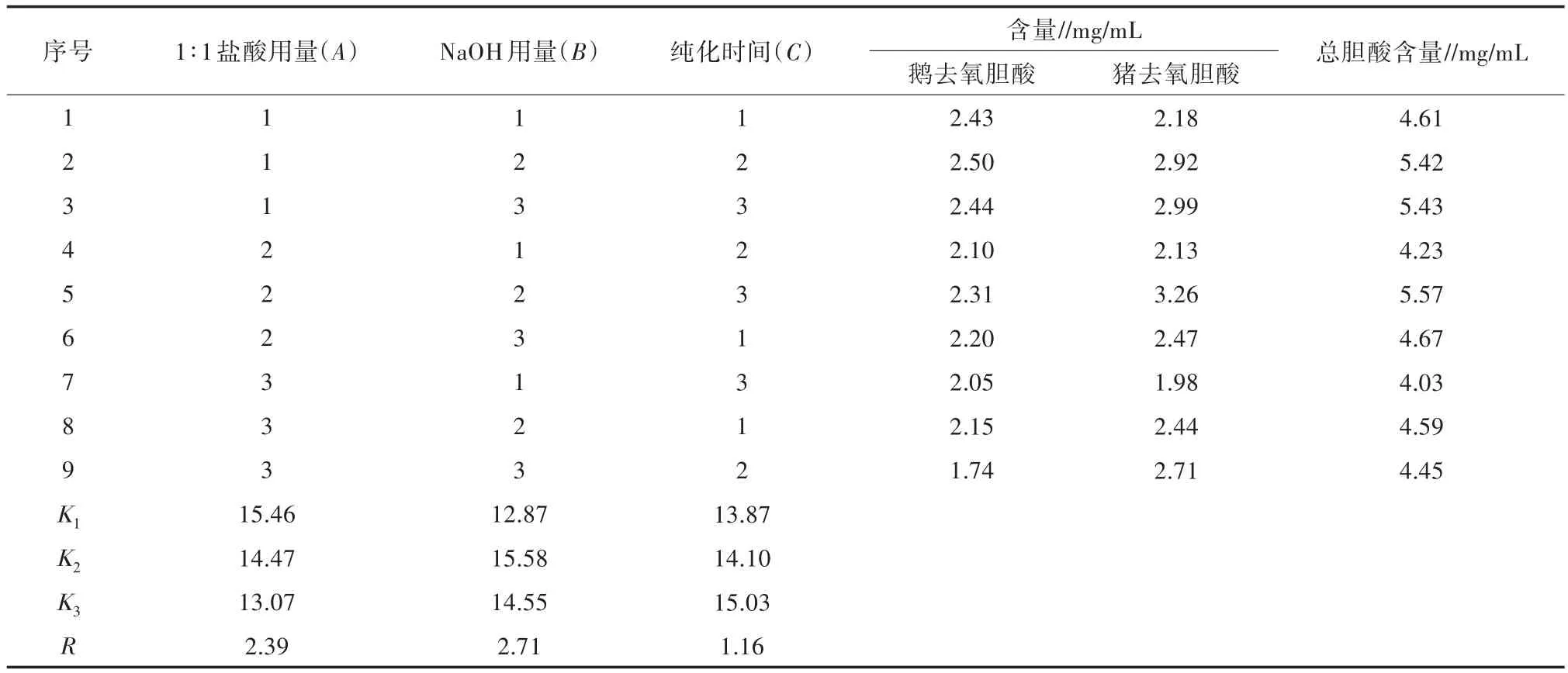
表2 酸碱纯化工艺正交试验结果
对正交试验结果进行直观分析,由极差R分析可知,影响最佳提取工艺的因素顺序为B>A>C,即NaOH用量>1∶1盐酸用量>纯化时间,初步确定最佳提取工艺组合为A1B2C3。由表3方差分析可知,1∶1盐酸用量(A)与 NaOH 用量(B)对总胆酸含量测定有显著的影响(P<0.05),纯化时间(C)与总胆酸含量测定无显著相关性(P>0.05)。综合直观分析与方差分析的结果,同时考虑省时、经济、节能,最后确定最佳工艺组合为A1B2C3,即10 g胆膏加入适量水溶化,加入 1∶1盐酸 4 mL沉淀,纯化时间 12 h,然后加入适量去离子水,加入氢氧化钠0.2 g,溶解过滤即可。
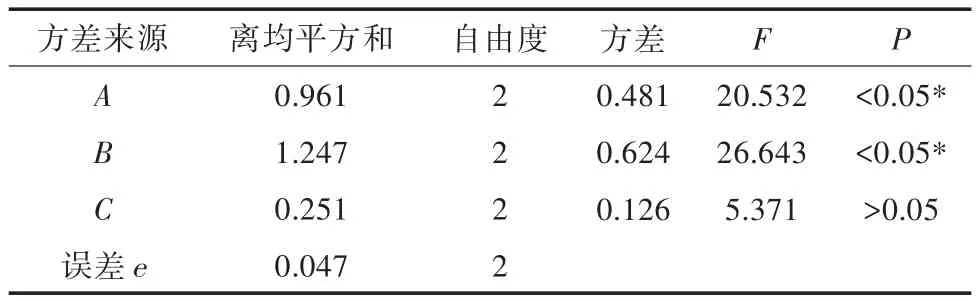
表3 方差分析结果
2.2 猪去氧胆酸和鹅去氧胆酸的含量测定
分别精密吸取猪去氧胆酸对照品溶液、鹅去氧胆酸对照品溶液、供试品溶液10 μL,注入高效液相色谱仪,测定峰面积,计算含量。鹅去氧胆酸对照品、猪去氧胆酸对照品、供试品、阴性样品对照高效液相色谱见图1。
将图1A、图1B和图1C比较可知,鹅去氧胆酸对照品的保留时间为13.506 min,猪去氧胆酸对照品的保留时间为7.213 min,供试品中鹅去氧胆酸的保留时间为13.614 min,猪去氧胆酸的保留时间为7.190 min。由图1可见,供试品中的鹅去氧胆酸、猪去氧胆酸与鹅去氧胆酸对照品、猪去氧胆酸对照品的保留时间、高度和面积基本一致,且HPLC色谱图峰形良好,无杂质干扰测定,具有较高的特异性,表明分析条件可行。
2.3 猪去氧胆酸和鹅去氧胆酸含量测定方法考察结果
以对照品浓度的对数x为横坐标、峰面积的对数y为纵坐标得猪去氧胆酸与鹅去氧胆酸的回归方 程 ,分 别为y=1.689 2x+5.570 2,R2=0.999 7;y=1.663 2x+5.502 9,R2=0.999 8。猪去氧胆酸和鹅去氧胆酸在0.125~0.625 mg/mL线性关系良好;精密度、重复性、稳定性结果的相对标准偏差(RSD)分别为猪去氧胆酸 0.56%、0.68%、0.71%,鹅去氧胆酸0.70%、0.85%、0.66%;猪去氧胆酸、鹅去氧胆酸的加样回收率分别为99.51%和100.17%,RSD分别为0.75%和0.65%,表明本方法可行。
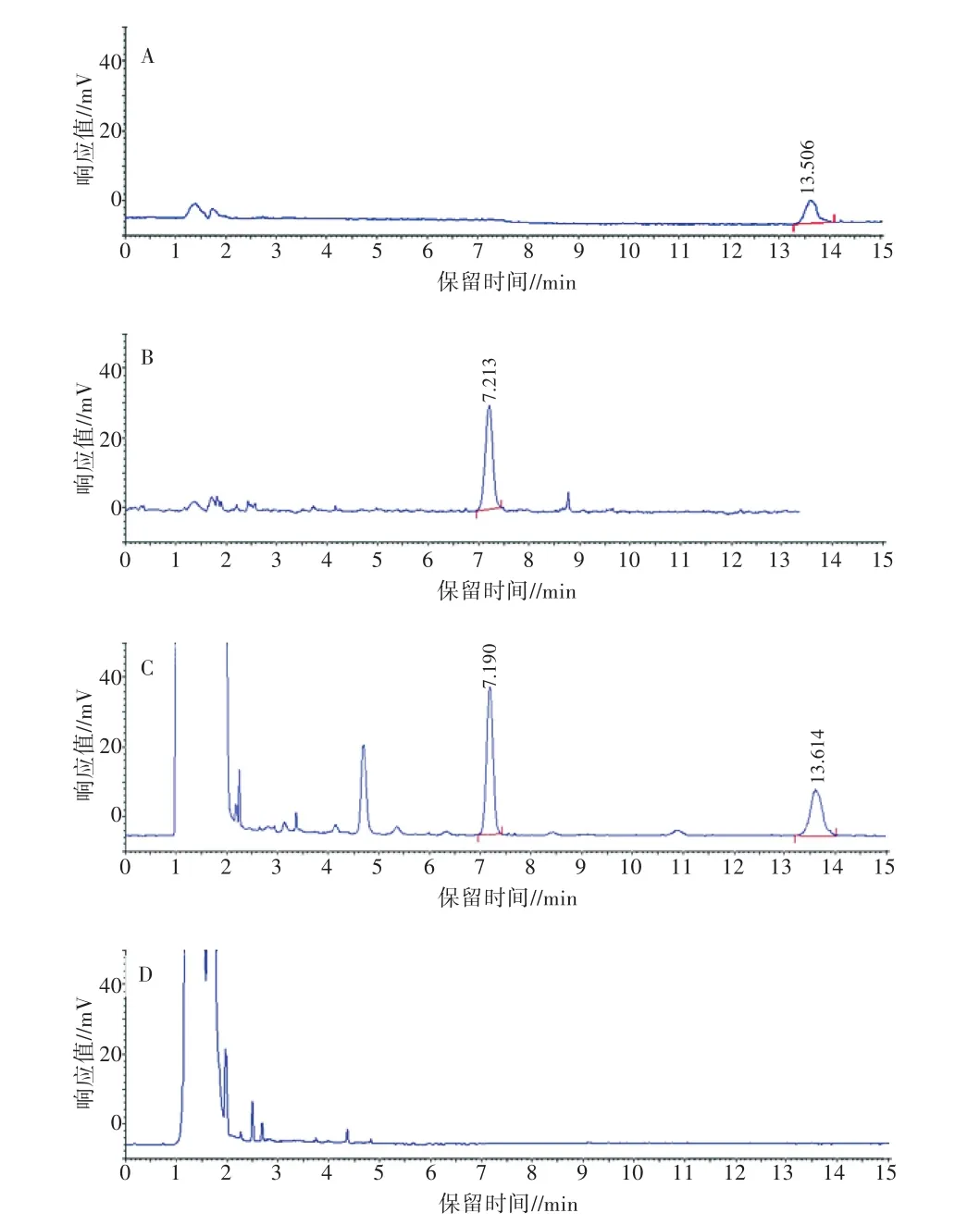
图1 高效液相色谱
2.4 验证性试验
按乙醇纯化和酸碱纯化最佳工艺条件A1B2C3纯化得到胆膏纯化液中总胆酸含量的测定结果(表4)。采用SPSS 21.0统计分析软件进行独立样本t检验,结果2种提取纯化工艺所得胆膏纯化液中总胆酸含量无显著差异(P>0.05),表明2种提取工艺的提取效果相似。

表4 不同工艺提取纯化总胆酸含量测定结果(x±s,n=3)
3 小结与讨论
随着人类对天然甾体类化合物的深入研究,从胆膏中提取分离胆汁酸的工艺研究是胆膏研究的热点之一[12]。目前,国内外主要以猪胆汁(膏)为原料提取鹅去氧胆酸或猪去氧胆酸等胆汁酸类[13]。主要通过钙盐沉淀法、钡盐沉淀法[14]、结晶提取法和离子交换树脂法[15]等提取鹅去氧胆酸,然而这几种方法产品回收率低,纯度也不高。对于猪去氧胆酸的提取,主要采用乙酸乙酯分离法[16],也有采用甲醇-水重结晶法[17]、乙醇-水重结晶法、丙酮重结晶法[18]或层析柱法对乙酸乙酯提取物进行纯化,但这些提取方法不仅需要消耗大量的有机溶剂,安全性能差,而且生产周期长,产品回收率低,不能规模化生产。
本研究通过酸碱纯化工艺提取纯化猪胆膏中的胆汁酸,最佳提取工艺为A1B2C3,即在1∶1盐酸用量4 mL、NaOH用量0.2 g的条件下纯化时间12 h,所得胆膏纯化液中总胆酸的含量为5.49 mg/mL;而乙醇纯化工艺提取纯化的胆膏纯化液中总胆酸的含量为5.50 mg/mL。对比这2种提取纯化方法,发现胆膏纯化液中总胆酸的含量无显著差异,且按《中国人民共和国兽药典》2015年版注射液有关物质项下检查纯化液中的蛋白质、鞣质、树脂等项目,均符合要求[19]。在制备过程中,受热时间过长会导致胆膏的某些有效成分损失[20],酸碱纯化工艺的作用机理是利用结合型总胆酸在酸性环境下不溶于水的性质,采用酸化代替乙醇提取,减少加热次数,提高胆膏中胆汁酸的提取率[21]。何姣等[22]将猪胆汁乙醇浸提和层析柱分离纯化后,再使用有机溶剂洗脱、烘干得到猪胆汁结合型总胆酸,但提取工艺手续繁杂,大量使用多种有机溶剂,结合型总胆酸的回收率低,成本高。胆膏纯化后所得的结合型总胆酸溶液不必经过浓缩和干燥,可直接用于注射液的配制,同时溶液中含有的牛磺酸具备良好的清热解毒作用,常用作制备人工牛黄,经碱皂化水解后就会损失此种药理价值[23]。相比之下,本研究建立的酸碱纯化工艺操作简单,纯化时间明显缩短,并且不使用易燃易爆有机溶剂。由此可见,酸碱纯化工艺在实用性以及经济性上均明显优于传统的乙醇纯化工艺,不仅符合绿色生产的工业化要求,而且还能提高生产效率和生产效益,故推荐选择酸碱纯化工艺作为胆膏中胆汁酸的提取纯化方法。
