L-色氨酸发酵中的细胞循环工艺研究
2021-09-28刘晓东滕佳佳
李 静,刘晓东,滕佳佳
(河南巨龙生物工程股份有限公司,河南 汝州 467599)

在研究中,将生物发酵罐与在线灭菌碟片式分离机相偶联,考察4种细胞循环策略对L-色氨酸的影响,筛选适宜的L-色氨酸细胞循环发酵策略。同时,基于细胞与色氨酸分子合成的线性关系分析,阐明了细胞循环策略对L-色氨酸合成的作用机理。
1 材料与方法
1.1 实验材料
1.1.1 菌 株
E.coliJLT-01,由公司菌种保藏室提供。
1.1.2 培 养 基
一级种子培养基(质量浓度):葡萄糖30 g/L,酵母粉15 g/L,K2HPO4·3H2O 24 g/L,KH2PO49.6 g/L,(NH4)2SO45 g/L,MgSO4·7H2O 1 g/L,盐酸四环素0.02 g/L。
二级种子培养基(质量浓度):葡萄糖20 g/L,酵母粉7.5 g/L,KH2PO41.5 g/L,KCl 1.9 g/L,(NH4)2SO44 g/L,MgSO4·7H2O 3.15 g/L,FeSO4·7H2O 0.075 6 g/L。
发酵培养基(质量浓度):葡萄糖10 g/L,酵母浸粉1 g/L,KH2PO41.5 g/L,KCl 1.9 g/L,(NH4)2SO44 g/L,MgSO4·7H2O 3.15 g/L,FeSO4·7H2O 0.075 6 g/L。
1.1.3 主要仪器
10 L和50 L全自动发酵罐,上海迪必尔生物设备工程有限公司;SBA-40E生物传感仪,山东科学院生物研究所;pH及溶氧电极,METTLER;Agilent 1200高效液相色谱仪,Agilent Technologie;GEA Westfalia Separator HSD 1-06-107在线蒸汽灭菌碟片式分离机,Oelde Deutschland。
1.2 培养方法
1.2.1 一级种子培养
挑取L-色氨酸平板菌苔悬浮于装有50 mL培养基的三角瓶中,温度36 ℃,转速200 r/min,培养时间8 h。
1.2.2 二级种子培养
将一级种子液接种于装有3 L种子培养基的10 L发酵罐中,发酵罐温度35 ℃,pH 7.0,调节通风量及搅拌转速将溶氧水平维持在20%,培养12 h,作为二级种子。
1.2.3 发酵培养
按照10%的接种量将二级种子液接种于装有18 L发酵培养基的50 L发酵罐中,培养温度为36 ℃,pH利用流加氨水维持在7.0(0~20 h)和6.5(20~40 h),通过调节通风量及搅拌转速将溶氧水平维持在20%。当初始葡萄糖耗尽时,采用溶氧反馈控制补料策略流加葡萄糖溶液,培养40 h。
将发酵罐与碟片式分离机相偶联,发酵罐中的培养液进入碟片式分离机,经离心后,上清液排出发酵系统(上清液的体积与葡萄糖溶液补加的体积相等),浓缩液重新回到发酵罐中。实验流程如图1所示。

图1 细胞循环生物反应器示意图Fig.1 Cell recycling bio-reactor
1.2.4 分析方法

1.3 动力学参数分析
每个实验3个平行,且求其数据的平均值,并用“±”表示数据的标准误差。利用Origin 8.0对数据进行显著性分析,显著性误差为P<0.05.
2 结果与讨论
2.1 不同细胞循环策略对生物量及L-色氨酸产量的影响
基于L-色氨酸发酵中的细胞增殖及L-色氨酸合成分析,将4种细胞循环策略应用于L-色氨酸发酵。策略Ⅰ:V(上清液)∶V(浓缩液)=1∶1,细胞循环周期为20~26 h;策略Ⅱ:V(上清液)∶V(浓缩液)=1∶1,细胞循环周期为24~30 h;策略Ⅲ:V(上清液)∶V(浓缩液)=1.5∶1,细胞循环周期为20~26 h;策略Ⅳ:V(上清液)∶V(浓缩液)=1.5∶1,细胞循环周期为24~30 h。利用细胞循环策略发酵L-色氨酸,细胞生物量及L-色氨酸产量如图2所示。
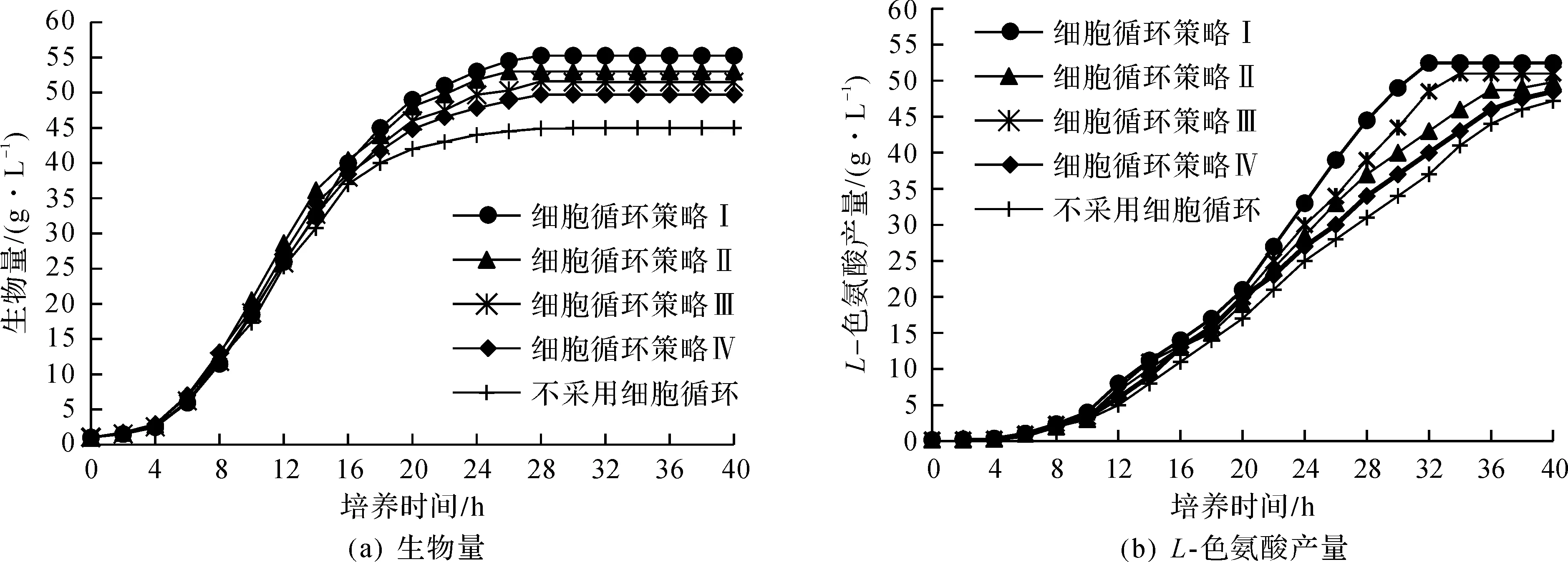
图2 细胞循环策略对生物量及L-色氨酸产量的影响Fig.2 Effect of cell recycle strategy on biomass and production of L-tryptophan
由图2可知:应用细胞循环策略,可提高生物量及L-色氨酸产量,且在细胞循环周期内,生物量及L-色氨酸产量显著提高。由L-色氨酸产量及L-色氨酸合成速率得出,采用策略Ⅰ~Ⅳ的发酵周期分别为32,36,34,38 h。细胞循环周期为20~26 h时的生物量及L-色氨酸产量均高于循环周期24~30 h;采用策略Ⅰ所得到的生物量及L-色氨酸产量最高分别为55.26,52.45 g/L,较未采用细胞循环分别提高了17.01%,10.58%。
2.2 不同细胞循环策略对发酵副产物乙酸及谷氨酸积累量的影响
乙酸及谷氨酸为L-色氨酸发酵中的主要副产物,且副产物的积累降低了L-色氨酸的合成效率。因此,控制乙酸及谷氨酸积累量是实现E.coli高密度培养的关键因素。在L-色氨酸细胞循环发酵过程中,乙酸及谷氨酸积累量如图3所示。

图3 细胞循环策略对乙酸及谷氨酸积累量的影响Fig.3 Effect of cell recycle strategy on accumulations of acetate and glutamate
由图3可知:应用细胞循环策略,可显著降低乙酸积累量及谷氨酸生成量。采用策略I时,乙酸(0.87 g/L)及谷氨酸(3.24 g/L)积累量最低,较未采用细胞循环分别降低了26.89%,41.51%;采用策略Ⅱ~Ⅳ的乙酸与谷氨酸积累量分别为0.98 g/L与3.47 g/L,0.93 g/L与3.62 g/L,1.02 g/L与3.73 g/L。
2.3 不同细胞循环策略时对浓度及糖酸转化率的影响


图4 细胞循环策略对浓度及糖酸转化率的影响Fig.4 Effect of cell recycle strattegy on concentration of and glucose conversion rate
2.4 细胞循环策略下细胞量有序控制的L-色氨酸高效合成
2.4.1 发酵过程中细胞增量与L-色氨酸合成分析
基于L-色氨酸发酵过程中细胞生物量干质量与活菌数目的测定,1 g菌体(干质量)含有2.11×1010个细胞;且1 molL-色氨酸中含有6.02×1023个色氨酸分子。结合发酵过程中生物量及L-色氨酸产量的测定,计算利用细胞循环策略(细胞循环策略Ⅰ及Ⅲ)在培养周期20~26 h的细胞增量与L-色氨酸合成分子数的关系如图5所示。
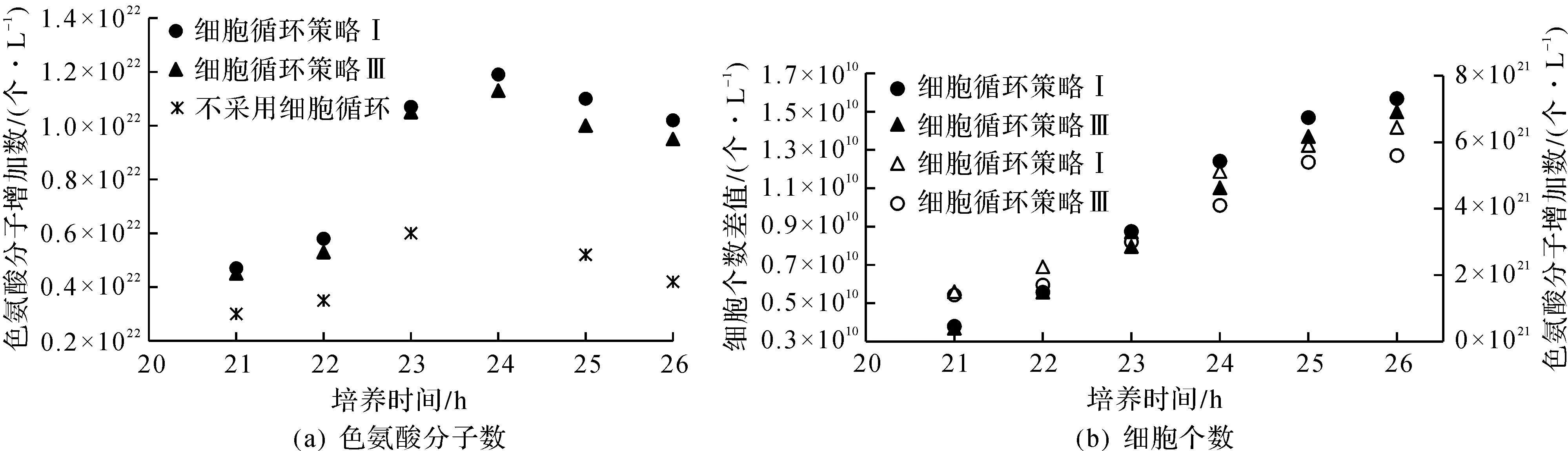
图5 细胞循环策略对细胞增量及L-色氨酸合成分子数的影响Fig.5 Effect of cell recycle strattegy on increment of cell amount and moleculus of L-tryptophan
由图5可知:与未采用细胞循环策略相比,采用细胞循环策略可以提高的细胞利用率增加L-色氨酸合成,细胞循环策略Ⅰ的细胞增量及L-色氨酸合成分子数增量均大于细胞循环策略Ⅲ,则表明细胞循环策略I的生物量及L-色氨酸增量均高于细胞循环策略Ⅲ。
3 结 论

