酶解豆渣工艺及其在黄原胶发酵中的应用
2021-09-28李学朋陈晓妮张培鑫
李学朋,陈晓妮,刘 超,张培鑫,徐 娜,周 敬
(1.内蒙古阜丰生物科技有限公司,内蒙古 呼和浩特 010030;2.内蒙古自治区生物发酵节能环保技术企业重点实验室,内蒙古 呼和浩特 010030)
黄原胶生产过程的副产物豆渣,具有水分大、不耐储藏和运输成本高等特性,造成豆渣的利用率低,只可作为饲料进行出售,产品的附加值低。近年来,随着人们对生态环境的重视及检测水平的提高,对豆渣的研究不断深入,对豆渣的认识更加清楚,对豆渣的再利用也有了新的方法。目前,豆渣再利用研究主要集中在豆渣食品方向,如将豆渣添加到面制食品中,可以改善面制食品的口感,豆渣中的大豆膳食纤维提取后,可以生产膨化食品。研究发现:作为副产物的豆渣中仍含有丰富的营养物质,如蛋白质、膳食纤维、碳水化合物和维生素等,将豆渣中的营养物质进行再利用,既可以减少生产成本,又可以降低对环境的影响。酶法提取大豆蛋白条件最为温和[1-4],对营养成分的破坏性小,又有利于产物在发酵中的再次应用,因此本实验旨在回收豆渣中的大豆蛋白,并回用于黄原胶发酵[5-7]。
1 材料与方法
1.1 材料与仪器
1.1.1 实验原料
副产物,由内蒙古阜丰生物科技有限公司黄原胶车间生产;黄原胶发酵原料淀粉乳,由内蒙古阜丰生物科技有限公司提供;发酵用黄豆、碳酸钙、硫酸镁以及磷酸氢二钾,由车间生产采购普通市售产品。
1.1.2 实验试剂
氢氧化钠(分析纯)、硫酸(分析纯)、凯氏定氮催化剂,碱性蛋白酶食品级200 kU/g高活力酶制剂,纤维素酶食品级200 kU/g高活力酶制剂。
1.1.3 仪器与设备
K1100全自动凯氏定氮仪,海能未来技术集团股份有限公司;METTLER TOLEDO ME204E分析天平;100 L全自动发酵罐,上海国强生化工程装备有限公司。
1.2 豆渣实验方法
1.2.1 蛋白的提取方法
黄豆作为黄原胶发酵的主要氮源,经过粉碎、过筛,加水105 ℃水解30 min后的产物应用于黄原胶发酵,而过筛产生的豆渣为本项目的实验原料。豆渣和水按照适当比例在酶解罐中混匀,搅拌速度以确保豆渣不沉淀即可。用40 ℃左右温水溶解酶制剂,利用蒸汽保持豆渣混悬液温度稳定在40~60 ℃进行酶解。酶解后通过检测清液含氮量计算蛋白回收率,并将回收的酶解豆渣清液应用于黄原胶发酵。
1.2.2 蛋白的回收率
将酶解后的豆渣混悬液过滤,去除豆渣颗粒,得到酶解豆渣清液。准确称取0.5 g(精确值±0.000 2 g)酶解豆渣清液至凯氏定氮仪配套消化管中,加入凯氏定氮催化剂,及浓硫酸6 mL,400 ℃消解1.5 h,降至室温后使用凯氏定氮仪进行含氮量(质量浓度下同)检测。用同样的方法对酶解前的豆渣混悬液进行含氮量检测,注意取样时保证豆渣混悬液样品均匀性[8-11]。豆渣蛋白收率计算式为

1.2.3 豆渣的料液比
取黄原胶车间生产过程产生的豆渣,按m(豆渣)∶m(水)分别为1∶3,3∶7,7∶13,2∶3的料液比加入自来水中制备1 L料液,按照10%的复合酶添加量(过量的酶),温度50 ℃,酶解6 h。待料液降温后,用60目滤布过滤,并检测清液含氮量,计算豆渣蛋白收率。
1.2.4 酶解条件的单因素
复合酶加入量:在豆渣混悬液实验的基础上,以200 kU/g的碱性蛋白酶食品级和20 kU/g的纤维素酶食品级复合酶(按质量比1∶1混合)作为水解酶,复合酶添加量分别按照0.5%,0.7%,1%,3%,5%,7%,9%的质量比添加混匀后,50 ℃水浴搅拌加热6 h。用60目滤布过滤,并检测清液含氮量,计算豆渣蛋白收率。
酶解时间:在豆渣混悬液实验的基础上,以200 kU/g的碱性蛋白酶食品级和200 kU/g的纤维素酶食品级复合酶作为水解酶,按照复合酶的添加量10%(过量的酶),酶解时间分别为2,3,4,5,6,7,9 h,50 ℃水浴搅拌加热。用60目滤布过滤,并检测清液含氮量,计算豆渣蛋白收率。
酶解温度:在豆渣混悬液实验的基础上,以200 kU/g的碱性蛋白酶食品级和200 kU/g的纤维素酶食品级复合酶作为水解酶,按照复合酶的添加量10%(过量的酶),酶解温度分别为30,35,40,45,50,55,60 ℃,水浴搅拌加热6 h。用60目滤布过滤,并检测清液含氮量,计算豆渣蛋白收率。
1.2.5 酶解条件的优化
为了优化复合酶的水解工艺条件,在单因素实验的基础上,选择加酶量A、酶解时间B和酶解温度C这3因素进行L9(34)正交实验,以确定复合酶水解的最佳工艺条件[12-14]。因素及水平如表1所示。
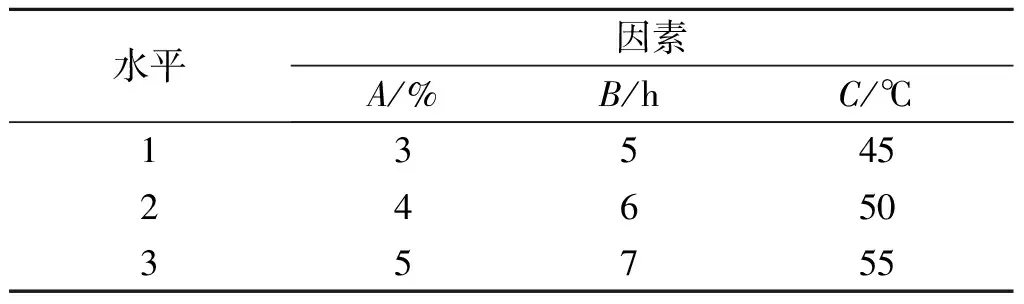
表1 正交实验因素和水平设计
1.2.6 大豆蛋白回收率的检测
取酶解前的豆渣混悬液或酶解后的豆渣清液0.1 g放入消化管中,加入12 mL硫酸后于石墨消解炉上消解2 h,待消化液冷却后利用凯氏定氮仪检测含氮量,并计算大豆蛋白回收率。
1.3 酶解豆渣回用于黄原胶发酵
1.3.1 菌种与原料
菌种为野油菜黄单胞杆菌,由黄原胶车间提供。
1.3.2 黄原胶发酵培养
种子培养基:质量浓度分别为蔗糖10 g/L,蛋白胨8 g/L,酵母粉1 g/L,牛肉浸膏3 g/L;pH 7.2。
发酵培养基:质量浓度分别为大豆水解液5 g/L,玉米淀粉50 g/L,磷酸二氢钾5 g/L,碳酸钙3 g/L,硫酸镁2.5 g/L,柠檬酸0.25 g/L,硫酸亚铁0.25 g/L。根据大豆水解液含氮量,添加不同比例的豆渣回收大豆蛋白,进行黄原胶发酵。回收大豆蛋白占氮源的比例分别设定为0,10%,20%,30%,50%。
种子培养:利用120 L全自动发酵罐进行菌种培养,根据种子培养基配方配置料液,定容50 L,121 ℃恒温灭菌30 min后接种,温度31 ℃,pH 7.0,转速220 r/min培养22 h左右,至OD600值净增10以上。
发酵控制:利用100 L全自动发酵罐进行菌种发酵培养,根据种子培养基配方配制料液,定容40 L,121 ℃恒温灭菌30 min,接种量5%,温度32 ℃,pH 7.0,转速220 r/min培养72 h[15-21]。
1.3.3 产品测定方法
黄原胶产量测定:100 g发酵液中加入2% KCl和2倍体积9%乙醇沉淀黄原胶,取沉淀物60 ℃烘干至恒重。
发酵液黏度测定:用NDJ-1型旋转式黏度计,室温,4号转子,30 r/min下测定。
淀粉乳转化率:淀粉乳转化率=黄原胶产率/淀粉乳添加量。
黄原胶成品流变性检测:取水250 mL,置烧杯中,调节低螺距型搅拌器或磁力搅拌器的转速为800 r/min,边搅拌变缓缓加入本品(按干燥品计)和混合物各3 g,继续搅拌10 min,边搅拌边用水44 mL冲洗烧杯杯壁,停止搅拌,快速振摇烧杯,使烧杯上的颗粒完全浸入溶液中,调节温度至(25±1) ℃。继续以转速为800 r/min搅拌2 h(搅拌过程中可适当旋摇烧杯,以避免样品分层,每次旋摇时间控制在30 s内,如供试品难以混合均匀,可适当延长搅拌时间),作为供试品溶液。取供试品溶液适量,置桶内直径为25 mm,外筒直径为27 mm的同轴圆筒旋转黏度计中,内筒浸入样品的深度为42 mm,以转速为18 r/min或角速度为1.885 rad/s(或选择适宜的测试条件,使剪切速率为24 s-1)依法测定(《中国药典》2020年版通则0633第三法),在温度为25 ℃时的动力黏度应不小于0.6 Pa·s。
2 结果与分析
2.1 料 液 比
料液比对蛋白回收率的影响如图1所示。料液比对豆渣在溶液中的状态有影响,在一定程度上影响豆渣与酶的接触面积。选择m(豆渣)∶m(水)分别为1∶3,3∶7,7∶13,2∶3的料液比加入自来水及过量的酶,由图1可以看出:蛋白回收率在一定范围内,会随着料液比的增加而增加;当料液比大于7∶13时,蛋白回收率随着料液比的增加而下降,故实验选择料液比为7∶13。
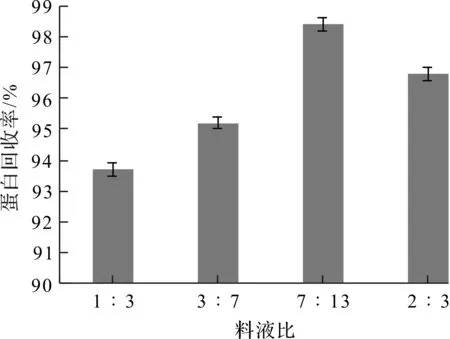
图1 料液比对蛋白提取率的影响Fig.1 Effect of material/liquid ratio on protein yield
2.2 酶解条件
2.2.1 酶加入量
确定照料液比7∶13为最佳料液比后,以200 kU/g的碱性蛋白酶食品级和200 kU/g的纤维素酶食品级复合酶作为水解酶,酶添加量分别按照0.5%,0.7%,1%,3%,4%,5%,7%,9%的比例添加混匀,加酶量对蛋白回收率的影响如图2所示。由图2可以看出:随着酶添加量的提高,蛋白回收率也提高;当酶的添加量大于4%时,蛋白回收率增加不明显。
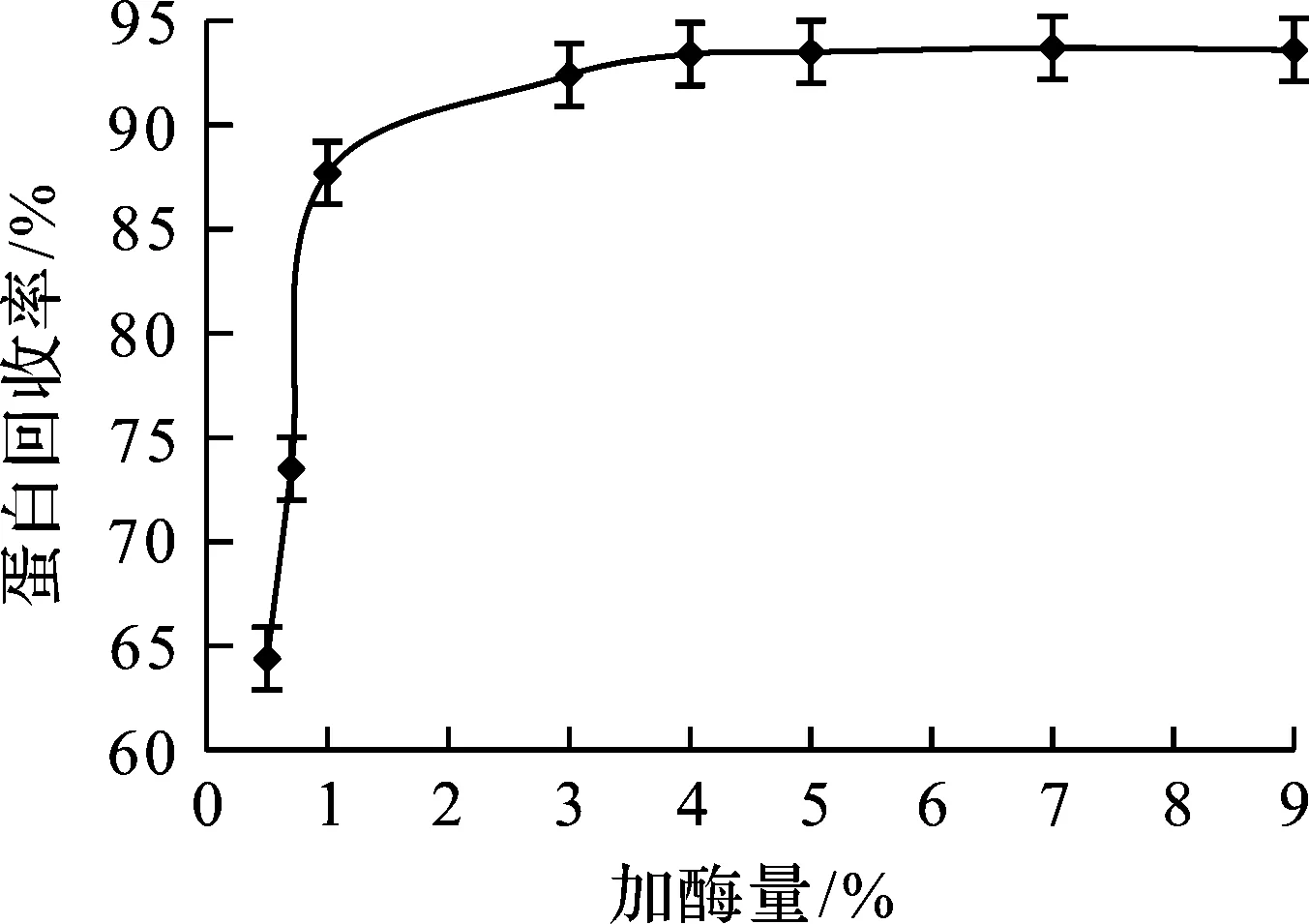
图2 加酶量对蛋白回收率的影响Fig.2 Effect of enzyme dosage on protein yield
2.2.2 酶解时间
按料液比7∶13,以200 kU/g的碱性蛋白酶食品级和200 kU/g的纤维素酶食品级复合酶作为水解酶,按照酶的添加量7%,酶解时间对蛋白回收率的影响如图3所示。由图3可以看出:随着酶解时间的延长,蛋白回收率也提高;当酶解时间大于5 h以后,蛋白回收率增加不明显。这是由于随着反应的进行,底物与酶的有效接触逐渐减少,且产物的生成一定程度上抑制了反应的进行,故确定酶解时间为5 h。
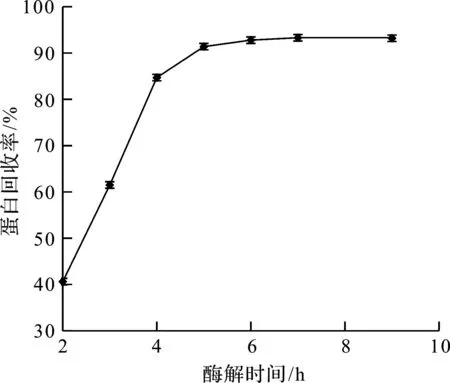
图3 酶解时间对蛋白回收率的影响Fig.3 Effect oftime on protein yield
2.2.3 酶解温度
按料液比7∶13,以200 kU/g的碱性蛋白酶食品级和200 kU/g的纤维素酶食品级复合酶作为水解酶,按照酶的添加量7%,酶解温度分别为30,35,40,45,50,55,60 ℃,酶解温度对蛋白回收率的影响如图4所示。由图4可以看出:温度低于55 ℃随着酶解温度的提高,蛋白回收率也提高;当酶解温度大于55 ℃,蛋白回收率明显下降。
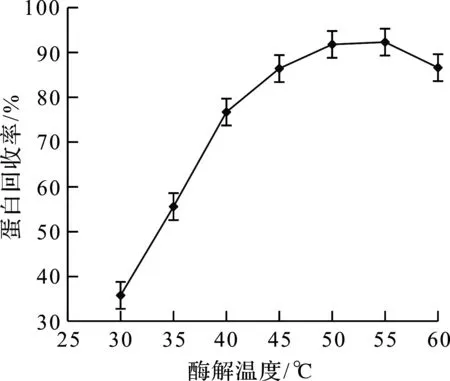
图4 酶解温度对蛋白回收率的影响Fig.4 Effect oftemperature on protein yield
2.2.4 酶解法正交实验
根据单因子实验,选择加酶量分别为3%,4%,5%,酶解时间分别为5,6,7 h,酶解温度分别为45,50,55 ℃进行3因素L9(34)正交实验,其结果如表2所示,确定复合酶水解的最佳工艺条件。
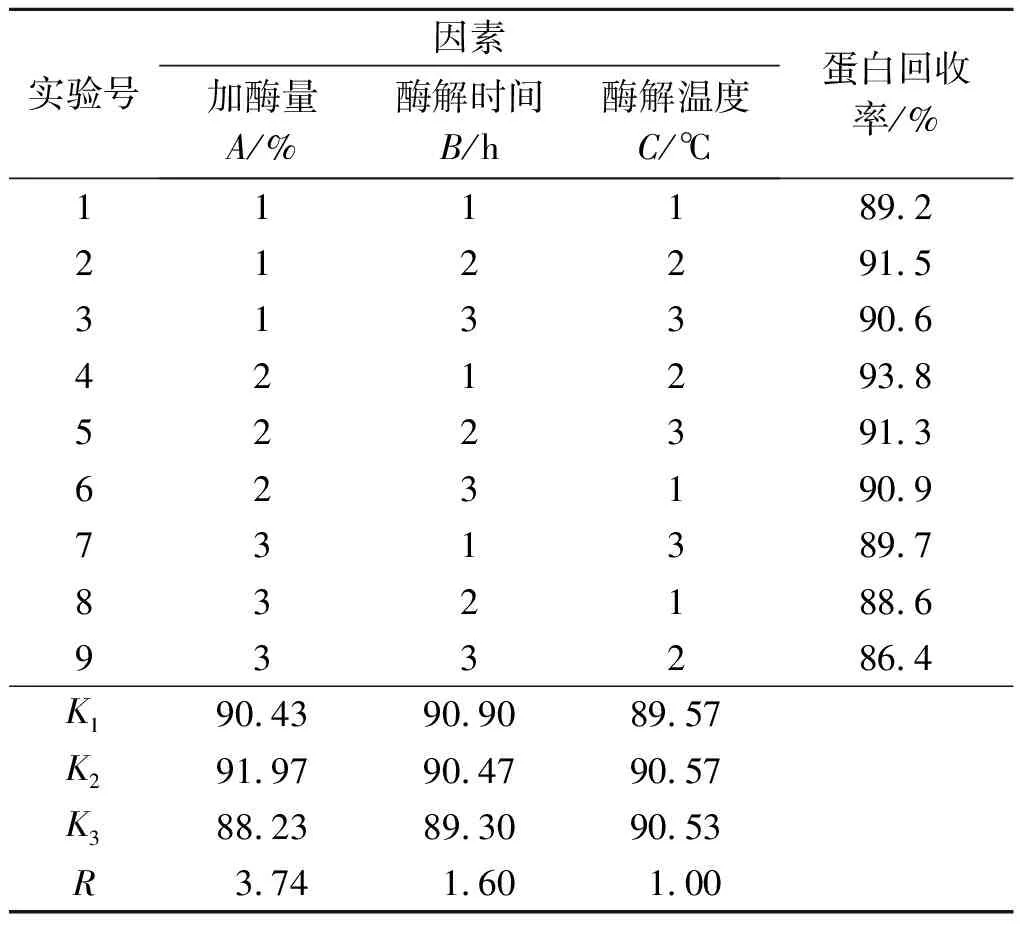
表2 正交实验结果
由表2可知:在影响豆渣蛋白回收率的因素中,3个因素的影响A>B>C,即复合酶添加量的影响最大,其次是酶解时间,最后是酶解温度。酶解豆渣的最佳条件为复合酶添加量为底物的4%,酶解温度50 ℃,酶解时间5 h。在正交实验的基础上,按此条件进行多次重复实验,得到的蛋白回收率均在93%以上,证明酶解反应较稳定。
2.3 酶解豆渣回用黄原胶发酵实验
酶解豆渣回用黄原胶发酵实验结果如表3所示。由表3可知:酶解豆渣回用黄原胶发酵[22-27]对黄原胶发酵产胶、转化率、流变性和白度等指标影响不大,却提高了黄原胶的黏度(CP),因此酶解豆渣应用于黄原胶发酵是完全可行的。
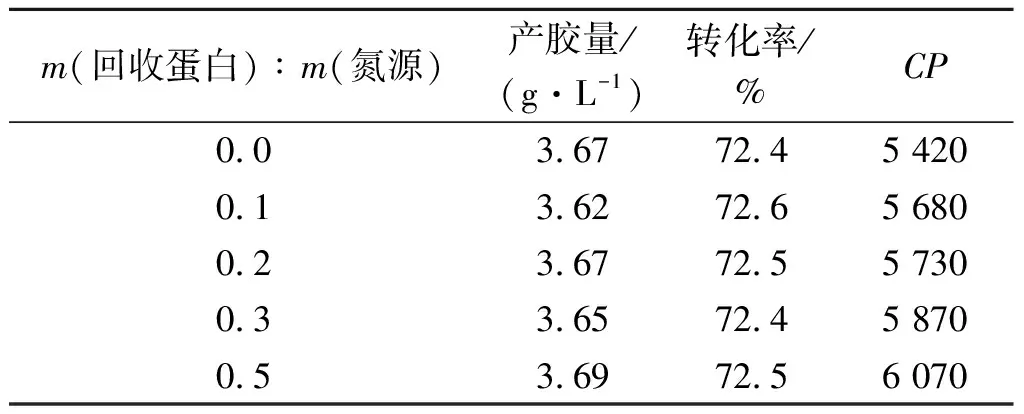
表3 酶解豆渣回用黄原胶发酵实验结果
3 结 论
豆渣作为黄原胶发酵的副产物,仍含有大量未被利用的氮源,单纯作为饲料产品的附加值较低,利用酶解技术将豆渣作为氮源用于生产,降低了黄豆使用量,有效地降低生产了成本,且酶解后豆渣作为小分子多肽,更易被利用,有效提高了氮源的利用率。通过利用酶解豆渣进行黄原胶发酵对黄原胶发酵产胶、转化率、流变性和白度等指标无影响,却可以显著地提高黄原胶的黏度,酶解豆渣应用至黄原胶发酵为有效提高黄豆利用率研究提出了新的思路。
