原生质体制备技术在阿卡波糖菌种筛选中的应用
2021-09-28高双玉
李 娜,高双玉
(杭州中美华东制药江东有限公司,浙江 杭州 310000)
阿卡波糖是Frommer等于上世纪70年代初从游动放线菌(Actinoplanessp.SE50)的发酵液中提取而来,自1990年上市后在许多国家被用于Ⅱ型糖尿病的治疗[1]。作为临床治疗Ⅱ型糖尿病类药物,阿卡波糖具有作用机制新颖、临床疗效好和毒副作用小等特点,市场前景广阔[2]。
阿卡波糖作为企业一个重要的发酵产品,其菌种生产能力的保持及提高至关重要。由于阿卡波糖产生菌的繁殖方式为菌丝断裂,不产生孢子,菌丝体为多核细胞,给菌株的纯化带来很大困难,导致产品生产过程中,难以筛选到高纯度高产量的生产菌株。原生质体是除去细胞壁的原生质,是单一的细胞,并且其由于没有细胞壁的阻碍,诱变更加完全[3-5],因此笔者希望通过研究阿卡波糖产生菌原生质体制备条件,为生产高产菌株的筛选和纯化奠定基础[6]。
1 材料与方法
1.1 菌 种
实验所用的菌种为犹他游动放线菌(Actinoplanessp.),由公司提供。
1.2 培 养 基
无渣种子培养基(SM2)配方:可溶性淀粉1 g,葡萄糖1.5 g,酵母提取物1 g,麦芽提取物1 g,天冬氨酸0.05 g,甘油1 g,MgSO4·7H2O 0.05 g,K2HPO40.1 g,CaCO30.2 g,用纯化水定容至100 mL;pH调节至6.8;121 ℃灭菌30 min。用途:原生质体制备一级、二级菌丝体的培养。
再生培养基配方:黄豆饼粉0.5 g,葡萄糖0.4 g,蔗糖4 g,甘油0.4 g,胰蛋白胨0.1 g,L-赖氨酸0.1 g,L-谷氨酸0.1 g,DL-丙氨酸0.1 g,麦芽提取物0.1 g,酵母提取物0.1 g,CaCl20.2 g,MgSO4·7H2O 0.8 g,K2HPO40.1 g,KCl 0.04 g,FeSO40.04 g,微量元素溶液0.7 mL,琼脂1.5 g,用纯化水定容至100 mL;pH调节至7.0,蒸馏水配置;121 ℃灭菌30 min。
平皿培养基配方:蔗糖3 g,蛋白胨0.5 g,KCl 0.15 g,K2HPO40.1 g,MgSO4·7H2O 0.05 g,琼脂1.5 g,用纯化水定容至100 mL;pH调节至7.0,121 ℃灭菌30 min。
摇瓶种子培养基:玉米淀粉2.0 g,黄豆饼粉4.0 g,甘油2.0 g,碳酸钙0.2 g,用饮用水定容至100 mL;pH调节至7.0,121 ℃灭菌30 min。
摇瓶发酵培养基配方:麦芽糖4 g,葡萄糖3 g,黄豆饼粉3 g,三氯化铁0.15 g,磷酸氢二钾0.2 g,碳酸钙0.5 g,味精0.2 g,用饮用水定容至100 mL;pH调节至7.0,121 ℃灭菌30 min。
种子罐培养基配方:玉米淀粉2 kg,黄豆饼粉4 kg,甘油2 kg,碳酸钙0.2 kg,泡敌100 mL,用饮用水定容至100 L;pH调节至7.0,121 ℃灭菌30 min。
发酵罐培养基配方:麦芽糖4 kg,葡萄糖3 kg,黄豆饼粉3 kg,三氯化铁0.15 kg,磷酸氢二钾0.2 kg,碳酸钙0.5 kg,味精0.2 kg,泡敌100 mL,用饮用水定容至100 L;pH调节至7.0,121 ℃灭菌30 min。
补料培养基配方:葡萄糖7 kg,麦芽糖10 kg,味精0.3 kg,碳酸钙0.5 kg,泡敌50 mL,用饮用水定容至100 L;121 ℃灭菌30 min。
1.3 试剂的配制
P稳定液:蔗糖10.3 g,K2SO40.025 g,MgCl2·6H2O 0.2 g,微量元素溶液0.2 mL,用纯化水定容至80 mL;121 ℃灭菌后加入3种单独灭菌的成分:0.5%的K2HPO41 mL,3.68%的CaCl2·2H2O 10 mL,浓度0.25 mol/L Tris-HCl溶液(pH 7.2)10 mL。
浓度0.25 mol/L Tris-HCl溶液:称量三羟甲基氨基甲烷3.03 g,用蒸馏水70 mL溶解后,用浓盐酸调pH至7.2,然后定容至100 mL。
微量元素溶液:ZnCl20.04 g,FeCl30.2 g,CuCl2·2H2O 0.01 g,MnCl2·4H2O 0.01 g,Na2B4O7·10H2O 0.01 g,钼酸铵0.01 g,加纯化水100 mL。
溶菌酶溶液:称取一定量溶菌酶,溶于10 mL P稳定液中,然后过滤除菌,备用。
1.4 培养条件
摇瓶种子培养:摇瓶种子培养基装量为50 mL∶500 mL,用接种铲从培养好的斜面培养基上取1 cm×1 cm的菌体至种子培养基中,然后置于28 ℃摇床恒温培养,摇床转速为220 r/min。
摇瓶发酵培养:摇瓶发酵培养基的装量为50 mL∶500 mL,30 ℃摇床恒温培养168 h,摇床转速为220 r/min,48~144 h间歇补料。
种子罐培养:将培养好的摇瓶种子按0.2%的接种量接种至1 m3种子罐,装液量为500 L,培养温度28 ℃,溶氧不低于30%,培养44~48 h。
发酵罐培养:将培养好的罐种子以10%的接种量接种至10 m3发酵罐,装液量为5 m3,培养温度30 ℃,溶氧不低于30%,发酵周期为168 h,48~144 h间歇补料。
1.5 器 材
SW-CJ-2F超净工作台,购自苏州安泰空气技术有限公司;ZWYR-D2402恒温摇床,购自上海智城分析仪器制造有限公司;HH-2恒温水浴锅,购自常州市凯航仪器有限公司;CBIO-UV4B紫外诱变箱,购自北京赛百奥科技有限公司;SC-3616低速离心机,购自安徽中科中佳科学仪器有限公司;CX21显微镜,购自奥林巴斯;10 m3发酵罐,购自杭州赛富特设备有限公司,规格3.6 m×1.8 m。
1.6 实验和检测方法
1.6.1 原生质体制备的基本流程
将甘油管菌种接种于无渣种子培养基(SM2)中,培养结束后,吸取2 mL菌液转入含有适量甘氨酸的无渣种子培养基(SM2)中,培养一定时间后取该培养液10 mL于25 mL离心管中,3 000 r/min离心10 min,弃上清,沉淀用P稳定液洗3次,加入终质量浓度为3 mg/mL的溶菌酶溶液2 mL,37 ℃水浴中保温,每隔约10 min轻轻振荡试管1次;镜检观察原生质体生成情况,当大多数菌体脱去细胞壁,呈现单一的原生质体球时,停止酶解反应。将滤液转入另一离心管中,3 000 r/min离心8 min,用P稳定液悬浮沉淀,即为原生质体悬液。
1.6.2 紫外诱变方法
实验采用的物理诱变方式为紫外线照射[7-11]。取制备好的原生质体悬液8 mL于直径9 cm的带无菌搅拌子的平皿中,盖上皿盖,在事先预热好的15 W紫外灯下30 cm处照射10 min,进行培养皿的表面消毒;之后开启磁力搅拌器,打开皿盖,边搅拌边照射,照射一定时间后盖上平皿盖取出。在红外灯下稀释涂平皿,将涂好的平皿用黑布包好,置于恒温培养箱中,28 ℃培养,至长出成熟菌落,计菌落数同时统计不同紫外照射时间的致死率。
1.6.3 菌体体积分数的测定
将菌液摇匀,用移液管准确吸取10 mL置于离心管中3 500 r/min,离心15 min,取上清液转移至量筒中测量体积。计算公式为

1.6.4 阿卡波糖发酵单位的测定
采用高效液相色谱法测定阿卡波糖的发酵单位[12],HPLC色谱条件如下:色谱柱为氨基柱(4.6 mm×250 mm,5 μm),流动相为V(0.01 mol/L磷酸缓冲液(pH 6.0))∶V(乙腈)=30∶70,流速为1.5 mL/min,检测波长为210 nm,柱温为35 ℃,进样量为10 μL。
2 原生质体制备条件
在原生质体制备的过程中,菌体一级培养时间、二级培养时间、甘氨酸的质量浓度、溶菌酶的质量浓度和酶解时间等要素是最终原生质体制备量的关键影响因素[13-15]。因此,针对阿卡波糖产生菌株犹他游动放线菌(Actinoplanessp.),对以上几个因素依次进行了实验。
2.1 一级培养时间
实验制备原生质体时先采用无渣种子培养基(SM2)进行一级培养,再用无渣种子培养基(SM2)进行菌丝体的二级培养,一级培养的菌丝进入稳定生长期时转接二级培养,二级培养至稳定生长期时的菌丝体用于制备原生质体。
实验将冷冻甘油管保存的菌液倒入一级培养基中,并在一级培养过程中,每间隔4 h取样并测定菌体浓度,具体结果如图1所示。

图1 一级培养时间Fig.1 The primary culture time
由图1可以看出:在一级种子培养过程中,种子培养前期0~24 h菌体生长较缓慢,24 h之后菌体开始快速生长,培养至44~48 h时菌体体积分数达到最高值,之后菌体体积分数稳定一定时间,培养52 h之后菌体体积分数开始下降,说明此时菌体开始逐渐衰老,因此一级培养时间确定为44~48 h,此时菌体数量多且活力较强。
2.2 二级培养甘氨酸添加质量分数
二级培养是制备原生质体最关键的一步,培养过程中需加入适量的甘氨酸,这是因为甘氨酸可以代替丙氨酸参与细胞壁合成初期短肽的合成,干扰细胞壁肽聚糖的相互交联,便于形成原生质体[16-19]。培养基中若添加甘氨酸的质量分数过小,菌丝体对溶菌酶不敏感,形成的原生质体数量很少,但加入甘氨酸质量分数过大时,会对细胞膜产生破坏,导致原生质体数量会下降。因此,本实验研究了二级培养时添加不同质量分数的甘氨酸对菌丝体生长的影响以及二级培养的时间。
将一级培养结束的菌悬液转入二级培养基中,在二级培养用的无渣种子培养基(SM2)中分别加入甘氨酸质量分数0%,0.1%,0.2%,0.3%,0.4%,0.5%,二级培养44 h后,分别测定菌体体积分数,具体实验结果如图2所示。

图2 不同质量分数甘氨酸对菌体生长的影响Fig.2 The influence of different glycine concentration on bacteria growth
由图2可以看出:随着甘氨酸质量分数的增加,菌体的生长受到明显的抑制;一般制备原生质体甘氨酸加入的质量分数通常控制在能够明显抑制菌丝生长,并可以获得适量菌丝体为宜。根据数据结果,确定采用甘氨酸的添加质量分数为0.3%进行后续实验。
2.3 二级培养时间
在二级培养中加入甘氨酸质量分数0.3%,在培养过程中,每间隔4 h取样并测定菌体体积分数,目的是确定最佳的二级培养时间,具体结果如图3所示。

图3 二级培养时间Fig.3 The secondary culture time
由图3可以看出:在该培养条件下,培养至40~44 h时,菌丝体处于对数生长期与稳定期的转换期,该时期的菌丝体对溶菌酶的作用最敏感,因此确定二级菌丝体最佳的培养时间为40~44 h。
2.4 溶解酶的质量浓度和作用时间对原生质体形成的影响
阿卡波糖产生菌为放线菌,实验使用溶菌酶作为工具酶,可水解放线菌细胞壁的主要成分肽聚糖[20-21]。通过将不同的溶菌酶质量浓度和不同酶解时间进行组合实验,已确定最佳的溶菌酶质量浓度和酶解时间。实验添加的溶菌酶质量浓度分别为2,3,4 mg/mL,酶解作用时间分别为1,2,3 h,酶解作用之后将原生质体悬液用血球计数板在显微镜下计数,可统计得到该条件下原生质体的制备量。实验结果如表1所示。

表1 不同溶菌酶质量浓度和酶解时间对原生质体形成数量的影响
由表1可以看出:溶菌酶质量浓度为3 mg/mL、酶解时间为2 h时原生质体的释放量最大,因此确定溶菌酶质量浓度为3 mg/mL时酶解时间2 h为宜。在酶解过程中不断取样在显微镜下观察,溶菌酶质量浓度较低、酶作用时间较短时,大部分菌体仍呈菌丝状;随着酶质量浓度的加大,菌丝周围球形的颗粒出现的越早,说明此时原生质体开始逐渐形成;在最佳酶解质量浓度和时间可观察到大多数菌丝体已形成原生质体,并且很少观察到丝状形态;酶质量浓度过大、酶解时间加长,细胞形态会发生变化,说明此时细胞质膜已经受到了损伤。
3 原生质体制备技术在阿卡波糖生产中的应用
3.1 利用原生质体复合诱变技术筛选阿卡波糖高产菌株
3.1.1 原生质体最佳物理诱变时间的摸索
按照1.6.2中叙述的紫外诱变方法,实验统计了紫外照射时间分别为1,3,6,9 min时的致死率,具体结果如表2所示。
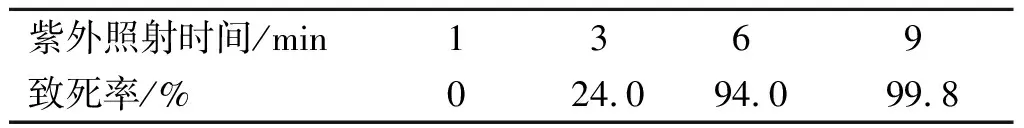
表2 不同紫外照射时间的致死率
由表2可以看出:当紫外照射1 min时,菌体没有受到任何损伤;紫外照射3 min时,致死率太低不利于筛选;而紫外照射9 min时,致死率高达99.8%,只有极少数细胞能够存活,同样也难以进行后续的菌株筛选;照射6 min时,致死率为94%,既能保证较高的致死率,又有足够数量的菌体可以用于后续的筛选,因此在后续实验中采用原生质体在紫外下照射6 min的诱变方式开展选育工作。
3.1.2 阿卡波糖高产菌株的筛选
利用摇瓶发酵的方式对原生质体诱变后的再生菌株进行大量的筛选[22-27],具体筛选方法:取紫外诱变处理的原生质体悬液,涂布于再生培养基上进行培养;从再生培养基平皿上随机挑取100株生长出的单菌落至斜面培养基上,再从斜面培养基挖块至种子培养基中,种子培养后,接种至摇瓶发酵培养基中进行培养,摇瓶发酵结束后,用HPLC测定每株菌的发酵单位。
以出发菌株的发酵单位为100%,分别统计了100株菌株中,摇瓶相对发酵单位为70%~80%,80%~90%,90%~100%,100%~110%,110%~120%,大于120%这6个阶段的菌株数量,具体结果如图4所示。

图4 筛选菌株的产量分布图Fig.4 The production distribution of the screened strains
由图4可以看出:利用原生质体进行紫外诱变,其诱变效果较为显著,负向突变率为28%,正向突变率可以达到15%,其中正变率大于120%的高产菌株有3株。
3.1.3 阿卡波糖高产菌株摇瓶发酵水平的确认
将原生质体诱变筛选出的3株高产菌株,重复进行了3批摇瓶发酵,确认了3株高产菌株发酵水平的稳定性,具体实验检测结果如表3所示。

表3 3株高产菌株的发酵水平
由表3可以看出:3株高产菌株重复进行了3批摇瓶发酵且发酵水平均较稳定,相对于出发菌株,平均发酵目的产物的质量浓度分别提高了19.3%,24.6%,25.4%。
3.1.4 筛选出的高产菌株在中试的应用
利用筛选出来的阿卡波糖高产菌株进行中试实验,以此考察高产菌株的生产效力。将筛选出的高产菌株接至种子培养基中,种子经过48 h的培养后,接种至1 m3的种子罐中进行扩大培养,再移种至10 m3发酵罐进行发酵培养。取其发酵液经HPLC测定,3株高产菌株的中试发酵水平如图5所示。
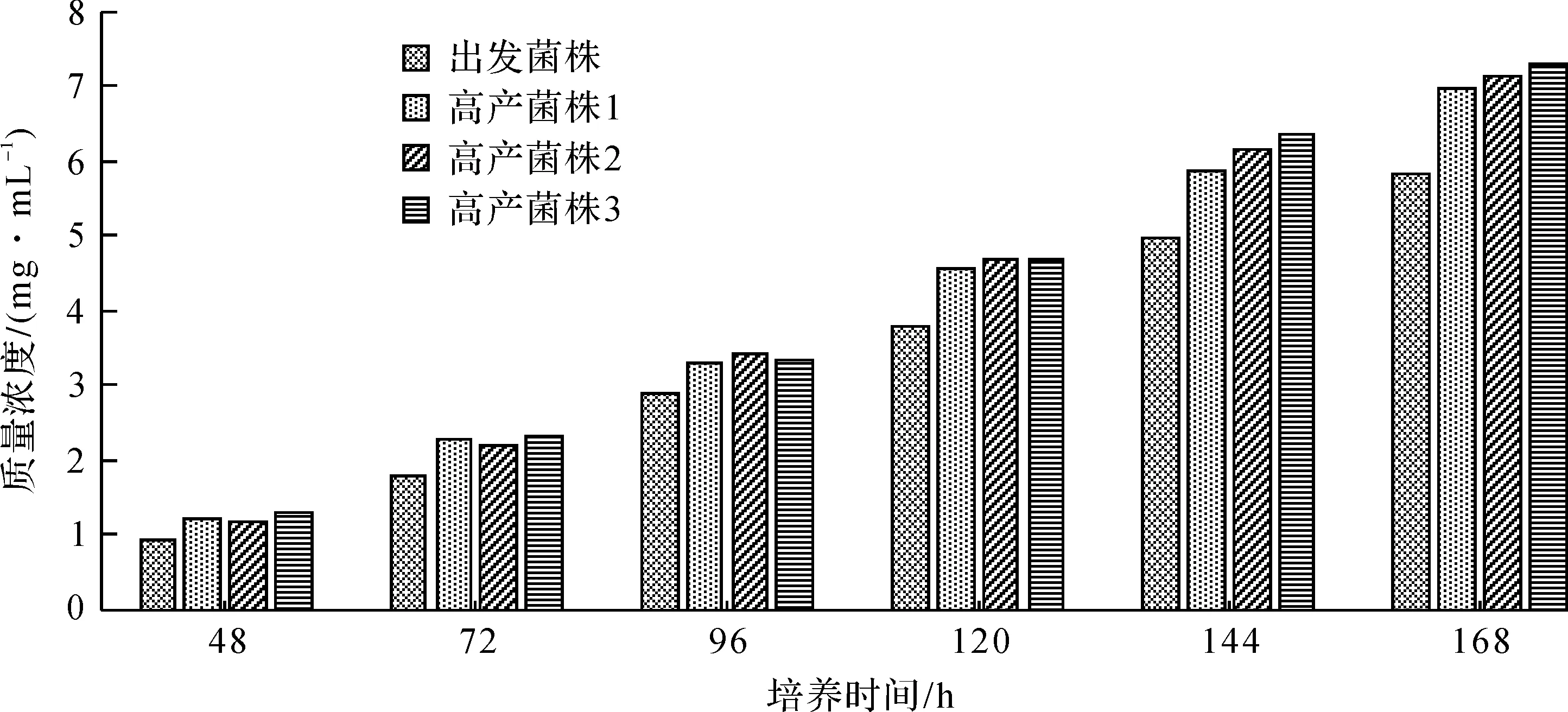
图5 3株高产菌株的中试发酵水平Fig.5 The pilot-scale fermentation level of the three high-yield strains
由图5可以看出:10 m3罐发酵培养168 h后,3株高产的发酵目的产物的质量浓度分别为6 951,7 133,7 286 μg/mL,比出发菌株分别提高了19%,22.2%,24.8%。通过中试放大实验说明原生质体诱变筛选获得的3株高产菌株,在10 m3的发酵罐规模下仍能够保持较高的产物合成能力。
3.2 原生质体技术在菌种库制备过程中的应用
阿卡波糖原料药发酵使用的工业菌种是从原始菌株不断复壮纯化而来的,由于阿卡波糖产生菌的分筛和保藏都是以菌丝体的形式,多核细胞导致保存和使用的菌种库的纯化程度不高,因此在阿卡波糖菌种的实际使用过程中发现分离筛选后的单菌落间存在明显差异的现象,差异主要体现在种子生长速度及发酵过程中的代谢特征,从而引起生产水平的波动和下降。该问题的出现可以说明:若菌种库的纯化程度不高,则会造成菌株表型延迟和严重的遗传分离现象,菌种的生产性能会逐渐衰退,这是目前菌种库制备面临的一个重要问题。
实验在菌种库制备的过程中使用原生质体技术,明显提高了菌种库的纯化程度。制备菌种库的具体流程如下:制备原生质体—原生质体再生—从再生培养基中挑取单菌落—接种至摇瓶种子培养基—菌液中加入20%灭菌后的甘油并充分混匀—分装于甘油管中冷冻保存。
实验将自然筛选与原生质体两种方式制备的菌种库,其单菌落之间的差异大小进行了比对。首先将两个不同菌种库的菌液涂布于平皿培养基上,然后从每组平皿上分别挑取10颗单菌落,接种于摇瓶种子培养基中,种子培养结束后再转接至摇瓶发酵培养基中,并测定剩余种液的菌体体积分数,发酵培养168 h后,取发酵液经HPLC测定发酵水平,具体实验结果表4所示。
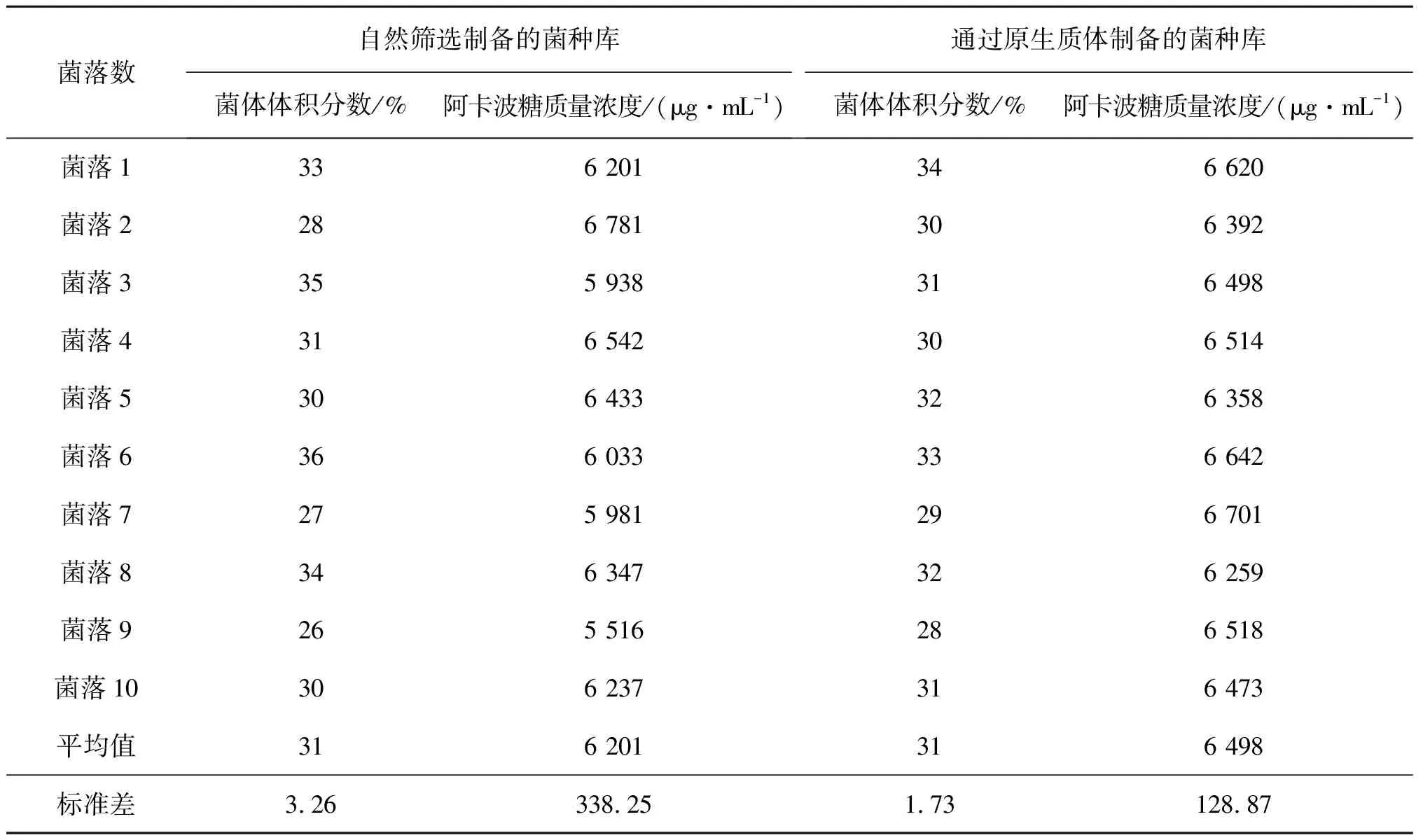
表4 对比不同菌种库单菌落之间的发酵水平差异
由表4可以看出:两组实验菌体质量分数的平均值均为31%,说明不同方式制备的菌种库种子生长速度相当,但是两组实验菌体质量分数的标准差分别为3.26和1.73,说明通过原生质体制备的菌种库不同单菌落之间的种子生长速率差异更小;通过原生质体制备的菌种库其10颗单菌落对应的摇瓶发酵单位平均值高于自然筛选制备的菌种库,说明通过原生质体是一种优于自然选育的优胜劣汰的筛选过程;通过原生质体筛选获得的菌株不仅发酵水平高,而且不同单菌落个体之间的差异较小,发酵水平更加稳定。
4 结 论
通过实验确定了阿卡波糖产生菌原生质体制备的最适条件为:二级菌丝培养采用优化后的SM2培养基,一级培养时间为44~48 h,二级培养添加甘氨酸质量分数为0.3%,培养时间为40~44 h;溶菌酶质量浓度为3 mg/mL,作用时间为2 h,该条件下原生质体制备量可达1.2×105个/mL,并且通过对原生质体进行紫外诱变,获得了3株高产菌株。对于不产孢子的放线菌而言,原生质体制备技术是解决该类放线菌纯化的一种有效方法。目前,该技术在育种工作中已经运用原生质体诱变的方法来筛选高产菌株,用UV照射去除细胞壁的原生质体能够更加迅速地与细胞核作用,基因突变率会大大增加,而且诱变后易于形成单菌落,便于后续的分离筛选,因此可以说对于像阿卡波糖产生菌一样的不产孢子的丝状微生物而言,原生质体是最适的诱变材料。另外,在菌种库制备过程中应用原生质体技术与原来的自然筛选相比较,该流程较繁琐,操作难度较大。该技术虽然从短期的运用效果来看还未体现出明显的优势,但从长期的工业化大生产来看,对确保生产菌种优良性能的稳定具有深远的意义。
