核壳结构NH2-UiO-66@TiO2 的制备及其可见光下的甲苯降解性能研究
2021-09-01周易欧阳威龙王岳军王海强吴忠标
周易,欧阳威龙,王岳军,王海强,*,吴忠标
1 浙江大学环境技术研究所,杭州 310058
2 浙江天蓝环保技术股份有限公司,杭州 311202
1 引言
挥发性有机物(VOCs),如芳香烃、醇、酯、酮等,是一类常见的室内空气污染物,在室内场所分布广泛,直接威胁着居室住户的身体健康1-3。其低浓度的特性以及封闭空间的限制,让反应条件温和、使用便捷的光催化技术被寄予厚望4-6。然而,目前普遍使用的TiO2光催化剂对光的利用效率低、对污染物的吸附性能差,致使降解效率不理想7,8,制约着该技术的应用。
新型催化剂的开发是解决上述问题的重要途径。具有半导体特性、超大比表面积、合成方法简便的金属有机框架材料(MOFs)日益受到关注,在气体吸附和分离9,光催化产氢10、CO2还原11,12、化学合成13和NOx降解14等方面展现出优异的性能。MOFs巨大的比表面有利于对中间产物的吸附,有望实现污染物的深度降解;部分MOFs材料,如NH2-UiO-66、MIL-125等,能够在可见光波段内激发,提高太阳光谱的利用率。然而,将MOF材料直接用于催化,效果并不理想,主要原因是存在着光生电子利用率低和稳定性不足等问题15。
研究表明,MOF与无机半导体的复合,可以构建电荷转移路径,提高电子和空穴的利用效率。特别是,在MOFs表面原位生长非晶态TiO2层,能够显著提高光催化活性和稳定性16。Wang等人17制备了核壳结构催化剂HKUST-1@TiO2用于异丙醇的降解,HKUST-1可以选择性捕获中间产物,从而提高异丙醇的矿化率。Li等人18在多种MOFs的孔道内原位生长无定形二氧化钛,极大地促进了光生载流子的迁移和分离,提高了光催化性能。基于上述研究,本研究在NH2-UiO-66表面上原位生长非晶态的TiO2,制备出具有优异活性和稳定性的NH2-UiO-66@TiO2催化剂,并结合系列表征探究其光催化性能的提升机理。
2 实验部分
2.1 实验药品和制备过程
实验所用到的四氯化锆(ZrCl4)、N,N-二甲基甲酰胺(DMF)、乙醇、甲醇试剂生产厂家为中国国药化学试剂公司,2-氨基对苯二甲酸试剂厂家为美国Sigma-Aldrich公司,钛酸四丁酯(TBOT)购自中国Aladdin试剂公司。以上试剂纯度均为分析纯,且未进行后续提纯。
NH2-UiO-66的合成19:0.600 g ZrCl4和0.456 g二氨基对苯二甲酸溶于150 mL DMF中,逐滴加入0.475 mL去离子水,室温下搅拌10 min,然后转移至容量为200 mL的聚四氟乙烯内衬的水热反应釜中,120 °C加热24 h。将反应后的产物过滤,依次用DMF和甲醇洗涤,150 °C下真空干燥6 h。
NH2-UiO-66@TiO2的合成18:取0.2 g NH2-UiO-66超声分散到400 mL甲醇溶液中,加入2 mL钛酸四丁酯,室温下搅拌15 min。将所得的溶液在85 °C下回流搅拌8 h,产物离心分离,用甲醇洗涤数次,80 °C下烘干。
为全面评价NH2-UiO-66@TiO2的性能,本研究采用固混法制备了不同形态的TiO2和NH2-UiO-66的复合样品,用于对比分析。样品的合成方式如下。
Anatase/NH2-UiO-66的合成:将水热制备的锐钛矿与NH2-UiO-66按1 : 10混合,充分研磨。其中,锐钛矿制备方法20如下:向17 mL钛酸正丁酯中逐滴加入44 mL乙醇,记作溶液A;将29 mL乙醇和45 mL去离子水混合,记为溶液B;将溶液A加入溶液B中,搅拌2 h,180 °C水热24 h。将水热后的样品离心、水洗、烘干,450 °C下煅烧3 h。
P25/NH2-UiO-66的合成:将购买的Degussa P25与NH2-UiO-66按质量比1 : 10混合,充分研磨。
2.2 催化剂活性评价
甲苯的光催化降解性能测试实验在加装了红外和紫外滤光片的300 W 氙灯(京中教金源Celhx300UV)下进行,波长范围在420-780 nm。静态反应器容积为1.5 L,壁面夹层中通入循环水,保证容器内温度的恒定。实验前先将0.1 g催化剂涂覆在圆形玻璃片上,烘干后置于反应器内;密封,注入甲苯蒸汽,控制甲苯初始浓度为150 × 10−6左右;反应器置于避光环境中一段时间,直到内部甲苯浓度不再变化,即催化剂达到吸脱附平衡后开始实验。甲苯浓度由气相色谱(北京普析Puxi-G5)检测。
问题:(1)用一张正方形的纸怎样才能制成一个无盖的长方体形盒子?( 假设这张正方形纸的边长a为20 cm,所折无盖长方体形盒子的高为h cm)
2.3 催化剂表征
样品的晶相结构由X射线粉末衍射(PXRD)确定,所用仪器为日本Shimadzu公司的XRD-6000仪器;微观形貌由日本Hitachi H-9500型透射电镜(TEM)及Hitachi SU8010扫描电镜(SEM)观测。X射线光电子能谱(XPS)由美国Thermo公司生产的ESCALAB 250Xi型能谱仪获取。N2吸脱附实验使用的仪器为北京精微高博JW-BK 132F型吸附仪,样品的比表面积、孔径分布等信息根据BET-BJH模型获得。光电流、阻抗谱等电化学性能测试,在上海辰华CHI 660E型电化学工作站进行。光致发光光谱(PL)在英国爱丁堡仪器公司的FLS980型荧光光谱仪上测试,激发波长为380 nm。电子自旋共振(ESR)用来确定反应中的活性自由基,以5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)作为捕获剂。
3 结果与讨论
3.1 晶相结构分析
图1为实验中制备的所有样品的PXRD谱图。位于5°-10°的两个强峰为NH2-UiO-66的衍射峰,与文献报道吻合,说明NH2-UiO-66制备成功。
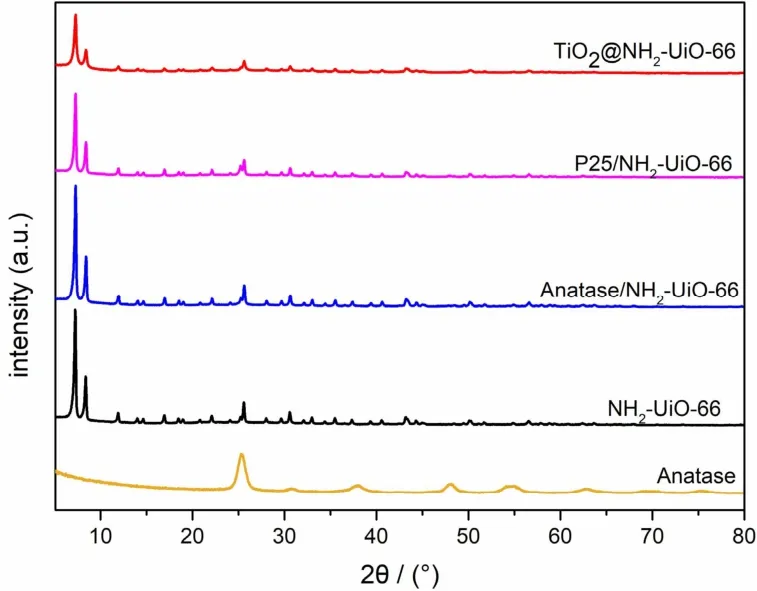
图1 样品的XRD图Fig. 1 XRD patterns of the samples.
NH2-UiO-66在与TiO2复合之后,其峰强有明显的下降。水热法制备的TiO2为锐钛矿相(PDF:No.12-1272)。由于各样品的TiO2负载量均较少,因此在复合样品中均未观察到TiO2的特征峰。
3.2 形貌分析
图2 为NH2-UiO-66 和NH2-UiO-66@TiO2的SEM图。由图可见,NH2-UiO-66的粒径在100 nm左右,为棱角分明的八面体形态。NH2-UiO-66@TiO2样品有轻微的团聚,颗粒表面更为粗糙。通过EDS能谱(图3)可以看出,NH2-UiO-66@TiO2由C、N、O、Zr、Ti等元素组成,可以初步判定TiO2已成功生长在NH2-UiO-66表面。在TEM图(图4b)中未观察到明显的晶格,故其表面的TiO2应是非晶态结构。
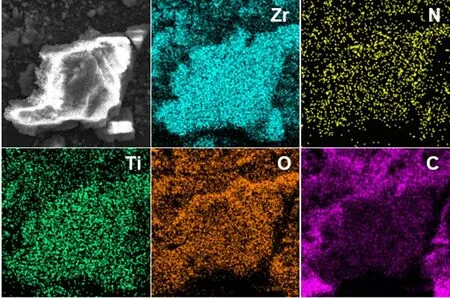
图3 NH2-UiO-66@TiO2的EDS图谱Fig. 3 EDS element mappings of NH2-UiO-66@TiO2.
固混样品的TEM图见图4的c-f,可以看到NH2-UiO-66大颗粒的周围紧密环绕着TiO2小颗粒,边缘处晶格清晰可见,说明锐钛矿和P25经简单固混之后已在NH2-UiO-66表面负载。

图4 样品的TEM图:(a) NH2-UiO-66,(b) NH2-UiO-66@TiO2,(c, e) Anatase/NH2-UiO-66,(d, f) P25/NH2-UiO-66Fig. 4 TEM images of (a) NH2-UiO-66, (b) NH2-UiO-66@TiO2, (c, e) Anatase/NH2-UiO-66 and (d, f ) P25/NH2-UiO-66.
3.3 表面元素分析
由图5 XPS的结果可知,NH2-UiO-66@TiO2由Zr、Ti、O、C、N元素组成,与EDS结果一致。O 1s可分为533.3、531.9和530.4 eV处的三个峰,分别对应未配位的羧基、Zr-O-C和Zr-O-Zr的O元素21。Ti 2p3/2和2p1/2分别位于458.9和464.7 eV,对应TiO2中的O―Ti―O键22,再次证明了NH2-UiO-66表面的Ti物种是TiO2。与纯的NH2-UiO-66及两个固混样品相比,NH2-UiO-66@TiO2的Zr 3d5/2、Zr 3d3/2峰向低结合能方向偏移了0.1 eV,而NH2-UiO-66@TiO2的Ti 2p峰则向高结合能方向偏移,说明原位生长方式下,两种材料间形成了异质结23。

图5 样品的XPS谱图: (a) NH2-UiO-66和NH2-UiO-66@TiO2, (b) Zr 3d, (c) Ti 2p, (d) O 1sFig. 5 XPS spectra of (a) NH2-UiO-66 and NH2-UiO-66@TiO2, (b) Zr 3d, (c) Ti 2p and (d) O 1s.
3.4 吸附性能分析
通过BET方法计算得到不同样品(NH2-UiO-66、NH2-UiO-66@TiO2、Anatase/NH2-UiO-66、P25/NH2-UiO-66)的比表面积分别为914.9、805.1、898.5、822.5 m2·g−1(见图6)。NH2-UiO-66@TiO2最大程度上保持了NH2-UiO-66超大的比表面积,比表面积的轻微下降可能由于TiO2在表面的覆盖造成的。
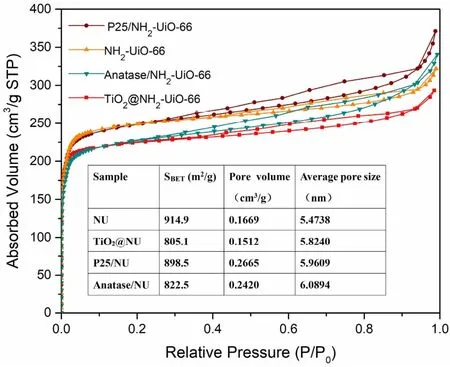
图6 样品的氮气吸脱附等温线、比表面积Fig. 6 Nitrogen adsorption-desorption isotherms and BET surface area of samples.
3.5 光吸收范围和能带结构分析
根据Mott-Schottky曲线(图7c),可得NH2-UiO-66的平带电位为−0.52 Vvs.Ag/AgCl (即−0.32 Vvs.NHE)。选取导带底和平带电位的差值为0.1 eV24,可得NH2-UiO-66导带底的位置是−0.42 eV。根据禁带宽度,可计算出NH2-UiO-66 的HOMO 和LOMO位置分别为2.49和−0.42 eV (vs.NHE)。

图7 (a) 不同样品的UV-Vis DRS 图,(b) Tauc 图,(c) NH2-UiO-66 的Mott-Schottky 曲线Fig. 7 (a) UV-visible diffuse reflection spectra (DRS) , (b) the plot of (Ahv)2 versus photo energy of samples and(c) Mott-Schottky curve of NH2-UiO-66.
3.6 活性和稳定性测试
图8为不同样品的甲苯光催化降解活性比较。在可见光照射下,P25对甲苯几乎没有降解作用;NH2-UiO-66在3 h内降解效率为51.7%。将NH2-UiO-66与P25或锐钛矿简单固混之后,活性有小幅提高(10%左右);而原位生长策略实现了明显的性能提升,NH2-UiO-66@TiO2在三小时内达到了76.7%的去除效率。由图8b可知,除活性之外,NH2-UiO-66@TiO2的稳定性也较佳。将反应之后的样品进行相同条件下的重复测试实验,重复使用三次后活性有轻微下降,推测可能是甲苯矿化不完全生成的降解副产物,如苯甲酸、苯甲醛、苯甲醇等,吸附在样品表面,覆盖了反应活性位点25。样品在乙醇洗涤之后活性可以基本恢复,可见催化剂具有良好的光化学稳定性26。
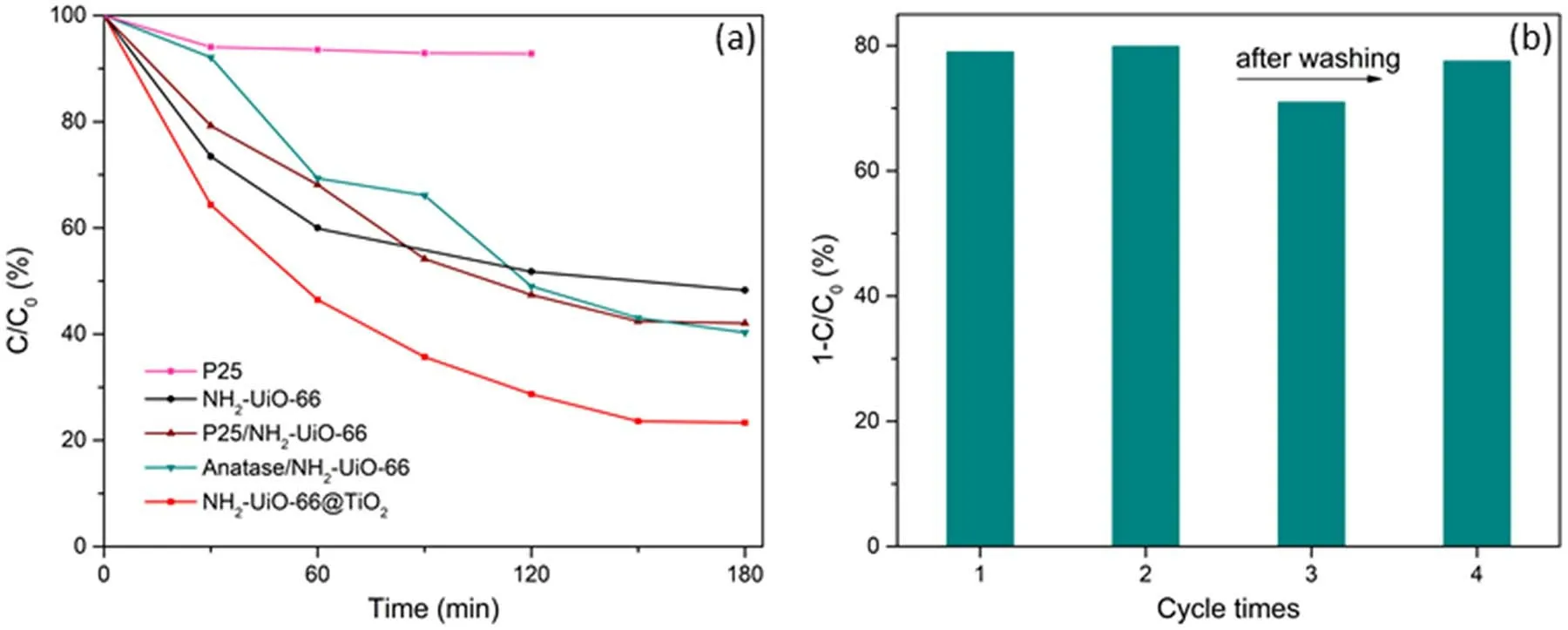
图8 (a)不同样品的活性测试和(b) NH2-UiO-66@TiO2 的循环稳定性测试Fig. 8 (a) Photocatalytic activities of samples and (b) stability test of NH2-UiO-66@TiO2 photocatalyst for toluene removal.
3.7 光生电荷分离情况分析
图9展示了样品光生电子-空穴对的分离性能。由PL光谱可见,复合样品的荧光强度明显减弱,说明光生电子空穴的复合率降低,有更多的载流子参与到甲苯降解过程中27。从图9c来看,相比单独的NH2-UiO-66,复合样品的光电流明显增大,特别是NH2-UiO-66@TiO2,提高了将近10倍。四种样品的Nyquist半径由小到大依次为:NH2-UiO-66@TiO2、NH2-UiO-66、Anatase/NH2-UiO-66、P25/NH2-UiO-66。即NH2-UiO-66@TiO2的界面电荷迁移阻力最小。以上结果说明NH2-UiO-66@TiO2具有最佳的电荷分离和转移能力,有助于光催化效果的提高。

图9 不同样品的(a) PL 图,(b)电化学阻抗图,(c)光电流响应图Fig. 9 (a) The photoluminenscence spectra, (b) electrochemical impedance spectroscopy (EIS) Nyquist plots and(c) photocurrent responses of the samples.
3.8 光催化性能提升机理探讨
为进一步探究核壳结构NH2-UiO-66@TiO2的性能提升机制,本文进行了DMPO-ESR测试,实验结果如图10所示。黑暗条件下,所有样品均未检测到·OH或·O2−的信号。在光照条件下,NH2-UiO-66可以观察到较弱的·O2−信号和极微弱的·OH信号。TiO2加入后,改变了这一状况:可见光照射下,所有样品均能明显观察到DMPO-·OH和DMPO-·O2−的信号。特别是NH2-UiO-66@TiO2的ESR信号最强,与其优越的光催化性能对应。
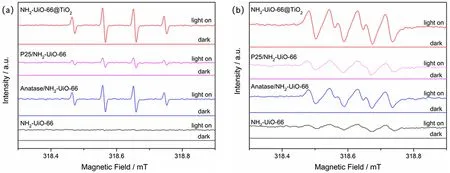
图10 不同样品的DMPO-ESR 谱图:(a) ·OH,(b) ·O2−Fig. 10 DMPO spin-trapping ESR spectra for (a) DMPO-·OH, and (b) DMPO-·O2−.
结合能带位置计算的结果,本文推测复合样品活性提高的原因可能是两种组分形成了type-II型异质结(如图11),且原位生长策略下,异质结结合更加紧密。相比于TiO2,由于NH2-UiO-66的导带和价带位置更低,光生电子会向TiO2表面转移,而光生空穴会在NH2-UiO-66表面富集。迁移路径的形成降低了电子和空穴的复合率28。NH2-UiO-66的HOMO(2.49 eVvs. NHE)位置高于·OH/H2O的氧化电位29(2.27 eVvs.NHE),因此在其表面会产生·OH;TiO2的导带位置低于O2/·O2−的还原电位30(−0.33 eV),故在其导带上会产生·O2−。在具有强氧化性的自由基攻击下,甲苯会被分解为丙酮、乙醛、甲酸、甲醛等中间产物,并最终氧化为CO231。
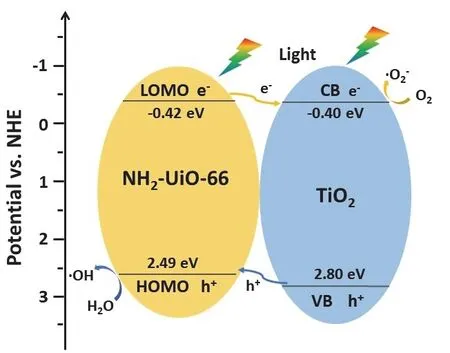
图11 NH2-UiO-66@TiO2 的光催化原理图Fig. 11 Schematic diagram of the possible photocatalytic mechanism of the NH2-UiO-66@TiO2.
4 结论
本文对NH2-UiO-66,核壳结构NH2-UiO-66@TiO2和固混法制备的Anatase/NH2-UiO-66、P25/NH2-UiO-66催化剂进行了可见光下的甲苯降解实验。结果表明:
(1) NH2-UiO-66@TiO2性能最优,3 h内甲苯降解效率可达76.7%,是单纯的NH2-UiO-66效率的1.48倍,同时远高于两种固混样品。样品重复使用三次之后,其去除效率仍有70%,经乙醇洗涤后其活性可以基本恢复。
(2) UV-Vis DRS、PL光谱、光电流和电化学阻抗等表征手段证实,NH2-UiO-66和TiO2的结合可以拓宽吸收光谱范围、促进载流子的迁移和分离,提高光生电荷的利用率。其中以NH2-UiO-66@TiO2最为明显。
(3) 结合自由基捕获实验结果和能带结构的分析可知,在NH2-UiO-66@TiO2体系中,TiO2和NH2-UiO-66形成了强的界面相互作用,在光激发下,发生了电子和空穴的转移,电子在TiO2的导带上与O2结合生成了·O2−,同时空穴得到更好的利用,产生更多·OH。活性自由基生成量的增加,实现了甲苯降解效果的提高。
猜你喜欢
杂志排行
物理化学学报的其它文章
- 基于密度泛函理论下H2S 在单原子催化剂V/Ti2CO2 上的分解机理研究
- 富含缺陷的2D/2D 异质结促进光催化清洁能源转化
- Development of Iron-Based Heterogeneous Cocatalysts for Photoelectrochemical Water Oxidation
- 二维光催化材料电子结构和性能调控策略研究进展
- Defect Engineering in Two-Dimensional Graphitic Carbon Nitride and Application to Photocatalytic Air Purification
- Non-Noble-Metallic Cocatalyst Ni2P Nanoparticles Modified Graphite-Like Carbonitride with Enhanced Photocatalytic Hydrogen Evolution under Visible Light Irradiation
