苯胺蓝染色对沉积物摇蚊头壳提取方法的改进
2021-08-13田文龙骆萱郑子杰周安琪代哲曹艳敏
田文龙,骆萱,郑子杰,周安琪,代哲,曹艳敏
(中南民族大学 资源与环境学院,武汉 430074)
摇蚊幼虫是遍布几乎所有淡水水体的一种不咬人的蠓虫.其作为淡水底栖生物中数量最多、分布最广的水生昆虫,在水生态系统生物地球化学过程中具有不可替代的重要作用[1].摇蚊是一种全变态昆虫,其幼虫蜕变过程中脱落的头囊几丁质化程度高,能耐酸碱,因此可以在沉积物中得以长期保存.
现代摇蚊生态学研究表明:尽管摇蚊可遍布世界几乎所有的生物地理区,但多数属种生态幅狭窄,其短暂的生命周期使得各生长阶段生理活动对环境变化异常敏感,能对周围环境变化做出迅速响应[2].古湖沼学家们发现,沉积物中保存良好的亚化石头壳可以鉴定到属甚至到种,使过去环境下摇蚊组合的恢复成为可能.20世纪90年代以来,摇蚊被视为古环境古气候重建最具发展潜力的生物方法之一[3].一系列摇蚊-环境数据库的建立[4-6]使得摇蚊在古湖沼学研究中的应用从定性转向定量.全球范围内基于沉积物摇蚊亚化石的温度、营养盐、降水等指标的定量重建工作相继开展[7-9],为区域及全球环境变化研究提供了大量基础性数据.
然而,作为古环境有效生物代用指标,亚化石摇蚊头壳的应用范围远不如孢粉和硅藻等其他生物指标.1990年以来,诸多学者对亚化石摇蚊头壳的前处理过程进行了不断改进,目前形成了一套“样品分散—过筛—挑拣—制片—鉴定”的标准流程[2].然而,手动将摇蚊头壳从沉积物中一一提取出来并封片是一项极其繁琐、耗时的工作,即使是熟练的工作人员也需要4~8 h(视头壳总数及样品类型而有所不同)才能完成一个样品的头壳挑拣及封片工作,这可能是限制亚化石摇蚊应用范围进一步推广的原因之一.因此,亟需寻找一种能提高前处理效率的方法,节约科研人员的时间及人力成本.
学者们尝试各种方法希望解决这一难题.ROLLAND N和LAROCQUE I发现煤油浮选方法可以快速、有效地提取摇蚊头壳,但对易被沉积物填充的较大壳体效果并不明显[10].同时,VERSCHUREN D和EGGERMONT H提出前处理过程中使用大孔径(>150 μm)分样筛可有效缩短样品处理时间,且对摇蚊古生态信息解译不会产生较大影响[11],但是,他们所用湖泊沉积物样品取自非洲,热带地区的摇蚊头壳相对较大,大孔径分样筛不会导致大量摇蚊壳体的遗失,但该方法对于高纬地区冷水湖泊中较小壳体可能并不适用. VELLE G和LAROCQUE I建议通过添加已知浓度的微球标记物快速估算沉积物摇蚊头壳浓度,但这对亚化石摇蚊种群组成及古生态解译研究作用并不明显[12].直到2011年,LAROCQUE-TOBLER I和OBERLI F尝试利用棉蓝(cotton blue)对沉积物摇蚊头壳进行染色[13],从而增强摇蚊头壳和其它杂质间对比度,虽然仍需将摇蚊头壳手动一一挑拣,但这无疑加快了工作人员识别、挑拣摇蚊头壳的速度,提高了样品处理效率.
鉴于棉蓝试剂及其他染色剂在生物样品处理中的成功应用[14],本文尝试利用另外一种染色剂-苯胺蓝-乳酚油试剂对沉积物摇蚊头壳进行染色处理,通过与未染色样品中头壳着色情况、种群组成特征等进行对比,探讨该染色剂是否能有效提高摇蚊亚化石提取效率,以寻求更多、更有效的样品处理方法,扩大摇蚊亚化石作为古环境有效代用指标的应用范围.
1 材料与方法
1.1 样品采集
共10个水体表层沉积物样品用于本实验染色分析.样品分别于2015年11月、2018年11月和2019年3月在华中科技大学、中南财经政法大学和中国地质大学(武汉)校园水体内采得,各水体具体信息见表1.采样过程使用1/32 m2彼得森抓泥器抓取水体沉积物,刮取表层0~1 cm样品并置于自封袋中,4 ℃冷藏以备分析测试.

表1 采样点属性信息Tab.1 Information of sampling sites
1.2 染色剂配制
将苯酚(20 mL)、乳酸(20 mL)、甘油(40 mL)及蒸馏水(20 mL)以1∶1∶2∶1比例配制,混合均匀后加入苯胺蓝(150 mg)将其配成1%的苯胺蓝-乳酚油试剂(后称“苯胺蓝染色剂”),待溶解稳定后进行使用.
1.3 样品染色及分析
每个表层样品称取质量相当的沉积物两份,置于100 mL烧杯中并分别标记为对照组(无染色)和实验组(苯胺蓝染色剂染色).两组样品按文献[2]提出的沉积物摇蚊头壳提取标准方法同时进行前处理:加入 10% KOH适量,置于75 ℃水浴锅中加热15 min后依次过 212 μm和90 μm分样筛, 将剩余样品反复冲洗后转移至烧杯中以备头壳提取或后续染色.
取清洗后的实验组样品,加入适量苯胺蓝染色剂(以残余样品能完全被染液淹没为准),后置于室温下静置染色约2 h(不同样品可酌情增减染色时间).将染色后的样品再次清洗过筛,用水洗去染液后,将筛网中剩余样品转移至生物解剖镜下,用镊子将摇蚊头壳手工拣出, 并用Hydromatrix®将其封片.对照组样品不进行染色,直接转移至镜下手动提取摇蚊头壳并进行封片处理.提取的所有摇蚊头壳在100~400倍生物显微镜(Nikon ECLIPSE E200)下进行属种鉴定,尽可能鉴定到种级水平.将完整的或具大部分颏的头壳计为一个,将半个颏的计为半个,不足一半的不统计.摇蚊属种鉴定主要依据文献[2,15]进行.
1.4 数据分析
利用摇蚊头壳浓度和属种数对各样点对照组和实验组样品中摇蚊丰度和属种丰富度进行评价.配对样本t检验用于判别对照组和实验组样品中的摇蚊头壳浓度和属种丰富度有无显著性差异.计算各个属种百分含量以衡量对照组和实验组中摇蚊种群组成,并在TILIA-GRAPH 1.7.16中制图,配对样本t检验在SPSS 25中实现.
2 结果与讨论
2.1 染色可提高摇蚊头壳提取效率
染色和未染色样品在显微镜下呈现出显著不同的效果.由图1可见:对照组样品中,摇蚊头壳与背景杂质色调较为一致,头壳与其它物质较难快速区分,增加了挑样难度;而经染色后的样品,摇蚊头壳呈现鲜艳的蓝色,在杂质较多的背景中非常突出,易于识别和快速挑取.实验表明:一个未染色沉积物样品摇蚊头壳提取所需时间约为3~5 h(所得头壳>50头),而染色样品所需时间仅为2~3 h,节省时间成本约30%~40%.此外,摇蚊头壳提取过程中,部分较小的头壳易于在水面上漂浮,其经染色后更容易引起实验人员的注意,提高挑样速度的同时可降低较小壳体遗漏的可能性.

框内目标即为摇蚊头壳,图片在相同放大倍数下拍摄,未经任何后期处理.图1 显微镜下摇蚊头壳样品图 Fig.1 Sample photos of the chironomid head capsules under microscope(a), (b)对照组;(c), (d) 实验组
2.2 染色对摇蚊鉴定的影响
100倍显微镜下,经苯胺蓝染色后的壳体不同部位着色对比明显(图2).
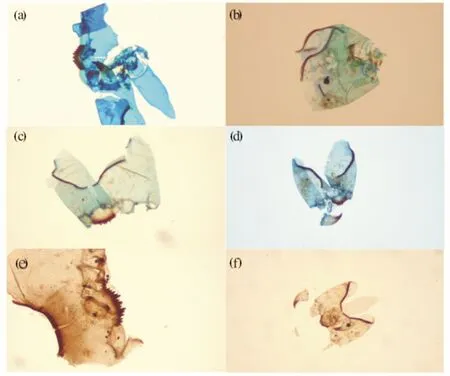
图2 100倍显微镜下染色组和未染色组摇蚊头壳对比图 Fig.2 Comparison of chironomid head capsules between stained and unstained group under 100× magnification (a), (b), (c), (d) 染色组,着色程度不同,其中图(c)为染色后一段时间出现褪色;(e), (f) 未染色组
图2中颏板(mentum)、上颚(mandible)、前上颚(premandible)及后头板(post-occipital plate)边缘等部位呈现褐色或黑褐色,而其余部位为浅蓝到蓝色.
400倍显微镜下,特征部位着色对比也非常明显(图3).如腹颏板是亚化石摇蚊鉴定中最为重要的特征之一,但一般较难识别其细微特征.经染色后的壳体上,腹颏板边缘着色较浅,而中部及基部呈现蓝色,影线纹也更加明显.由于前上颚为褐色,与壳体其它部位着色差异明显,有利于快速区分摇蚊亚科长附摇蚊族各属幼虫的壳体.此外,毛孔边缘较周边壳体位置着色略深,对快速识别部分属种(尤其长足摇蚊亚科和直突摇蚊亚科)特征非常有利.说明苯胺蓝染色能提高壳体特征部位与其它部位对比度,有利于鉴定特征及生物属种的快速识别.
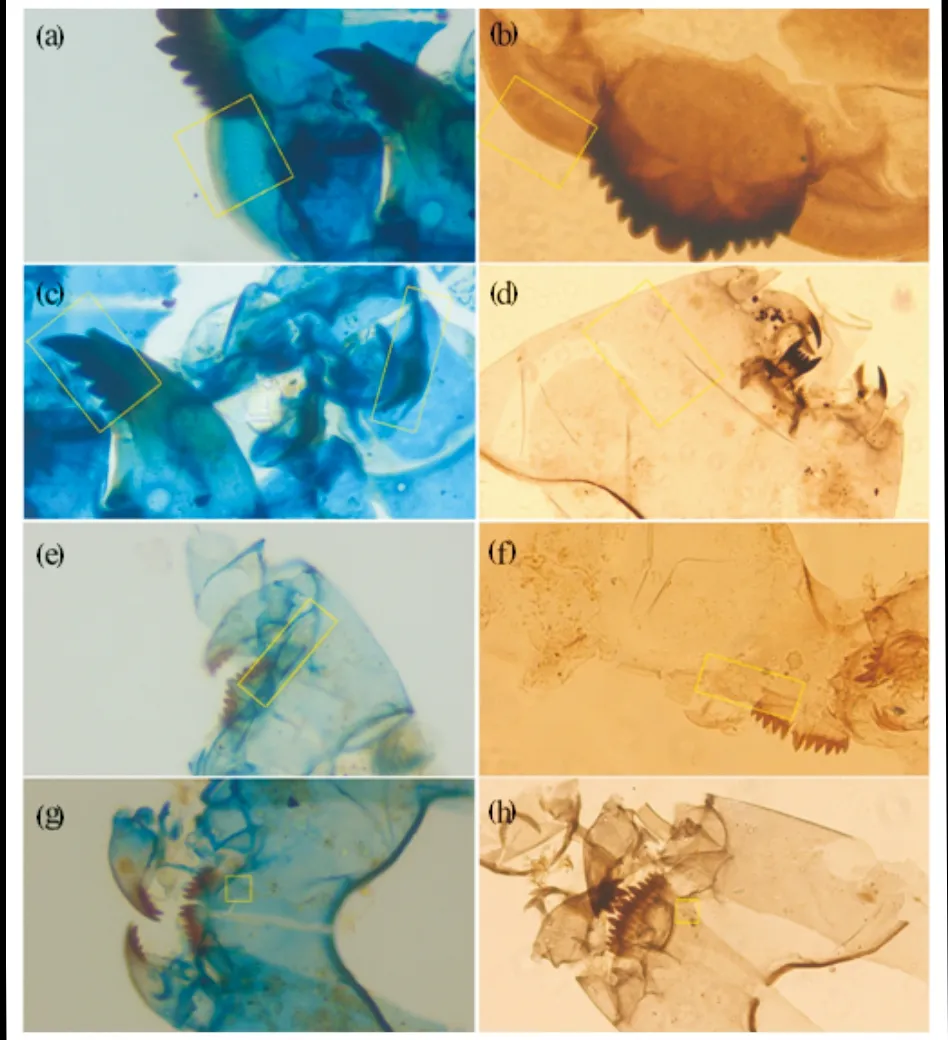
图3 400倍生物显微镜下染色与未染色头壳鉴定特征 Fig.3 Identification characteristics of stained and unstained chironomid head capsules under 400× magnification (a), (c), (e), (g) 染色组;(b), (d), (f), (h) 未染色组;(a),(b) Glyptotendipes腹颏板轮廓及影线纹; (c) Glyptotendipes上颚及前上颚; (d) Procladius腹部毛序; (e),(f) Tanytarsus腹颏板边缘; (g),(h) Polypedilum亚颏毛孔
2.3 摇蚊组成及种群特征
所有样品中摇蚊头壳浓度变化范围为1.9~22.1 ind·g-1湿样,其中最小值出现在实验组的L2样品,最大值为对照组的L4样品;摇蚊属种数在9~24之间变化,最小值为实验组的L1、L2和对照组的L2样品,最大值为对照组的L5(图4).图4表明,除L4和L5两个样点不同处理方式下头壳浓度出现较大偏差外,其余样点均匀分布于1∶1线两侧;50%的样点实验组摇蚊属种数高于对照组,说明苯胺蓝染色不会降低属种分类精度.同时,t检验结果表明对照组和实验组摇蚊头壳浓度和属种数均不存在显著差异(P>0.05),说明染色对以上摇蚊种群特征并未产生显著影响.
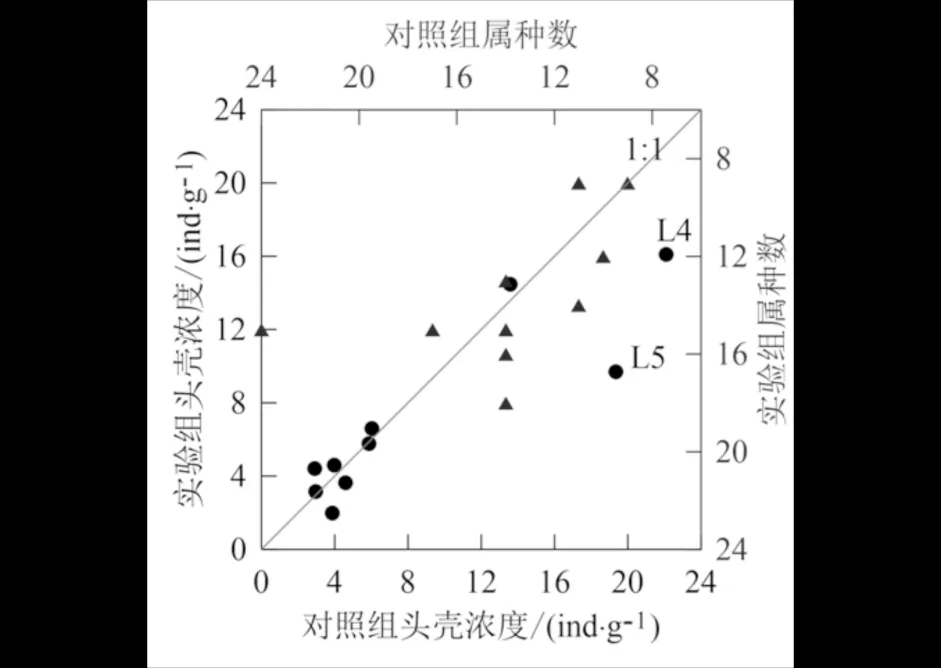
图4 对照组和实验组样品摇蚊头壳浓度和属种丰度对比图Fig.4 Comparison of head capsule density and species richness between control and experimental samples
主要摇蚊组合图谱(图5)显示,大部分样点对照组和实验组摇蚊种群组成上非常相似.将对照组和实验组中出现的各个属种百分含量进行对比(图6),结果表明:仅有L7样点中的Glyptotendipespallens-type以及L1和P9样点中的Cricotopussylvestris-type落在1∶1线的±10%偏差线以外,说明L1样点中的Cricotopussylvestris-type被高估,而L7中的Glyptotendipespallens-type和P9中的Cricotopussylvestris-type则被低估.10个样点中共有14个属种位于±5%~±10%偏差范围内,约占所有属种的5.2%,说明这些属种虽然存在高估或低估的现象,但误差较小.
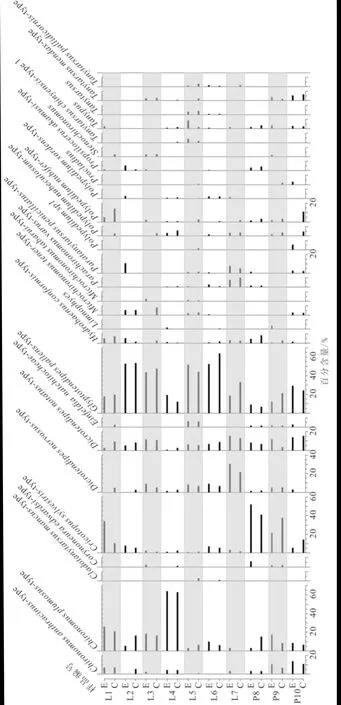
C为对照组;E为实验组.图5 主要摇蚊组合图谱Fig.5 Major chironomid assemblages
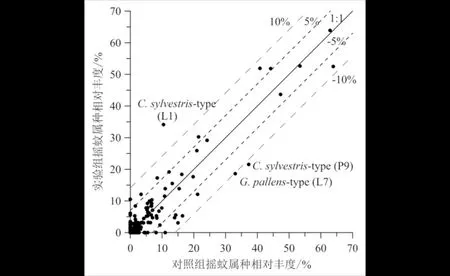
实线为两种处理方式中摇蚊属种相对丰度1∶1关系线,其±5%和±10%偏差线分别用短虚线、长虚线表示;图中标示了位于±10%偏差范围外的属种及其所属样品号.图6 对照组和实验组摇蚊属种相对丰度散点图 Fig.6 Comparison of taxa relative abundance in control and experimental samples
3 结论
(1)苯胺蓝染色能使沉积物摇蚊头壳挑拣时间缩短约30%~40%,有效提高头壳提取效率.
(2)苯胺蓝染色后摇蚊头壳各部分着色对比更加明显,方便了对特征部位的快速辨识,更有利于摇蚊头壳的鉴定和分类.
(3)染色后摇蚊头壳浓度及属种丰度并未发生显著变化,说明苯胺蓝染色过程不会对摇蚊古生态信息的解译产生显著影响.
