表没食子儿茶素没食子酸酯(EGCG)的磷脂纳米囊泡构建及其抗龋齿研究
2021-08-13寇先勇徐肖迪张成汪印元张子林祝红达
寇先勇,徐肖迪,张成,汪印元,张子林,祝红达
(湖北工业大学 生物工程与食品学院 & 发酵工程教育部重点实验室 & 工业微生物湖北省重点实验室,武汉 430068)
茶叶中含有丰富的天然多酚,具有广泛的生物活性如抗氧化,预防心血管疾病以及抗癌等,对预防人体龋齿也有重要的作用[1-2]. 龋齿作为一种常见的慢性疾病,尤其在儿童以及青少年人群中发病率较高,是由口腔细菌导致的多种复合因素作用下牙体硬组织的病变,其中变异链球菌(Streptococcusmutans,S.mutans)是常见的致龋菌[3]. 变异链球菌致龋的主要途径为细菌在口腔中的积累,加速蔗糖代谢为乳酸及其他有机酸并对牙齿表面粘附,因此通过阻止细菌在牙齿表面的粘附和积累这一过程可以大大降低龋齿的发病率[4-5]. 研究表明茶叶有效成分茶多酚中含量最多且活性最强的多酚物质表没食子儿茶素没食子酸酯(EGCG)特有的酚羟基结构使其具有高抗氧化能力,能抑制乳酸脱氢酶和致龋因子(GTF)的活性,降低致龋菌产酸能力、减少致龋菌在牙齿表面的粘附聚集从而抑制致龋菌的生长[6-7]. 由于EGCG结构的特异性,其在人体生理环境中易发生氧化、异构化和降解等,造成EGCG的活性降低,同时超强的极性使药物分子不易穿透细胞膜导致其在体内的生物利用度降低, 因此如何提高EGCG的稳定性及其生物利用度成为其发挥预防龋齿作用需要解决的关键问题[8].
EGCG与磷脂通过相互作用可以形成较为稳定的磷脂复合物,提高其稳定性的同时可以改善亲水性分子的脂溶性,增强跨生物膜的药物吸收[8]. 近年来,纳米包埋技术已成功地应用于活性有效成分及药品中,磷脂纳米囊泡作为亲水活性成分载体,对亲水性活性成分具有较强的亲和力,可以粘附在生物表面上提高活性成分的生物利用度[9-11]. 本文设计一种以EGCG磷脂复合物为基础的EGCG磷脂纳米囊泡,利用纳米囊泡的载体性能和磷脂复合物解决EGCG稳定性问题和吸收问题,延长活性成分在牙齿表面吸附时间,增强EGCG的防龋齿疗效.
1 材料与方法
1.1 材料与仪器
表没食子儿茶素没食子酸酯(EGCG,纯度 >98%)、蛋黄卵磷脂(纯度 ≥ 99%)(国药集团);吐温-80 (德国Biofroxx Gmbh);变异链球菌ATCC 25175(武汉中国典型培养物保藏中心);胰蛋白胨大豆琼脂培养基(TSA)、脑心浸液肉汤培养基(BHI)(青岛海博生物);其他试剂均为国产分析纯.
Pyris Diamond热重分析仪(美国Perkin-Elmer);UV-Lambda 35紫外-可见分光光度计(日本岛津);Zetasizer Nano ZS 90激光粒度仪(英国Malvern);Tecnai G220 S-TWIN透射电子显微镜(捷克FEI);Scientz-IID超声波细胞破碎仪(宁波新芝生物).
1.2 EGCG磷脂复合物及载EGCG纳米囊泡的制备
首先选择蛋黄卵磷脂与EGCG制备成磷脂复合物,然后采用乙醇注入法制备EGCG纳米囊泡[12-13]. 具体制备过程如下:称取处方量(表1)的蛋黄卵磷脂加入6 mL无水乙醇中,磁力搅拌至蛋黄卵磷脂充分溶解;加入处方量的EGCG,40 ℃恒温水浴下搅拌冷凝回流4 h即得EGCG磷脂复合物;称量0.2 g 吐温-80溶于10 mL超纯水,搅拌均匀成水相;在35 ℃水浴快速搅拌下,将上述EGCG磷脂复合物缓慢滴加至水相,搅拌过夜;将所得溶液置于细胞破碎仪中(4 s∶1 s,功率为60%)超声3 min,得EGCG纳米囊泡.
1.3 EGCG 磷脂复合物的表征
(1) EGCG磷脂复合物紫外光谱分析 将EGCG、卵磷脂、EGCG磷脂复合物分别溶于无水乙醇,其中复合物溶液中EGCG的浓度与EGCG溶液的浓度相同,复合物溶液中磷脂浓度与磷脂溶液的浓度相同,对3种溶液在200~400 nm波段进行紫外扫描分析.
(2) EGCG磷脂复合物差式扫描量热分析(DSC) 以空坩埚作为参比,设置升温速率为10 ℃/min、扫描范围为20~300 ℃、N2流速为30 mL/min,分别对磷脂、EGCG、EGCG磷脂复合物及EGCG与磷脂的物理混合物进行DSC测定.
1.4 以纳米特性为指标的纳米囊泡处方筛选
采用调整药脂比对处方进行优化,固定总体系体积为15 mL, 卵磷脂的浓度为10 mg/mL,调整EGCG量探索磷脂复合物所能达到的最佳比例,以最终所得EGCG纳米囊泡的粒径以及纳米囊泡分散系数(PDI)为评判标准,处方组成如表1.

表1 EGCG纳米囊泡处方Tab.1 Formulation of EGCG nanovesicle
1.5 EGCG纳米囊泡形貌表征
将EGCG纳米囊泡溶液用超纯水稀释15倍,滴加至铜网上,晾干后用2%磷钨酸进行负染,再次晾干后经透射电镜观察其形貌特征.
1.6 稳定性评价
将EGCG纳米囊泡分别置于室温及4 ℃冰箱保存,观察样品形状,同时测量其粒径观察粒径变化及样品的包封率.
1.7 EGCG的含量测定
1.7.1 EGCG标准曲线的绘制
因EGCG与卵磷脂的紫外特征峰相互重叠,直接进行测量会有较大误差,所以选用酒石酸亚铁比色法测定EGCG浓度. 取不同量的0.1 mg/mL EGCG标准溶液,加入5 mL显色剂(0.5 g酒石酸钾钠和0.1 g FeSO4·7H2O混合,去离子水溶解,100 mL容量瓶定容),磷酸盐缓冲液(0.1 mol/mL,pH 7.5)定容至25 mL,配制成浓度为1、2.5、5、7.5、15、20 μg/mL的EGCG标准溶液;以磷酸盐缓冲液作为空白,依次测定540 nm处不同浓度EGCG标准溶液的吸光度,并绘制吸光度与浓度的标准曲线.
1.7.2 纳米囊泡包封率(EE)的测定
取200 μL EGCG纳米囊泡加入2 mL无水乙醇,超声10 min破乳,取1 mL样品,加入5 mL显色剂,磷酸盐缓冲液定容至25 mL,测量其在540 nm处的吸光度,根据标准曲线计算相应浓度及质量,平行实验3次. 包封率计算方式如下:
式中:EE表示纳米囊泡包封率.
1.8 抗变异链球菌评价
在无菌操作台上,将变异链球菌(ATCC 25175)接种至BHI肉汤培养基中,37 ℃培养箱培养48 h,用无菌PBS将其稀释至菌含量为5×106CFU/mL,备用.
采用牛津杯法评价EGCG纳米囊泡的抗龋齿效果[14]. 使用BHI琼脂培养基各20 mL制作平板,在平板中等距放置4个直径为8 mm的牛津杯,分别加入200 μL无菌PBS,200 μL空白纳米囊泡(不含EGCG),200 μL EGCG溶液(1 mg/mL)和200 μL EGCG纳米囊泡(1 mg/mL),置于37 ℃恒温箱中培养24 h,测量各组抑菌圈大小,每组实验重复3次.
1.9 数据处理
实验数据以X±SD表示,采用GraphPad Prism 7.0软件进行单因素方差分析,在所有统计分析中, **表示P<0.01,***表示P<0.001,****表示P<0.0001.
2 结果与分析
2.1 紫外光谱分析
EGCG、卵磷脂、EGCG磷脂复合物的紫外扫描图见图1,图中EGCG、EGCG磷脂复合物在278 nm处有最强吸收峰,而磷脂溶液在此处的吸收较低. EGCG磷脂复合物的吸收值与EGCG溶液比较有降低,分析原因与磷脂包裹、吸附、偶联等方式致使EGCG与磷脂的极性部分发生较强的相互作用有关[8].
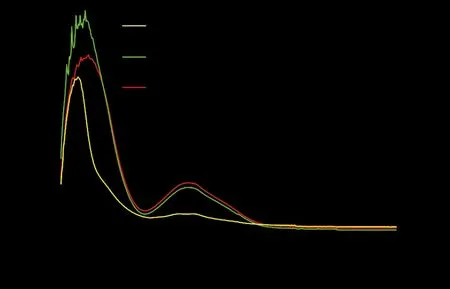
图1 EGCG、卵磷脂、EGCG磷脂复合物的紫外扫描图谱Fig.1 The UV spectra of EGCG, phospholipid and EGCG-phospholipid complex
2.2 差式扫描热量分析
固体活性成分的无定型状态是活性分子排列的无序状态,这种状态可能增加活性物质的生物利用度,促进活性分子的快速吸收[8,13]. 通过差式扫描热量分析考察磷脂复合物中EGCG晶型的变化. DSC结果显示(图2):卵磷脂和EGCG均存在单一的熔点峰;在EGCG与卵磷脂的物理混合物中,EGCG和磷脂的熔点峰均存在,只是受物理混合的影响峰位置有所偏移;在EGCG磷脂复合物中,EGCG的熔点峰完全消失,表明EGCG的晶型和状态受到影响发生了变化,即 EGCG分子中的极性基团与卵磷脂分子中的极性基团发生了相互作用,进而改变了EGCG的相变温度,特征吸收峰也随之发生了变化. EGCG在卵磷脂的脂肪酸链的包裹下,形成了新物相即EGCG磷脂复合物[13, 15].

图2 EGCG、磷脂、物理混合物和EGCG磷脂复合物的DSC图谱Fig.2 DSC thermograms of EGCG , phospholipids, physical mixture of EGCG and phospholipid and EGCG-phospholipid complex
2.3 纳米囊泡处方筛选及形貌表征
通过处方筛选发现随着EGCG含量增加,所得EGCG纳米囊泡的粒径以及PDI也随之增长,样品稳定性变差. 根据表1数据优选处方3所制备的EGCG纳米囊泡,粒径为119.36 nm,PDI为0.098,稳定性较好. 选择该样品进行形貌表征,采用透射电镜观察所制得EGCG纳米囊泡成均一球状,粒径在100 nm左右,与粒度仪测定结果一致,分散良好,无聚集(图3).

图3 EGCG纳米囊泡的透射电镜图Fig.3 TEM image of EGCG nanovesicles
2.4 稳定性考察
通过相隔固定时间监测EGCG磷脂纳米囊泡的粒径变化,其结果如图4所示,在连续14 d内其粒径基本无变化,说明EGCG纳米囊泡能够保持良好的稳定性. 根据1.7方法,测得EGCG含量与吸光度在1 μg/mL到20 μg/mL 范围内线性良好,得到线性回归方程为A=0.01119×C+0.00335,R2=0.9996.在稳定性考察中样品初始包封率为(81.24±0.18)%,2周后包封率略微下降至(77.16±0.34)%,说明EGCG纳米囊泡整体稳定性良好.

图4 EGCG磷脂复合物纳米囊泡的粒径变化Fig.4 Particle size changes of EGCG phospholipidcomplex nanovesicles
2.5 抑菌实验分析
采用牛津杯法评价EGCG纳米囊泡的抗龋齿效果. 根据图5所示,PBS组以及空白纳米囊泡组均未产生明显抑菌圈,而EGCG溶液的抑菌圈直径为(17.3±0.71) mm,说明了EGCG本身对于变异链球菌具有良好的抑制作用. 同时,EGCG纳米囊泡溶液的抑菌圈直径达到(19.2±0.40) mm,与EGCG溶液比较,抗龋齿效果显著性提高(P<0.01),可能是由于EGGC在模拟生理下因稳定性问题随时间产生一定的降解,导致了抗菌活性的下降[16]. 采用EGCG磷脂复合物制备纳米囊泡进行负载保护,提高了其生理环境中的稳定性,从而获得更好的抑菌效果.

图5 抑菌圈直径Fig.5 Diameter of inhibition zone
3 结语
通过将EGCG与卵磷脂制备为磷脂复合物增强其稳定性与脂溶性,增强跨生物膜的活性成分吸收. 采用简单、易操作的乙醇注入法,将磷脂复合物制备为纳米囊泡,增强其在口腔的粘附性及跨生物膜能力. EGCG磷脂复合物的紫外光谱、差式扫描热量图验证了EGCG磷脂复合物的形成;通过单因素优化实验,探索合适的药脂比,优选EGCG与卵磷脂的质量比为1∶10,所得EGCG纳米囊泡的粒径为119.36 nm,粒径分散均匀,包封率较高[(81.24±0.18)%].根据抗变异链球菌的实验结果显示EGCG纳米囊泡的抑菌圈可达到(19.2±0.40) mm,显著高于EGCG溶液,说明了EGCG纳米囊泡抑菌效果良好,在预防青少年龋齿方面具有一定应用前景.
