重离子束辐照选育高产细菌素植物乳杆菌
2021-08-11麻和平彭章普张文齐刘彩云王曙阳邵建宁
麻和平,彭章普,张文齐,刘彩云,王 洁,王曙阳,3, ,邵建宁,
(1.甘肃省科学院生物研究所 甘肃省微生物资源开发利用重点实验室,甘肃兰州 730000;2.甘肃省科学院,甘肃兰州 730000;3.中国科学院近代物理研究所,甘肃兰州 730000)
乳酸菌是国内外公认的对人类健康有益的食品级微生物,被广泛应用于食品、医药、农业等领域[1−3]。乳酸菌细菌素是乳酸菌通过核糖体途径产生的具有抗菌活性的肽和蛋白类物质,具有高效、安全无毒、无残留、无抗药性等优点,可以防止食品中腐败菌和病原菌的生长[4−7],已商品化的乳酸菌细菌素十分有限,仅限于Nisin和Pediocin PA-1等[8],生物合成量低也是细菌素应用受限的主要原因之一[9]。国内外许多实验室正致力于从不同原料中筛选高产菌株、发酵培养基和发酵条件优化、诱变育种、原生质体融合、基因工程方法、群体感应系统调控等方面提高乳酸菌细菌素合成量,开展乳酸菌细菌素的研究、开发与利用[10−13],大范围的收集、筛选乳酸菌株,挖掘广谱、高效的乳酸菌细菌素已经成为生物防腐剂研究领域中正在研究的热点[14−17]。甘肃牧区具有独特的生态环境,当地少数民族牧民沿用传统制作方法制作的发酵乳品,作为自然长期驯化乳酸菌的载体,含有丰富的乳酸菌资源[18−19]。
针对从传统发酵乳制品中初步分离筛选的乳酸菌细菌素产量偏低、基因工程菌公众接受度低等商业化瓶颈,本研究以甘肃牧区传统发酵乳制品中分离筛选出的产细菌素植物乳杆菌Lp1作为出发菌株,应用相比传统诱变源具有高突变率、广突变谱的重离子束辐照微生物育种技术[20−24],开展产细菌素植物乳杆菌重离子束辐照诱变育种及其突变株产细菌素性能遗传稳定性研究,解决前期分离筛选的乳酸菌产细菌素量偏低的问题,建立和优化产细菌素植物乳杆菌重离子束辐照诱变育种研究方法,为选育高产细菌素植物乳杆菌提供一定的参考依据。
1 材料与方法
1.1 材料与仪器
出发菌:植物乳杆菌Lp1(Lactobacillus plantarumLp1) 分离自甘南牧区牦牛酸奶,指示菌:大肠埃希氏菌(Escherichia coli)ATCC25922、金黄色葡萄球菌(Staphylococcus aureus)CMCC26003 甘肃省科学院生物研究所食品生物技术室保藏;MRS肉汤、MRS琼脂、营养肉汤(NB)、营养琼脂(NA)培养基 青岛海博生物技术有限公司。
JA2003N 电子天平 上海精密仪器有限公司;DELTA 320 pH计 梅 特 勒-托 利 多(METTLER TOLEDO)集团;DG-1 多功能培养箱 上海医疗器械修造厂;LDZF-75L-II 立式高压蒸汽灭菌器 上海申安医疗器械厂;SW-CJ-2D 超净工作台 苏州净化设备有限公司;BH-2 显微镜 日本奥林巴斯(中国)有限公司;HiCC-S1型全自动菌落计数及抑菌圈测量仪杭州万深检测科技有限公司;动菌落计数及抑菌圈测量仪 杭州万深检测科技有限公司。
1.2 实验方法
1.2.1 重离子束12C6+辐照诱变 将甘油法保藏的出发菌株植物乳杆菌Lp1接种于MRS肉汤培养基,37 ℃恒温活化、扩大培养后,在无菌条件下将待辐照菌悬液1.5 mL置于35 mm无菌塑料平皿中,利用中科院近代物理所重离子加速器浅层辐照终端提供的80 MeV/u,剂量率20 Gy/min 的12C6+重离子束进行辐照处理[25],辐照剂量分别为 0(CK)、50、100、150、200、300 Gy,每个剂量设置3个平行。
1.2.2 重离子束12C6+辐照致死率及正、负突变率测定
1.2.2.1 辐照致死率测定 将不同剂量辐照后的菌悬液10倍系列稀释后,选择适宜稀释度,采用平板倾注法,用MRS琼脂进行菌落计数,每个稀释度3个平行,37 ℃恒温倒置培养48 h。菌落计数参照GB 4789.2-2016食品安全国家标准食品微生物学检验菌落总数测定。

1.2.2.2 辐照正、负突变率测定 将不同剂量辐照后的菌悬液10倍系列稀释后,选择适宜稀释度的稀释匀液,采用涂布平板法,在MRS琼脂平板37 ℃恒温倒置培养24~48 h,挑选出所有单菌落,分别接入装有10 mL MRS肉汤培养基的试管中,37 ℃恒温静置培养24 h后,4 ℃静置24 h。以大肠埃希氏菌为指示菌对分离菌株发酵上清液进行抑菌试验,统计分离得到菌株总数和与出发菌株抑菌圈直径比较变化大于10%的分离菌株数,进行正负突变率计算。

1.2.3 高产细菌素乳酸菌突变株筛选
1.2.3.1 初筛 将重离子束辐照后菌悬液,稀释一定浓度,采用涂布平板法,在MRS琼脂平板37 ℃培养24~48 h,无菌条件下挑出单个菌落,接入装有10 mL MRS 肉汤培养基的试管中,37 ℃恒温培养24 h后,4 ℃静置24 h,取发酵上清液以大肠埃希氏菌为指示菌进行抑菌试验,测量抑菌圈直径,挑选正突变株进行保藏[26]备用。
1.2.3.2 复筛 初筛的正突变株用MRS 肉汤培养基于37 ℃培养24 h,8000 r/min离心10 min,收集上清液。上清液用1 mol/L NaOH调pH至5.5,排除有机酸的干扰;再在80 ℃保温10 min,排除过氧化氢的干扰;最后经0.22 μm滤膜过滤除菌[27]备用。以大肠埃希氏菌和金黄色葡萄球菌为指示菌对上述处理后上清液分别进行抑菌试验,测量抑菌圈直径,挑选对2种指示菌抑菌圈直径均大于出发菌抑菌圈直径的突变株为复筛菌株进行保藏。
1.2.3.3 高产细菌素乳酸菌突变株遗传稳定性测试 将复筛的高产细菌素乳酸菌突变株接种于MRS肉汤培养基,37 ℃恒温培养24 h,连续传代5次,对每一代菌株发酵液按1.2.4的方法处理后进行抑菌实验,测定抑菌圈直径,评价突变株遗传稳定性[28]。
1.2.4 抑菌实验 采用双层琼脂扩散法[29],在水平放置的无菌培养皿中先加入10 mL灭菌后冷却至50 ℃左右的1%琼脂水溶液,至完全凝固后均匀摆放6个牛津杯,再加入15 mL含大肠埃希氏菌或金黄色葡萄球菌约106CFU/mL的48 ℃左右的营养琼脂培养基,等完全凝固后取出牛津杯,在形成的圆孔内,3个孔分别滴加分离菌株待测样液100 μL,其余3个孔分别滴加出发菌株待测样液100 μL,37 ℃培养20 h,用HiCC-S1型全自动菌落计数及抑菌圈测量仪测定抑菌圈直径。
1.3 数据处理
所有数据采用Micorsoft Excel 2019软件进行统计分析,数据以平均值±标准偏差表示。
2 结果与分析
2.1 辐照剂量对致死率的影响
对重离子束12C6+不同剂量辐照后的植物乳杆菌Lp1菌悬液,采用倾注平板法菌落计数,计算出各个辐照剂量致死率,以辐照剂量为横坐标,致死率为纵坐标,绘制致死率曲线。结果如图1所示,出发菌株植物乳杆菌Lp1对重离子束的辐照较为敏感,通过不同剂量的重离子束12C6+辐照后,随着重离子束辐照剂量的增大,诱变致死率不断升高。在整个辐照试验中,当辐照剂量从50 Gy升高至300 Gy时,出发菌株植物乳杆菌Lp1的致死率从58.62%上升至86.3%,致死率提高了27.68%。其中,当辐照剂量从50 Gy升高至150 Gy时致死率提高了5.83%,剂量从150 Gy升高至300 Gy时致死率提高了21.85%。本次研究最大辐照剂量为300 Gy,植物乳杆菌Lp1的致死率达到了86.3%,如果想得到更高致死率剂量,可以在大于300 Gy的重离子束辐照剂量下再进一步增大辐照剂量来研究[30−31]。
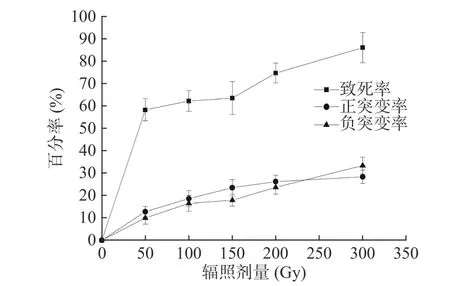
图1 重离子束辐照诱变植物乳杆菌Lp1致死曲线和正、负突变率曲线Fig.1 Lethality curv and positve & negative mutation rate curve of Lactobacillus plantarum Lp1 irradiatied by heavy ion beams
2.2 辐照剂量对正负突变率的影响
在分离菌株发酵上清液抑菌试验中,将与出发菌株抑菌圈直径比较变化大于10%的菌株定义为突变菌株,抑菌圈直径比较变化在10%内的菌株定义为非突变菌株,统计分离的正负突变株菌株数和总菌数。以辐照剂量为横坐标,正、负突变率为纵坐标,绘制正、负突变率随辐照剂量的变化曲线。正、负突变率曲线如图1所示,菌株的正突变率随着辐照剂量的增大逐步提升,当辐照剂量为 300 Gy时,正突变率达到28.28%,相比其它辐照剂量可筛选得到较多正突变菌株,试验结果表明在本次研究设置辐照剂量下,重离子束12C6+辐照最佳剂量为300 Gy。菌株的负突变率也随着辐照剂量的增加而升高,辐照剂量为300 Gy时,负突变率达到33.33%。在 300 Gy时,正、负突变率均达到最高,同时致死率也达到86.3%。根据相关诱变研究得到的现代育种理论表明,当被诱变微生物致死率为 70%~80%时,所采用的辐照剂量下,菌株更容易出现较高的正突变菌株,当在更高的致死率下,虽然突变率可能较高,但在此情况下,正、负突变率都会较高[32−33]。
2.3 高产细菌素乳酸菌突变菌株筛选
2.3.1 初筛 对重离子束12C6+300 Gy剂量辐照后的出发菌株Lp1菌悬液稀释液涂布平板,分离单菌落,以大肠埃希氏菌为指示菌,对分离菌株发酵上清液进行抑菌试验,分离出了抑菌圈直径大于出发菌株抑菌圈直径10%的正突变株28株。出发菌株Lp1的平均抑菌圈直径为(15.57±0.41)mm,从正突变菌株中再选出抑菌圈直径大于出发菌株抑菌圈直径15%的菌株9株,结果见表1。由表1可知,初筛的9株菌株其抑菌圈直径较出发菌株抑菌圈直径提高了16.83%~20.55%,均与出发菌株Lp1对大肠埃希氏菌的平均抑菌圈直径差异极显著(P<0.01)。
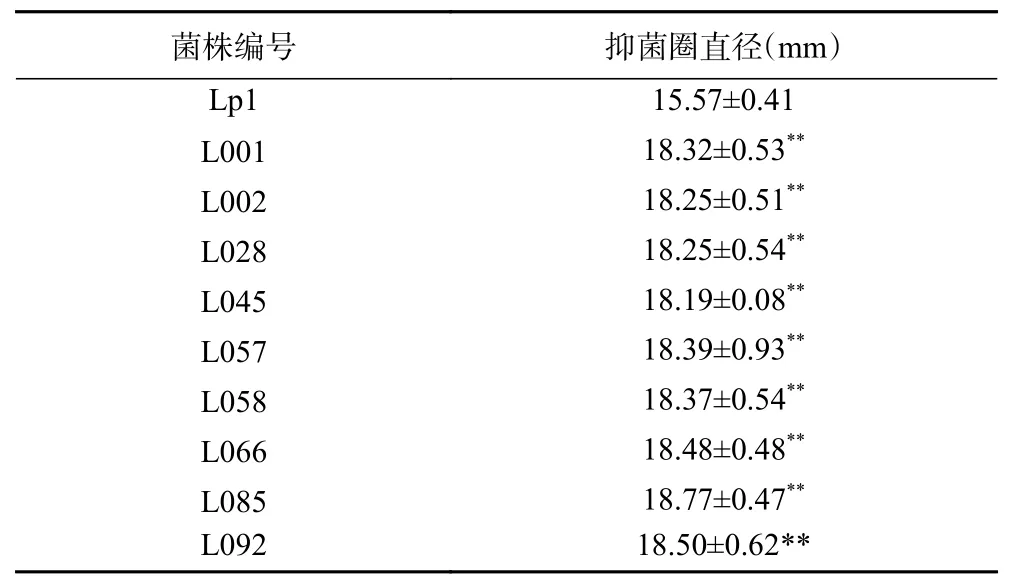
表1 重离子辐照诱变植物乳杆菌Lp1初筛突变株Table 1 Positve mutation strains of Lactobacillus plantarum Lp1 of preliminary screening
2.3.2 复筛 对初筛出的9株菌株进行复筛,9株菌株发酵液经除有机酸、过氧化氢、菌体处理后,以大肠埃希氏菌、金黄色葡萄球菌分别为指示菌,进行抑菌圈试验,结果见表2。由表2 可知,初筛的9株突变株发酵液排除有机酸、过氧化氢、菌体干扰后,仍有明显抑菌效果。复筛出2株抑菌圈较大菌株,L092菌株对大肠埃希氏菌、金黄色葡萄球菌的抑菌圈直径分别为(16.95±0.53)、(17.48±0.54)mm,比出发菌株Lp1对大肠埃希氏菌和金黄色葡萄球菌的抑菌圈直径提高20.64%和17.16%。L085菌株对大肠埃希氏菌、金黄色葡萄球菌的抑菌圈直径分别为(16.77±0.23)、(17.03±0.23)mm,比出发菌株Lp1对大肠埃希氏菌和金黄色葡萄球菌的抑菌圈直径提高19.36%和14.14%。L092、L085菌株对大肠埃希氏菌、金黄色葡萄球菌的抑菌圈直径与出发菌株抑菌圈直径差异极显著(P<0.01)。
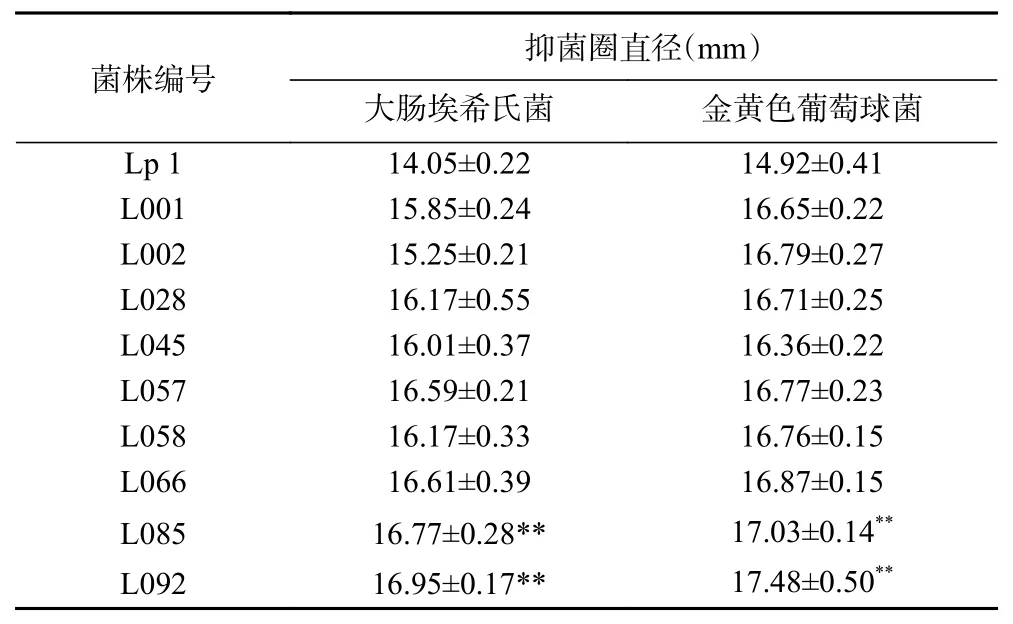
表2 重离子辐照诱变植物乳杆菌Lp1复筛突变株Table 2 Positve mutation strains of Lactobacillus plantarum Lp1 of secondary screening
2.4 高产细菌素突变菌株遗传稳定性
为了验证复筛高产细菌素突变菌株遗传稳定性,对复筛菌株Lp085、Lp092进行遗传稳定性试验,37 ℃恒温,MRS 肉汤培养基的试管中培养24 h,连续传代5次,菌株每一代发酵液均经除有机酸、过氧化氢、菌体处理后进行抑菌圈试验,结果如表3所示,2株复筛菌株Lp085、Lp092连续传代5次,Lp092菌株对大肠埃希氏菌、金黄色葡萄球菌的抑菌圈直径分别在 16.41~16.95、16.66~17.48 mm,Lp085菌株对大肠埃希氏菌、金黄色葡萄球菌待抑菌圈直径分别在 16.01~16.77、16.36~17.03 mm,连续传代5次,各代的抑菌圈直径变化均在5%之内,说明菌株Lp085、Lp092具有较稳定的产细菌素遗传特性。
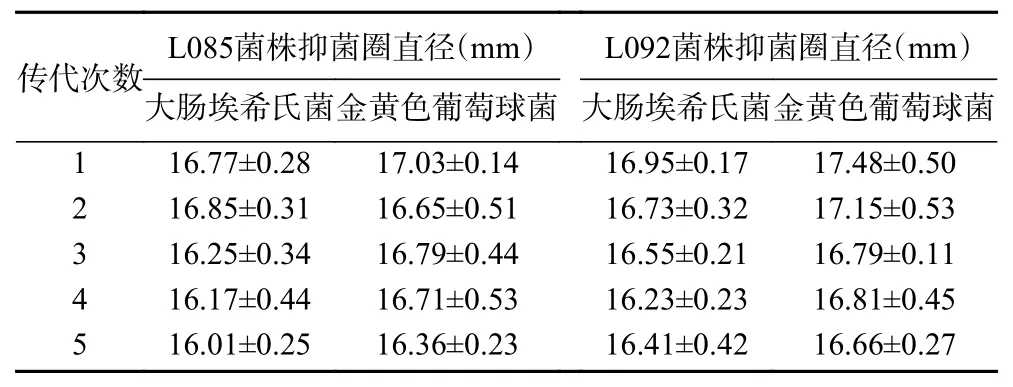
表3 复筛突变株突的遗传稳定性研究Table 3 Genetic stability of mutant strain of secondary screening
3 结论
采用重离子束12C6+对产细菌素乳酸菌出发菌株植物乳杆菌Lp1进行辐照选育,辐照剂量在50~300 Gy时,致死率呈上升趋势,出发菌株植物乳杆菌Lp1的致死率从58.62%上升至86.3%。在辐照剂量300 Gy时,出发菌株植物乳杆菌Lp1的正突变率为28.28%,负突变率为33.33%。在辐照剂量300 Gy菌悬液中选育出高产细菌素突变菌株Lp085、Lp092,Lp092对大肠埃希氏菌、金黄色葡萄球菌待抑菌圈直径分比出发菌株Lp1抑菌圈直径提高21.40%、18.9%;Lp085对大肠埃希氏菌、金黄色葡萄球菌待抑菌圈直径比出发菌株Lp1抑菌圈直径提高 20.27%、16.91%。经过连续传代5次试验,2株菌株Lp085、Lp092均具有良好的产细菌素遗传稳定性。本研究表明,利用重离子束12C6+辐照产细菌素乳酸菌可以得到高产细菌素的突变菌株,可用于高产细菌素乳酸菌种的选育,为高产细菌素乳酸菌选育提供了一定理论依据和试验基础。
