南极磷虾壳聚糖、壳寡糖的制备与品质鉴定
2021-08-11刘小芳苗钧魁冷凯良徐玉成
于 源,刘小芳,苗钧魁,冷凯良,2, ,徐玉成
(1.中国水产科学研究院黄海水产研究所, 农业农村部极地渔业开发重点实验室, 山东青岛 266071;2.青岛海洋科学与技术国家实验室, 海洋药物与生物制品功能实验室, 山东青岛 266200;3.辽渔集团有限公司, 辽宁大连 116001)
几丁质是自然界中含量第二丰富的大分子物质,仅次于纤维素,主要β(1→4)连接的N-乙酰氨基葡萄糖构成,在虾蟹、昆虫的甲壳与一些真菌、海藻的细胞壁中广泛分布[1−2]。壳聚糖是几丁质的衍生物,一般使用浓碱对几丁质进行脱乙酰处理制备。壳聚糖的脱乙酰度大于50%,溶于酸溶液[3]。壳聚糖具有良好的抗菌活性、成膜特性、生物相容性、吸附性,同时具有较高的机械强度与可降解性[4−6],广泛应用于食品保鲜防腐、水的净化处理、抗菌膜的制备、伤口复原等方面[7−8]。壳寡糖是壳聚糖的降解产物,聚合度小于20,分子量低于3.9 kDa,相比于壳聚糖黏度更低。研究表明,壳寡糖对革兰氏阴性菌株的抗菌效果与其脱乙酰度和聚合度有关,壳寡糖的C-2位游离氨基含量越高,抗菌活性越强[9−10]。壳寡糖可溶于水的特性使得其显示出比壳聚糖更优异的生物活性如抗菌、抗氧化、抗肿瘤、自由基清除、抗炎症、降血压、降血糖等,这些活性的发挥还与其聚合度与脱乙酰度息息相关[10−11]。酸水解与酶水解为壳寡糖最常见的制备方法,其中酶法降解反应条件温和,易于控制,有利于壳寡糖功能基团的保持与聚合度的控制,有效保持壳寡糖的生物活性[12]。
南极磷虾是南极生态系统的重要组成部分,南极海域多种高等生物以南极磷虾为食[13]。南极海洋生物资源保护委员会(CCAMLR)数据显示,南极磷虾的总生物量约六千余万吨,其中2018年捕捞量为31万余吨[14]。南极磷虾是一种优质蛋白原,含有人类全部必需氨基酸,生物学价值高于牛奶与禽蛋,同时氨基酸评分符合FAO的要求[15]。南极磷虾脂质富含n-3不饱和脂肪酸、磷脂型EPA、磷脂型DHA等成分,对人类健康十分有益[16]。目前,南极磷虾的开发与研究以蛋白质与磷虾油为主,南极磷虾油等产品已作为保健品上市并获得消费者认可[17]。南极磷虾的虾头、虾壳占南极磷虾总重的75%左右,大部分作为低值水产饲料进行开发,甚至作为废弃物处理[18]。作为一种天然的生物资源,南极磷虾壳中具有较高含量的甲壳素[19]。从南极磷虾壳中对该类聚合物进行分离提取,进一步开发壳聚糖与壳寡糖,有利于南极磷虾资源的高效综合利用。
本研究以南极磷虾壳为原料,经乳酸-中性蛋白酶处理获得几丁质,以氢氧化钠溶液进行脱乙酰处理,探究碱溶液浓度、脱乙酰温度、处理时间对壳聚糖产品脱乙酰度的影响,选取适宜的条件制备壳聚糖;选取商品化壳聚糖酶对壳聚糖进行酶法降解,探究酶添加量与酶解时间对壳寡糖产量的影响,选取适宜的条件制备壳寡糖,并对壳寡糖的结构特性进行表征,以期为南极磷虾产品开发与该资源的综合利用提供数据支撑。
1 材料与方法
1.1 材料与仪器
南极磷虾冷冻虾壳 辽渔集团提供,冷冻虾壳经融化后于60 ℃烘干至恒重,粉碎后使用;中性蛋白酶 5 万U/g,索莱宝公司;壳聚糖酶 10 万U/g,最适pH5.6~5.8,最适温度50~60 ℃,上海源叶生物科技有限公司;乙腈 色谱纯,购德国Merck公司;D2O Sigma公司;乳酸、盐酸、氢氧化钠、溴化钾、甲醇等试剂 分析纯,国药集团化学试剂有限公司。
Nexus470红外光谱仪 美国Thermo公司;Agilent 1290-6460三重四级杆质谱仪 Agilent公司;AVANCE III 400核磁共振仪 德国Bruck公司。
1.2 实验方法
1.2.1 南极磷虾壳聚糖制备 本研究中南极磷虾壳聚糖与壳寡糖的制备工艺流程如图1所示。

图1 南极磷虾壳聚糖与壳寡糖的制备工艺流程Fig.1 The preparation process of chitosan and chitooligosaccharide from Antarctic krill
参考前期报道的工艺进行南极磷虾甲壳素的制备,以南极磷虾壳为原料,使用10% (V/V)的乳酸,以1:15 (m/V)的料液比处理4 h脱钙;脱钙后添加1% (m/V)的中性蛋白酶,以1:15 (m/V)的料液比,在pH 6的环境下酶解3 h脱蛋白,制备南极磷虾甲壳素[20]。在南极磷虾壳聚糖的制备过程中,使用氢氧化钠对南极磷虾甲壳素进行脱乙酰处理,每组实验量取5 g甲壳素,以60% (m/V)氢氧化钠、处理温度100 ℃、处理时间3 h、反应体系料液比1:20 (m/V)作为初始处理条件,分别探究氢氧化钠溶液浓度(40%、50%、60%和70%)、不同处理温度(90、100、110和120 ℃)、不同处理时间(1、2、3、4和5 h)各因素条件下的脱乙酰效果。脱乙酰处理后获得的壳聚糖各试样使用蒸馏水洗至中性,以壳聚糖质量的剩余量与脱乙酰度作为检测指标,评价南极磷虾甲壳素的脱乙酰效果。
1.2.2 南极磷虾壳寡糖的制备 参考赵华等[21]报道,采用壳聚糖酶酶解法制备南极磷虾壳寡糖,并结合本研究中壳聚糖酶的最适条件,对酶解条件稍作调整。称取1 g南极磷虾壳聚糖,根据壳聚糖酶的最适pH与最适温度,在100 mL pH为5.8的0.2 mol/L乙酸-乙酸钠缓冲溶液体系下完全溶解。分别探索壳聚糖酶添加量分别为0.05%、0.1%、0.2% (m/V)时南极磷虾壳寡糖生成量随酶解时间(1~16 h)的变化规律,确定适宜的南极磷虾壳寡糖制备条件。
1.2.3 指标测定
1.2.3.1 南极磷虾壳聚糖剩余量与脱乙酰度测定壳聚糖剩余量(%)的计算方式如下:
壳聚糖剩余量(%)= 脱乙酰反应后壳聚糖质量(g)/脱乙酰反应前壳聚糖质量(g)×100
壳聚糖脱乙酰度测定参考GB 29941-2013中所述电位滴定法[22],以盐酸溶液溶解南极磷虾壳聚糖,使用氢氧化钠溶液滴定,通过滴定过程中出现的两个“突跃”点之间消耗的氢氧化钠量可以计算待测样品的脱乙酰度,计算方式如下:
脱乙酰度(%)=16.1×氢氧化钠溶液浓度(mol/L)×氢氧化钠消耗体积(mL)/ 壳聚糖质量(g)×100
1.2.3.2 南极磷虾壳聚糖品质指标测定 根据各因素实验结果选取适宜的脱乙酰条件制备南极磷虾壳聚糖,测定终产品的粘均分子量。南极磷虾壳聚糖粘均分子量(Mw)采用乌氏粘度计法测定,通过测得的壳聚糖特性粘度[η],根据公式计算粘均分子量[23]:
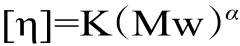
其中K值为1.81×10−3,α值为0.93。
壳聚糖的水分含量测定参考GB 5009.3所述[24];灰分含量测定参考GB 5009.4所述[25];酸不溶物含量测定参考SC/T 3403-2018所述[26];壳聚糖溶液pH的测定参考GB 29941-2013所述[20]。
1.2.3.3 南极磷虾壳寡糖含量的测定 参考李克成等[27]报道的方法,使用3, 5-二硝基水杨酸法(DNS法)测定南极磷虾壳寡糖的含量(以还原糖含量计)。根据壳寡糖的单糖组成,DNS标准曲线测定实验采用浓度梯度为0~1 mg/mL的N-氨基葡萄糖溶液为标准品(标准曲线方程:y=0.347x−0.029,R2=0.999)。取1 mL待测酶解液与1 mL DNS混合煮沸5 min,迅速冷却后定容至10 mL,于520 nm波长下测定光密度值,代入DNS标准曲线,计算待测酶解液中壳寡糖的浓度。向酶解液中添加5倍体积(V/V)乙醇沉淀壳寡糖,烘干称重,计算壳寡糖得率,计算方式如下:
南极磷虾壳寡糖得率(%)= 酶解后乙醇沉淀所得壳寡糖质量(g)/ 酶解前壳聚糖质量(g)×100
1.2.4 南极磷虾壳寡糖的结构表征
1.2.4.1 红外光谱分析 南极磷虾壳寡糖的红外光谱分析参考高雪梅等[28]报道,量取1 mg干燥的南极磷虾壳寡糖,加入100 mg溴化钾在研钵中粉碎均匀,以压片机压制透明薄片后于红外光谱仪扫描,进行红外光谱解析。红外光谱条件:扫描波段4000~500 cm−1;扫描次数20次。
1.2.4.2 核磁共振分析 南极磷虾壳寡糖的1H、13C核磁共振分析参考程功等[29]报道并稍作调整。量取10 mg 南极磷虾壳寡糖以1 mL D2O溶解,并交换三次,使样品中氢原子完全被氘原子置换,将溶液转移至核磁管,加入一滴氘代丙酮作为内标物,于核磁共振仪进行1H、13C图谱的分析。
1.2.4.3 质谱分析 南极磷虾的质谱分析参考张静文等[30]报道并稍作调整。南极磷虾取南极磷虾壳寡糖溶解于70% (V/V)甲醇溶液,离心后过0.22 μm滤膜,使溶液浓度达到10 pmol/L,进行质谱分析。质谱条件:负离子ESI模式;进样量5 μL;流动相100%甲醇;流速0.3 mL/min;洗脱时间3 min;质量扫描范围m/z 50~1000;吹干与喷雾气体:N2。
1.3 数据处理
各实验设置三平行,数据以“平均值±标准偏差”表示,使用SPSS 22.0软件完成各数据分析。
2 结果与分析
2.1 南极磷虾壳聚糖的制备
本研究使用较高浓度的碱溶液完成南极磷虾甲壳素的脱乙酰处理,考察了氢氧化钠浓度、脱乙酰反应温度、反应时间三个因素对壳聚糖脱乙酰度的影响,如图2所示。结果表明,随着氢氧化钠浓度的逐渐增大,壳聚糖产品的脱乙酰度从14.75%上升至82.20%,壳聚糖的余重也呈下降趋势,说明乙酰基的脱除效果逐渐增强。在理想状态下,全部由N-氨基葡萄糖(Mw=179 Da)组成的壳聚糖占由乙酰氨基葡萄糖(Mw=221 Da)组成的甲壳素重量的81.0%。本研究中,使用50%氢氧化钠溶液制备的壳聚糖脱乙酰度仅47.05%,脱乙酰反应尚未完全。在已有的报道中,使用50%的氢氧化钠进行脱乙酰反应的报道较多,如Bernardi等[5]处理成品甲壳素,所得壳聚糖脱乙酰度为72.3%;Knidri等[31]使用微波辅助脱乙酰法于100 ℃处理虾壳2.5 h,所得壳聚糖脱乙酰度为75.08%~81.50%;Tokatlı等[32]在100 ℃处理虾壳12 h,所得壳聚糖脱乙酰度为80.06%。本研究的结果表明,从不同来源的虾壳制备壳聚糖的难易程度有显著不同,为提高南极磷虾壳聚糖的制备效果,需适当提高氢氧化钠的使用浓度。使用70%氢氧化钠的处理组,壳聚糖的脱乙酰度虽然提高至82.20%,但壳聚糖的余重降至78.31%,低于81.0%,表明高浓度的氢氧化钠溶液处理可能导致壳聚糖结构的破坏。相比之下60% (m/V)氢氧化钠的处理组的壳聚糖余重为81.55%,脱乙酰度为73.79%,该数值介于上述报道之间(72.3%~81.5%),表明该条件较适用于南极磷虾壳寡糖的制备。

图2 氢氧化钠溶液浓度、脱乙酰反应温度、反应时间对南极磷虾壳聚糖脱乙酰度与余重的影响Fig.2 Effects of sodium hydroxide concentration, deacetylation temperature and reaction time on the deacetylation degree and residual weight of Antarctic krill chitosan
反应温度的提高有利于乙酰基脱除效果的提升,在60% (m/V)氢氧化钠浓度下,反应温度为90 ℃时,脱乙酰度为42.52%;温度升高至110 ℃时,壳聚糖的脱乙酰度升高至80.95%,此时壳聚糖余重为80.10%,因而该温度为较合适的反应温度。在已有报道中,大部分壳聚糖脱乙酰过程采用90~110 ℃高温反应。Mohanasrinivasan等[33]报道以70%氢氧化钠于室温处理虾壳72 h,所得壳聚糖脱乙酰度为74.82%,由于反应温度较低,需要更高的碱溶液浓度以及较长时间的反应才能达到良好的脱乙酰效果,表明较高的反应温度可显著提升脱乙酰反应效率。然而,进一步提高反应温度至120 ℃时,壳聚糖的脱乙酰度没有提升,而壳聚糖的余重下降至78.13%,样品的颜色呈黄色,表明高温可能引起了壳聚糖产品的结构破坏。
处理时间的延长有利于甲壳素乙酰基脱除效果的提升,在氢氧化钠浓度为60%,反应温度100 ℃的条件下,脱乙酰度从第1 h的55.81%上升至4 h的81.01%,而后基本保持稳定,因而脱乙酰反应时间可控制在4 h。
壳聚糖在制备过程中一般使用约50%的氢氧化钠在100 ℃左右完成脱乙酰处理,但从不同来源的虾壳制备的壳聚糖,其脱乙酰条件和脱乙酰效果均有差异,脱乙酰度介于59.7%~81.5%之间[5,31−34],低于本研究(表1)。与虾壳来源的壳聚糖不同,Yen等[35]以40%氢氧化钠于105 ℃处理蟹壳3 h,所得壳聚糖脱乙酰度达93.3%;Kumari等[34]以40%氢氧化钾于90 ℃处理蟹壳6 h,所得壳聚糖脱乙酰度为70%,上述报道表明以不同水产品原料制备壳聚糖的难易程度与产品品质不尽相同。本研究通过提高氢氧化钠溶液浓度与处理温度,在不影响南极磷虾壳聚糖品质的前提下,有效提升了壳聚糖的脱乙酰效果。

表1 不同脱乙酰条件对虾壳壳聚糖脱乙酰度的影响Table 1 Effect of different deacetylation conditions on chitosan deacetylation degree from shrimp
100 g南极磷虾壳在乳酸-中性蛋白酶处理后,使用60% (m/V)的氢氧化钠于110 ℃脱乙酰处理4 h完成南极磷虾壳聚糖的最终制备,最终获得4.09 g壳聚糖,其脱乙酰度为85.74%,属中脱乙酰度壳聚糖[26]。经测定,南极磷虾壳聚糖粘均分子量为305.65 kDa,水分含量4.66%,灰分含量0.98%,酸不溶物含量0.40%,10 g/L壳聚糖水溶液pH为7.8。本研究中制备的壳聚糖水分含量低于10%,灰分含量低于1%,酸不溶物含量低于1%,符合食品级壳聚糖的理化指标要求[25]。
2.2 南极磷虾壳寡糖的制备
壳聚糖酶添加量和酶解时间对南极磷虾壳寡糖产生量的影响如图3所示。结果表明,添加0.05%、0.1%壳聚糖酶的实验组,在酶解6 h后,酶解产生还原糖的速率显著提升,酶解至第16 h时,还原糖含量分别为1.96 mg/mL与2.99 mg/mL,不过,还原糖的含量仍然处于上升趋势,这是由于壳聚糖酶的添加量不足,导致酶解反应尚不完全。继续提高壳聚糖酶添加量至0.2%,酶解4 h后,还原糖生成量迅速提高,至酶解第14 h时,还原糖的含量趋于平稳,酶解过程基本完全。酶解第16 h时还原糖含量为5.27 mg/mL,因此壳寡糖的酶解制备条件确定为壳聚糖酶添加量0.2%,酶解16 h,该条件下,从南极磷虾壳聚糖制备壳寡糖的产品得率为46.0%。
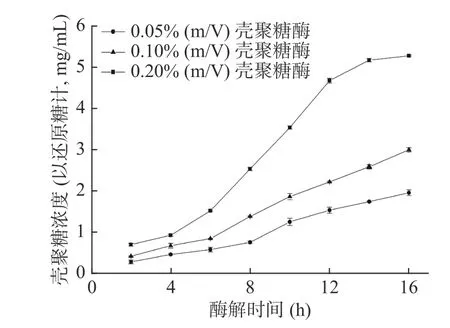
图3 壳聚糖酶添加量与酶解时间对壳寡糖产量的影响Fig.3 Effect of chitosanase addition and hydrolysis time on the yield of chitooligosaccharide
2.3 南极磷虾壳寡糖的结构表征
南极磷虾壳寡糖经凝胶过滤层析脱盐后,使用红外光谱、质谱与核磁共振仪器分析法对壳寡糖的结构特征进行鉴定。南极磷虾壳寡糖的红外光谱图如图4所示,通过壳寡糖的红外光谱可获得一系列表征壳寡糖结构的吸收峰,包括3400 cm−1附近的O-H振动收缩峰与N-H非对称拉伸峰,2885 cm−1处的C-H振动收缩峰[36],1560 cm−1处的N-H2振动吸收峰[8],1409 cm−1处的C-H2振动吸收峰[12],1153 cm−1处的糖环C-O-C振动收缩峰[8],1072 cm−1处的糖环C-O振动收缩峰[12]。而表征乙酰基的特征峰如1650 cm−1的酰胺I键吸收峰与1373 cm−1的酰胺III键吸收峰的峰强度相对偏低,表明南极磷虾壳寡糖的脱乙酰程度较高。
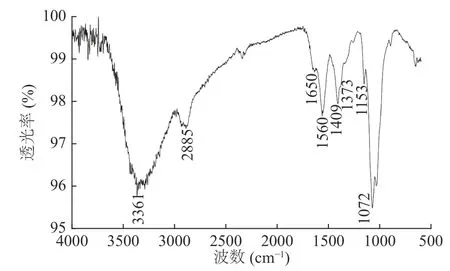
图4 南极磷虾壳寡糖的红外光谱谱图Fig.4 Infrared spectrum of Antarctic krill chitooligosaccharide
通过核磁共振技术进一步对壳寡糖的结构特征进行鉴定。1H谱各氢信号化学位移归属如图5与表2所示。酶法降解使得壳寡糖还原端产生α与β异构现象,谱图中5.22 ppm与4.45 ppm处分别代表壳寡糖α与β异头氢信号[37]。壳寡糖H-2位的信号峰出现在2.70 ppm附近,表明壳寡糖的游离氨基含量较高[37−38],当壳寡糖的乙酰基含量较高时,H-2信号位于较低场3.1~3.2 ppm处,本研究中壳寡糖在该处信号峰强度较弱,表明其乙酰基含量较低,而表征乙酰基甲基氢的信号出现在1.96 ppm[8]。壳寡糖其他氢原子信号峰集中于3.3~3.9 ppm之间,其中H-3与H-4位的氢 信号位于3.61~3.85 ppm,H-5与H-6位的氢信号位于3.31~3.55 ppm[39]。13C谱各碳信号化学位移归属如图5与表3所示。根据谱图与报道,壳寡糖的异头碳信号位于101.33 ppm,其余各碳信号分别为C-2: 56.33 ppm,C-3: 69.95 ppm,C-4: 76.18 ppm,C-5: 74.8 ppm,C-6: 60.04 ppm[8]。乙酰基的羰基碳与甲基碳的信号位于181.4 ppm与23.3 ppm,峰强度相对较低。当寡糖C-4位有糖苷键连接时,C-4与C-3信号峰位于较低场,同样在谱图中体现[39]。以上各碳信号均显示出壳寡糖的结构特征,且未出现任何杂质的信号峰,表明壳寡糖样品的纯度较高。

图5 南极磷虾壳寡糖的1H与13C NMR谱图Fig.5 1H and 13C NMR spectra of Antarctic krill chitooligosaccharide

表2 南极磷虾壳寡糖的1H NMR化学位移归属Table 2 The 1H NMR chemical shift assignment of Antarctic krill chitooligosaccharide

表3 南极磷虾壳寡糖的13C NMR化学位移归属Table 3 The 13C NMR chemical shift assignment of Antarctic krill chitooligosaccharide
南极磷虾壳寡糖的聚合度通过ESI负离子质谱技术进行解析,壳寡糖的质谱谱图如图6所示。结果显示m/z 339、560、721三个碎片峰的丰度较高,其中m/z 339碎片峰代表由两分子氨基葡萄糖GlcN构成的二糖;m/z 560代表由两分子GlcN与一分子乙酰氨基葡萄糖GlcNAc构成的三糖;m/z 721代表由三分子GlcN与一分子GlcNAc构成的四糖。上述结果表明寡糖主要由二糖、三糖、四糖构成。除此之外,四糖碎片峰m/z 661 (GlcN)4、五糖碎片峰m/z 823 (GlcN)5;m/z 882 (GlcN)4-GlcNAc同时产生。m/z 984表征六糖(GlcN)6的碎片峰丰度较低,表明南极磷虾壳寡糖样品的聚合度为2至5(表4)。壳聚糖产品未显示出单一的聚合度,且酶解终产物中未检测到单糖的碎片峰,因而本研究中用到的壳聚糖酶的水解方式为内切[40]。质谱结果显示壳聚糖酶解终产物为二糖(GlcN)2与三糖(GlcN)2-GlcNAc,但未显示任何表征三糖(GlcN)3的碎片峰,推测该壳聚糖酶通过识别(GlcN)2重复单元的两端的糖苷键完成对壳聚糖的酶解,因此酶解过程中未产生(GlcN)3片段。本研究中酶解终产物与大肠杆菌外源表达的壳聚糖酶CDA20与芽孢表达的壳聚糖酶BsCsn46A的酶解终产物三糖(GlcN)3有所不同[37,41]。

表4 南极磷虾壳寡糖质谱碎片峰解析Table 4 MS fragmentation analysis of Antarctic krill chitooligosaccharide
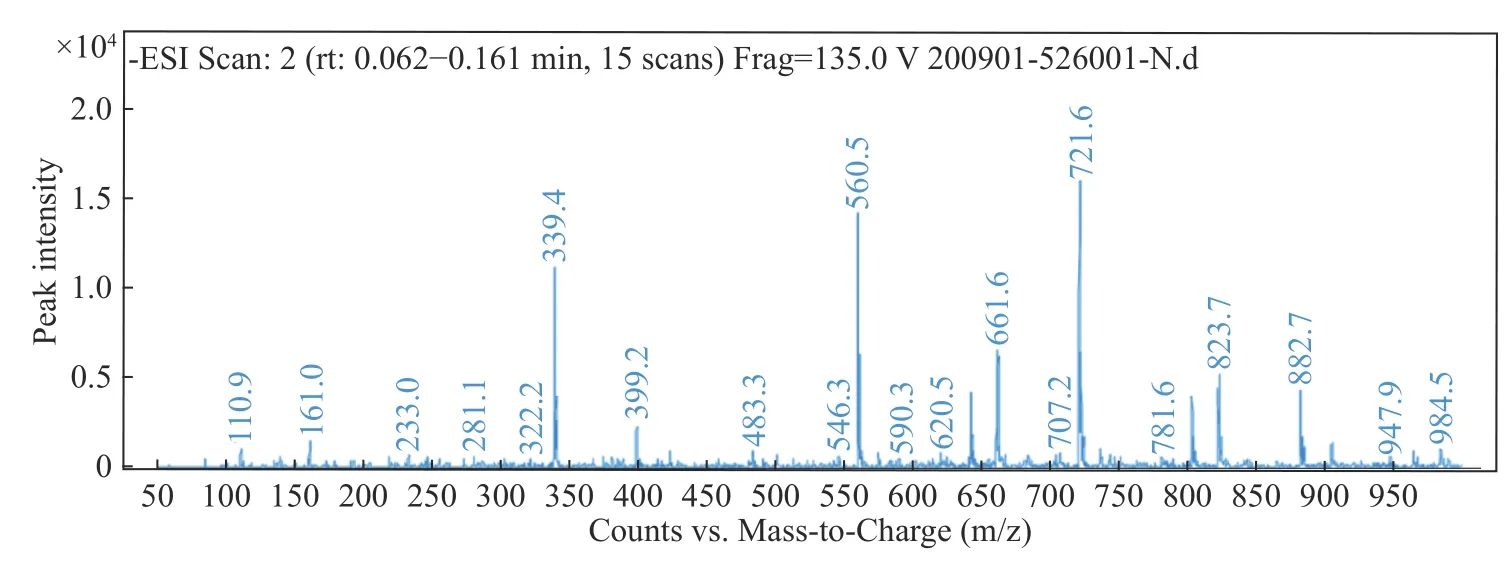
图6 南极磷虾壳寡糖的ESI负离子质谱谱图Fig.6 ESI negative ion mass spectrometry of Antarctic krill chitooligosaccharide
3 结论
本研究在乳酸-中性蛋白酶处理制备甲壳素的基础上,探索了碱溶液脱乙酰制备南极磷虾壳聚糖与酶法制备南极磷虾壳寡糖的工艺,制备了较高品质的南极磷虾壳聚糖与壳寡糖。其中壳聚糖的脱乙酰度为85.74%,粘均分子量为 305.65 kDa,水分含量4.66%、灰分含量0.98%、酸不溶物含量0.40%,理化指标均符合食品级壳聚糖的要求;以适宜的酶解条件,从南极磷虾壳聚糖制备的壳寡糖产品得率为46.0%,仪器分析结果显示南极磷虾壳寡糖主要由二糖、三糖与四糖构成。鉴于壳聚糖与壳寡糖良好的抗菌、抗氧化等活性,从南极磷虾壳中大量制备较高品质的壳聚糖与壳寡糖,进一步拓展南极磷虾产品在食品工业的应用范围,实现南极磷虾资源的全效综合利用。
