半固态酶解法制备全谷物多肽及其抗氧化、ACE抑制活性的研究
2021-08-11曹梦笛周浩纯章期博刘新旗
曹梦笛,周浩纯,李 赫, ,张 健,章期博,刘新旗,刘 宇
(1.北京工商大学, 食品与健康学院, 国家大豆加工产业技术创新中心, 北京 100048;2.中国检验检疫科学研究院, 综合检测中心, 北京100123;3.北京协同创新研究院, 北京100094)
燕麦中营养物质含量丰富,含有大量可溶性膳食纤维、维生素、矿物质及生物活性成分,蛋白质含量约占20%,在粮食作物中最高且必需氨基酸含量高出其他粮食作物两倍左右[1]。荞麦中蛋白质含量约占12%,蛋白质成分优质且有独特的氨基酸组成比,含有人体必需的8种氨基酸[2]。燕麦和荞麦与其它谷物相比,蛋白质含量较高且氨基酸种类丰富,因此,其营养价值引起了学者们的关注。
谷物肽是以谷物中的蛋白质为原料,经过蛋白酶酶解、食品加工或者微生物发酵等方法制备的具有特殊生理功能的生物活性肽,是谷物蛋白水解的中间产物,一般少于20个氨基酸,分子量<5800 Da[3]。已有研究表明谷物肽具有抗氧化[4−5]、抗高血压[6]、降血糖[7],抗肿瘤[8]、抗炎及降低胆固醇[9]等生理活性。ACE在肾素-血管紧张素系统中通过催化血管紧张素-1转化为血管紧张素-2,加强心肌收缩,引起血压升高。因此,通过抑制体内ACE来降低血管紧张素-2的浓度具有重要意义。Hernández-Ledesma等[10]研究表明,低分子量的ACE抑制肽具有强降血压活性。谷物肽可作为ACE抑制剂,通过与ACE活性位点结合,发挥降血压作用[11]。抗氧化活性被认为是谷物肽的另一基本功能,体内的氧化应激反应会对蛋白质和DNA等生物分子造成不同程度的损害,从而导致多种疾病如:炎症、心血管疾病和癌症等[12−13],因此研究具有抗氧化作用的天然谷物肽具有重要的意义。已有研究表明,低分子量生物活性肽可直接被人体肠道吸收,从而能更好的发挥生物活性[14]。
饮食中的谷物蛋白消化利用率低,特别是老年人和胃肠道疾病患者,通过消化谷物蛋白获取营养能力较弱,提高谷物中蛋白质营养的利用率成为谷物加工的关注点。固态发酵或液态酶解谷物蛋白是获取谷物肽的普遍方式,半固态酶解蛋白工艺研究鲜有报道。半固态酶解谷物蛋白是以谷物面团为底物,经调制搅拌器捏合及控温酶解等步骤,可得含多肽的酶解谷物粉。相对于液态酶解,半固态酶解后的谷物面团更易烘干,有利于谷物、谷物蛋白的大规模生产加工。
本实验以燕麦和荞麦两种谷物作为研究对象,以酶解产物中多肽含量、抗氧化活性和ACE抑制活性为指标确定了半固态酶解最佳工艺参数,以研究酶解产物的抗氧化、降血压作用,为谷物高值化加工和功能性食品配料领域的应用提供理论支持。
1 材料与方法
1.1 材料与仪器
燕麦及荞麦 均为市售商品;碱性蛋白酶(200 U/mg) 帝斯曼公司;中性蛋白酶(100 U/mg)丹尼斯克;凯氏定氮消化片 德国福斯公司;三吡啶基三嗪(tripyridyltriazine,TPTZ) 博奥拓达科技有限公司;谷胱甘肽、马尿酰-组氨酰-亮氨酸、马尿酸上海源叶生物科技有限公司;血管紧张素I转换酶(ACE) 美国Sigma公司。其他试剂 均为AR级别。Milli-Q Integral 5纯水仪 美国Millipore公司;KJELTEC 8000全自动凯式定氮仪 丹麦FOSS公司;Cary 60 UV-Vis紫外-可见分光光度计美国Agilent科技有限公司;1260 Infinity高效液相色谱 美国Agilent科技有限公司;THZ-92B旋涡振荡器 上海博讯实业有限公司;HH.S11-4电热恒温水浴锅 上海博讯实业有限公司;X-30R台式高速离心机 美国Beckman公司;cientic EASY-nLC 1000 System(Nano HPLC)高效液相色谱 美国Thermo公司;NH 1500L调制搅拌器 山东旺林机械有限公司。
1.2 实验方法
1.2.1 两种谷物粉半固态酶解工艺的优化 燕麦及荞麦分别经粉碎机粉碎,过200目筛;在调质搅拌器内加水和碱性蛋白酶与中性蛋白酶以2:1的比例配制的复合酶,捏合形成谷物面团,50 ℃控温酶解;酶解结束后,将酶解面胚放入隧道炉中(温度80 ℃)进行烘干;最后,用粉碎机对其进行粉碎得到含多肽的半固态酶解谷物粉并过200目筛。在半固态酶解过程中,复合酶添加量分别为1.25%、2.50%和3.75%,酶解时间分别为0.5、1.0、1.5、2.0、2.5、3.0、3.5及4.0 h。
1.2.2 半固态酶解产物肽含量的测定
1.2.2.1 半固态酶解物中多肽液的提取与纯化 称取酶解后谷物粉5.000 g,溶于125 mL蒸馏水中,在气浴恒温振荡器中37 ℃恒温振荡30 min;将振荡后的谷物粉溶液在4000 r/min,25 ℃恒温离心30 min并收集上清液;将第1次离心所得沉淀添加125 mL蒸馏水进行二次浸提,将两次离心所得上清液混合并经MD34-5M(300 Da)膜过滤提纯,可得多肽提取液,测其多肽含量及抗氧化和ACE抑制活性。
1.2.2.2 多肽含量的测定 参考GB/T 6432-2018[15]并加以改进。称取20.000 g多肽提取液用22.5%三氯乙酸溶液定容至50 mL,摇匀后静置10 min,使用中速滤纸过滤以除去提取液中的谷物蛋白。取10 mL滤液至消化管,加入12 mL浓硫酸及两片消化片,于消化器中180 ℃消化30 min除去样品中的水分,再调至420 ℃消化60 min。消化结束后冷却至室温并用凯氏定氮仪检测样品中的氮含量,通过公式1计算可得多肽含量。

式中:M为每100 g谷物粉中的多肽含量(g/100 g);ω为提取液中的多肽含量(mg/mL);m1为两次提取所得上清液总质量(g);m2为两次提取所得离心液总质量(g);K为蛋白转化系数(燕麦为5.83,荞麦为6.25)。
1.2.3 两种谷物粉液态酶解工艺方法 参考文献[16−18]并略作修改。将谷物粉200目过筛,加水配制成蛋白含量为8%的溶液,用1 mol/L NaOH及1 mol/L HCl调pH至7.0,加入复合蛋白酶,50 ℃恒温酶解4 h,在整个酶解过程中对酶解液进行恒速搅拌,酶解完成后,将温度升至85 ℃灭酶10 min。液态酶解液在4000 r/min,25 ℃恒温离心30 min,收集上清液。
1.2.4 酶解方式对酶解产物肽的蛋白转化率的影响肽的蛋白转化率是一定质量谷物粉中多肽含量与蛋白质含量的比值。在酶添加量为3.75%,酶解时间为3 h的酶解条件下用液态酶解和半固态酶解的方式酶解燕麦粉,在酶添加量为1.25%,酶解时间为1 h的条件下酶解荞麦粉,通过测定蛋白转化率比较两种酶解方式对谷物蛋白酶解效果的差异。
1.2.5 酶解产物分子量分布测定 参考GB/T 22492-2008的方法并加以改进[19]。燕麦在酶解时间为3 h,荞麦酶解时间为1 h的条件下,研究酶添加量及酶解方式对酶解产物分子量分布的影响。将标准品配制成1 mg/mL的溶液,样品和标品均需过0.22 μm微滤膜,随后在HPLC-DAD系统中过TSKgelG2000swxL 300 mm×7.8 mm色谱柱进行检测分析。流动相为乙腈:水:三氟乙酸=45:5:0.1,进样体积为10 μL,流速为30 mL/h,检测波长为220 nm。用峰面积归一法可计算到不同肽段相对分子质量的分布情况,按式2进行计算:

式中:X为试样中某相对分子质量肽段所占总肽段的质量分数,%;A为某相对分子质量肽段的峰面积;A总为各相对分子质量肽段的峰面积之和。
1.2.6 酶解产物中多肽抗氧化活性测定
1.2.6.1 总抗氧化能力(FRAP法)测定方法 参考文献[18]并略作修改。燕麦在酶解时间为3 h,荞麦酶解时间为1 h的条件下,研究酶添加量及酶解方式对酶解产物总抗氧化能力的影响。配制0.3 mol/L pH=3.6醋酸缓冲液、20 mmol/L FeCl3溶液以及10 mmol/L TPTZ溶液,并以10:1:1的比例混合。配制不同浓度(0.2、0.5、1.0、1.5、1.8、2.0 mmol/L)的FeSO4·7H2O标品,绘制标准曲线。取30 μL样品溶液加入4 mL FRAP试剂,加1 mL水,充分混合并于37 ℃静置15 min,在593 nm波长测其吸光度。以谷胱甘肽做参照,图4样品多肽浓度及谷胱甘肽浓度均为1 mg/mL。
1.2.6.2 羟自由基清除能力测定方法 参考文献[20]并略作修改。燕麦在酶解时间为3 h,荞麦酶解时间为1 h的条件下,研究酶添加量及酶解方式对酶解产物羟自由基清除能力的影响。取0.5 mL样品溶液依次加入1 mL 6mmol/L FeSO4、1 mL 6mmol/L H2O2混匀,静置10 min;加入1 mL 6 mmol/L水杨酸混匀静置30 min,510 nm波长下测吸光度即A1。按式3计算谷物肽羟自由基清除率:
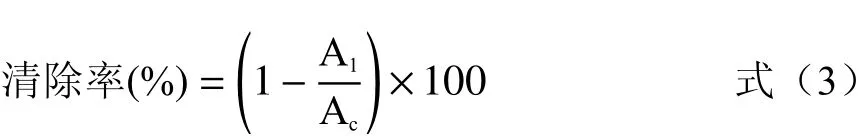
式中:Ac为空白组,使用蒸馏水替代样品;A1为样品组,加入标品或者样品的吸光度。
1.2.7 酶解产物中多肽ACE抑制活性测定 参考Boschin等[21]和Wu等[22]的方法加以改进。燕麦在酶解时间为3 h,荞麦酶解时间为1 h的条件下,研究酶添加量及酶解方式对酶解产物ACE抑制能力的影响。配制缓冲液一(100 mmol/L Tris-HCOOH,300 mmol/L NaCl,pH=8.3),缓冲液二(100 mmol/L Tris-HCOOH,300 nmol/L NaCl,10 mol/L ZnCl2,pH=8.3),配制1 mmol/L HHL溶液,1 mU ACE 溶液。取100 μL HHL加入1.5 mL离心管中,加入10 μL样品,37℃水浴反应15 min;预反应结束后加入15 μL ACE溶液反应1 h后加125 μL 0.1 mol/L HCl中断反应。样品过0.22 μm水相膜,滤液备进样用。仪器自动进样后,可根据马尿酸标品出峰时间以及峰面积确定马尿酸的生成量,计算样品的ACE抑制活性大小,同时做空白对照。图6样品多肽浓度为1 mg/mL。按式4计算谷物肽ACE抑制率:
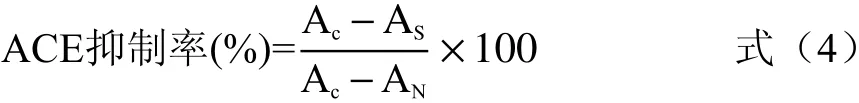
式中:Ac为不加抑制剂,用缓冲液一代替样品测得的峰面积;AN为不加ACE,用缓冲液二代替ACE酶测得的峰面积;As为样品组测得的峰面积。
色谱条件:HPLC 系统:HPLC-DAD;色谱柱:Eclipse Plus C18分 析用色谱 柱(5 μm,4.6 mm×150 mm);流速:30 mL/h;检测波长:228 nm;进样量:10 μL;流动相:水:乙腈=80:20。
1.3 数据处理
2 结果与分析
2.1 谷物粉半固态酶解参数对酶解产物肽含量的影响
本课题选用碱性蛋白酶与中性蛋白酶以2:1的比例配制的复合酶。复合酶比单一酶有更多的酶切位点,可更充分地水解谷物蛋白,且碱性蛋白酶和中性蛋白酶酶切位点为疏水性氨基酸和芳香族氨基酸,对多肽的抗氧化及ACE抑制活性均有积极影响。
为避免不同样品中蛋白含量差异的影响,试验中酶添加量为加酶量与谷物粉中蛋白质含量之比。由图1可得,相比酶添加量为1.25%及2.50%组,燕麦粉中酶添加量为3.75%时,所得多肽含量较高且在酶解时间为3 h达到最高,随着酶解时间增加,多肽含量增加不显著(P>0.05)。酶解时间0~1.0 h时,荞麦粉中多肽含量迅速上升,且当酶解时间为1 h,酶添加量为1.25%、2.50%、3.75%时酶解所得多肽含量无显著差异(P>0.05),继续延长酶解时间荞麦粉中肽含量呈平衡趋势,当蛋白酶达到一定量时,暴露的谷物蛋白质基本达到完全水解,加大添加量并不会对多肽含量产生明显影响[23]。综上可得,以酶解产物中多肽含量为标准,燕麦最佳半固态酶解条件为:酶解时间3 h,酶添加量3.75%;荞麦为:酶解时间1 h,酶添加量1.25%。林洋等[24]以豆粕为原料,设计单因素试验确定复合酶的组成,结果表明在碱性蛋白酶:中性蛋白酶=2:1、温度45 ℃、时间4.5 h酶解条件下大豆蛋白酶解效果最好。
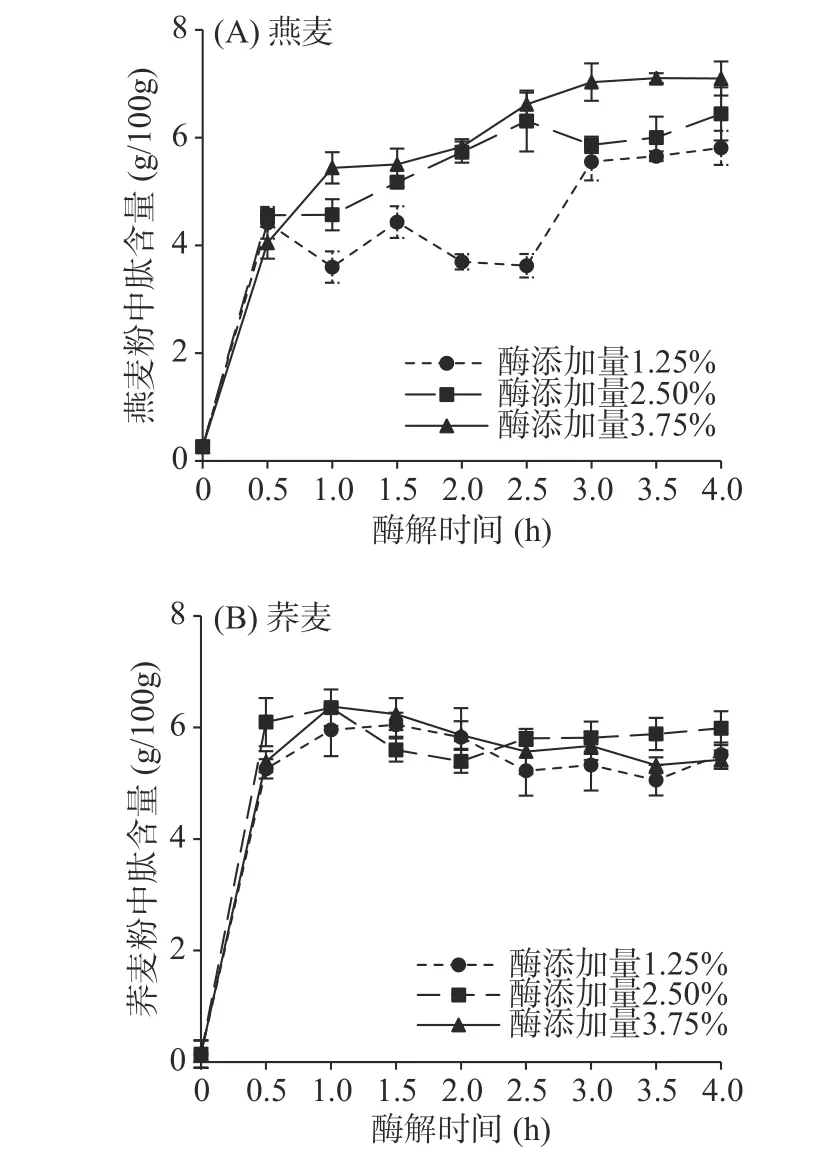
图1 半固态酶解工艺参数对(A)燕麦和(B)荞麦酶解产物肽含量的影响Fig.1 Effect of semi-solid enzymatic hydrolysis process parameters on peptide content of (A) oat and (B) buckwheat enzymatic hydrolysis products
2.2 酶解方式对酶解产物肽的蛋白转化率的影响
液态酶解是提高谷物蛋白转化率的主要方式,实验对半固态酶解能否获得相同的蛋白转化率进行了探讨,分析半固态酶解工艺的可行性。由图2(A)和(B)可得燕麦和荞麦的半固态酶解蛋白转化率显著高于(P<0.05)液态酶解。半固态酶解底物中的部分蛋白被淀粉包裹,复合酶会集中酶解裸露出的谷物蛋白,相比液态酶解,不仅半固态酶解底物浓度相对较高,而且调制搅拌器多方向不断捏合酶解谷物面团,也能够促进酶与底物蛋白接触。相同酶添加量时,半固态酶解显示出更高的蛋白转化率。
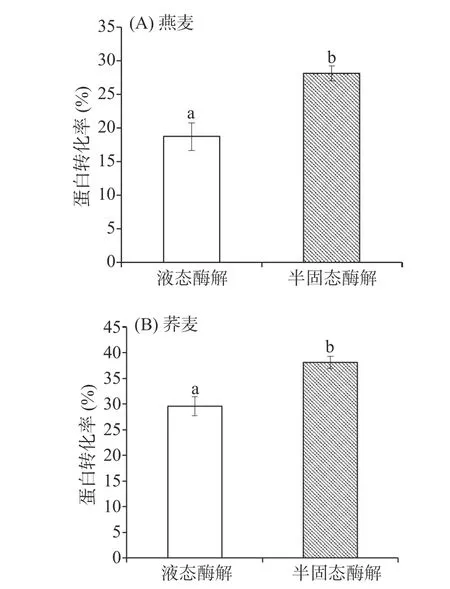
图2 酶解方式对(A)燕麦和(B)荞麦的蛋白转化率的影响Fig.2 Effect of enzymatic hydrolysis on the protein conversion rate of (A) oat and (B) buckwheat
2.3 酶解产物分子量分布的测定
谷物蛋白酶解产物功能活性不仅与其浓度有关,还受分子量大小的影响,已有研究表明具有2~10个氨基酸组成的低分子量肽生物活性较强,且其更容易穿过肠屏障发挥生理作用[25]。表1在最佳酶解时间条件下研究复合酶添加量对多肽分子量分布的影响,可得:酶解时间为3 h,燕麦半固态酶解产物中分子量<1000 Da的低分子量肽多肽占比约95%;酶解时间为1 h,荞麦酶解产物中分子量<1000 Da的低分子量肽多肽占比大于85%,可得燕麦与荞麦中的蛋白经半固态酶解均可得到较多的低分子量肽。燕麦酶添加量为3.75%的条件下多肽含量最高(图1A),且与酶添加量为1.25%组相比,酶解产物中<1000 Da低分子量肽占比也明显提高;荞麦在酶解时间为1 h,酶添加量为1.25%时多肽含量较高(图1B),但酶解产物中<1000 Da低分子量肽占比低于酶添加量为2.50%及3.75%组。这是由于半固态酶解底物中的部分蛋白被淀粉包裹,复合酶会集中酶解裸露出的谷物蛋白,随着酶添加量的增多,酶切位点水解越完全,低分子量肽占比更大。
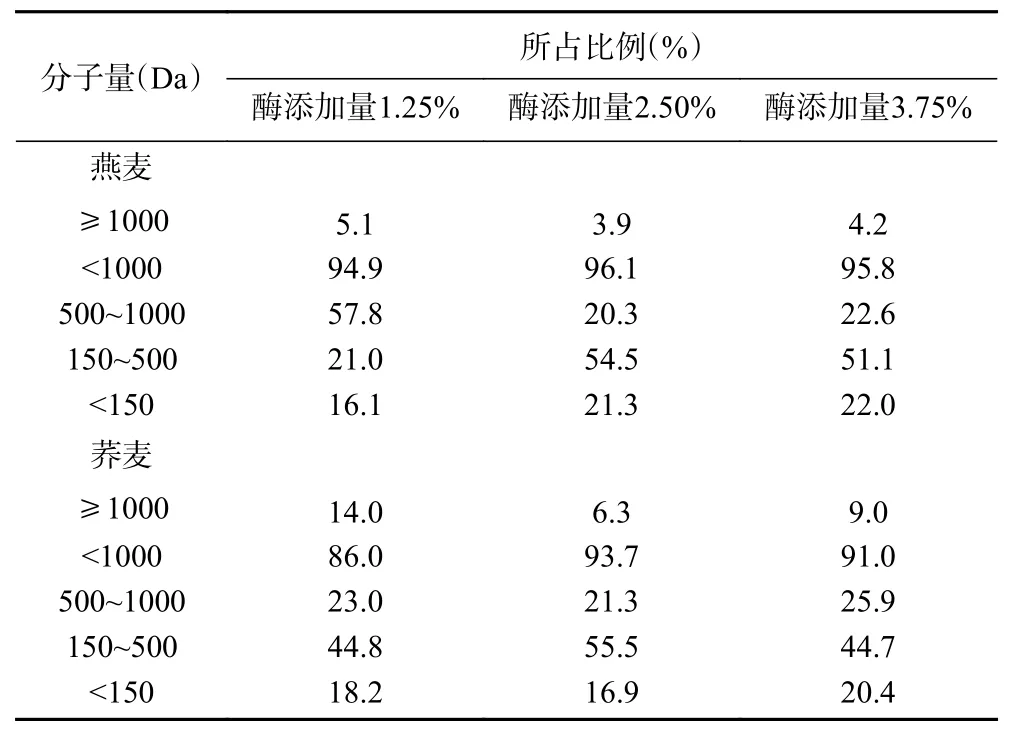
表1 半固态酶解酶添加量对酶解产物分子量的影响Table 1 Effect of the amount of semi-solid enzymatic hydrolysate on molecular weight of polypeptide in hydrolysate
通过液态酶解和半固态酶解的方式,在酶解时间为3 h,酶添加量为3.75%的条件下酶解燕麦粉,在酶解时间为1 h,酶添加量为1.25%的条件下酶解荞麦粉。由表2可得,燕麦和荞麦液态酶解产物中分子量<1000 Da的多肽占比分别为66.0%和76.3%,远低于半固态酶解产物的94.9%和86.0%。在半固态酶解反应体系中,复合酶集中酶解暴露出的谷物蛋白,从而生成较多低分子量的肽。因此,相对于液态酶解,燕麦在酶解时间为3 h,酶添加量为3.75%酶解条件下,荞麦在酶解时间1 h,酶添加量为1.25%酶解条件下,半固态酶解谷物蛋白不仅所得多肽含量高,而且酶解产物中<1000 Da的低分子量肽占比更高。
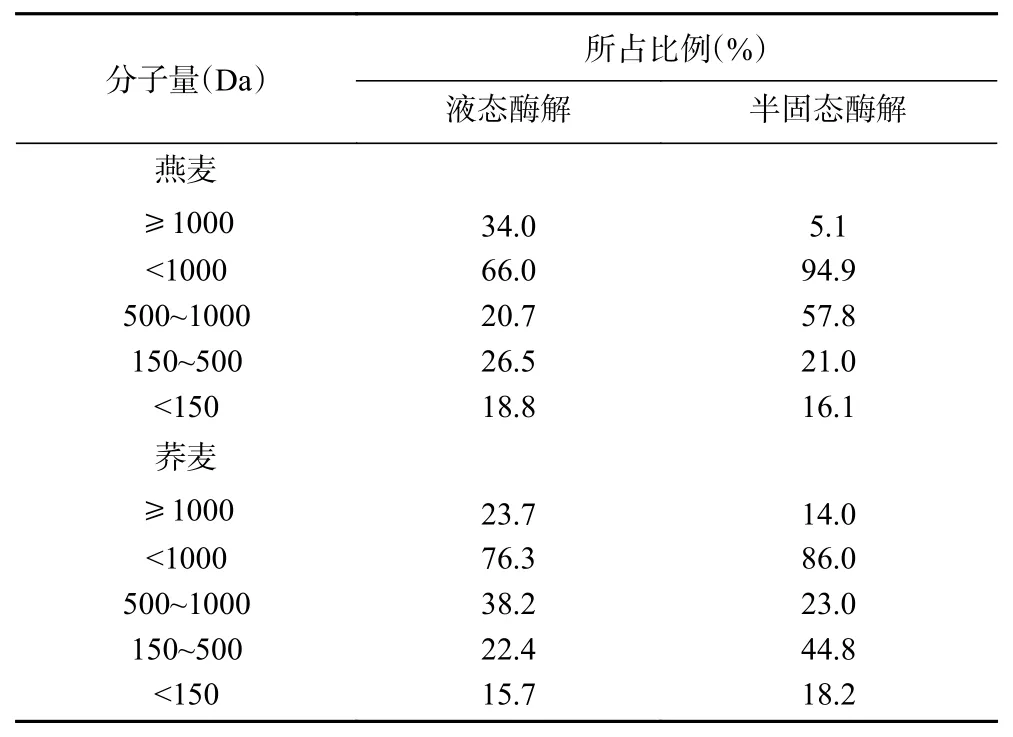
表2 酶解方式对谷物蛋白酶解产物分子量的影响Table 2 Effect of enzymatic hydrolysis on molecular weight of semi-solid enzymatic hydrolysates of grain protein
2.4 酶解产物中多肽抗氧化活性的比较
由图3可得,燕麦经半固态酶解所得多肽的总抗氧化能力及羟自由基清除能力均显著高于谷物原料且均随着酶添加量的增多而增强,荞麦酶添加量为2.50%组抗氧化活性显著高于酶添加量为1.25%组(P<0.05)且与及3.75%组无显著差异(P>0.05)。实验选用的复合酶由碱性蛋白酶和中性蛋白酶复配而成,其酶切位点包括羧基侧是芳香族或疏水性氨基酸构成的肽键及氨基侧是疏水性氨基酸构成的肽键。已有研究表明芳香族氨基酸残基易向缺电子基团提供质子,从而提高氨基酸残基的自由基清除能力,疏水氨基酸残基如Val或Leu可以促进多肽清除自由基[26]。因此,半固态酶解所得多肽越多,即可暴露更多抗氧化氨基酸残基,蛋白酶解产物抗氧化活性可能越强。燕麦在酶解时间为3 h时(图1A),随着酶添加量的增加,所得多肽浓度增加,对其抗氧化能力有显著增强作用(P<0.05)。由此可得,燕麦在酶解时间为3 h,酶添加量为3.75%条件下,半固态酶解所得燕麦肽含量最高且抗氧化活性最强。
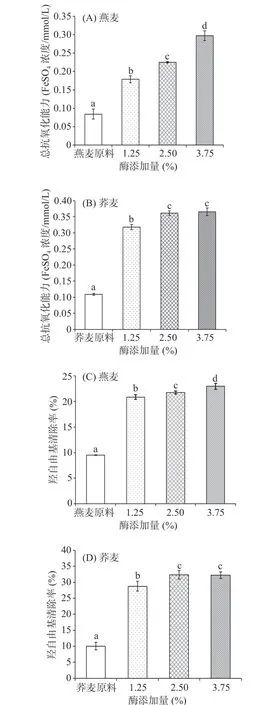
图3 半固态酶解酶添加量对酶解产物中多肽抗氧化活性的影响Fig.3 Effect of the amount of enzyme added in semi-solid enzymatic hydrolysis on antioxidant activity of polypeptides in enzymatic hydrolysates
荞麦在酶解时间为1 h时(图1B),酶添加量为1.25%组与2.50%和3.75%组所得谷物肽的含量无显著差异(P>0.05),酶添加量为2.50%组及3.75%组在酶解产物肽的分子量分布上较为相似(表1),相应的酶解产物肽在总抗氧化能力及羟自由基清除能力上均未有显著差异(P>0.05)。酶添加量为1.25%组酶解产物肽的分子量分布的低分子量占比低于另外两组(表1),其抗氧化能力及羟自由基清除能力均显著低于另外两组(P<0.05)。因此,荞麦在酶解时间为1 h,酶添加量为2.50%或3.75%条件下,半固态酶解所得荞麦肽含量较高且抗氧化活性较强。
多肽的抗氧化活性还与其氨基酸组成有关,氨基酸是肽的基本组分,它们的类型、含量和序列对肽的抗氧化活性具有很大的影响[27]。相同浓度肽含量时低分子量肽占比较高其抗氧化活性更强。Herrera Chalé等[28]研究了黧豆蛋白酶解产物中不同肽级分的抗氧化能力,得出分子量最小的肽级分,即<1000 Da的肽级分抗氧化能力最强。
由图4可得,在多肽质量浓度均为1 mg/mL时,燕麦和荞麦半固态酶解所得多肽的总抗氧化能力和羟自由基清除能力均显著高于液态酶解组(P<0.05),结合表2分子量分布实验结果可得:分子量是影响谷物肽抗氧化活性的重要因素,低分子量肽的抗氧化活性更强。半固态酶解产物中,<1000 Da的低分子量肽占比远大于液态酶解,所以半固态酶解所得多肽抗氧化活性显著高于相同质量浓度液态酶解所得多肽。
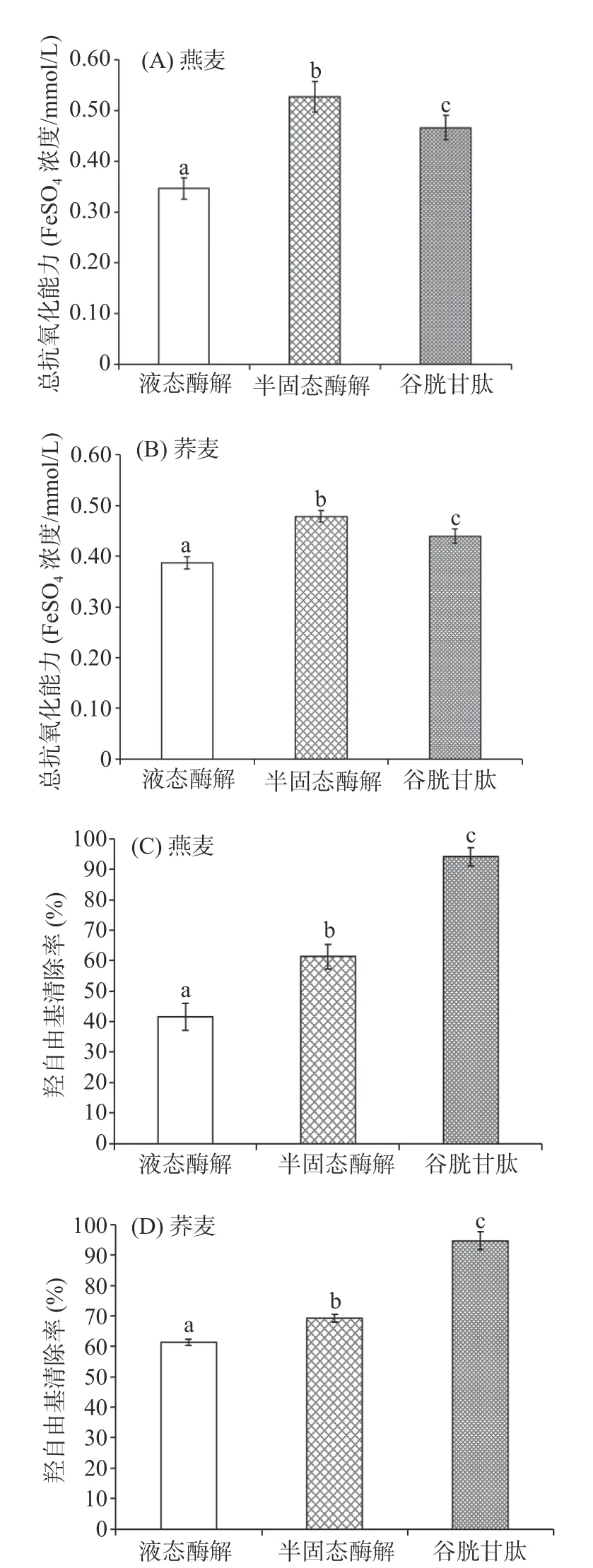
图4 酶解方式对酶解产物中多肽抗氧化活性的影响Fig.4 Effect of enzymatic hydrolysis process on the antioxidant activity of polypeptides in hydrolysis products
2.5 酶解产物中多肽ACE抑制活性的比较
比较相同质量谷物粉经半固态酶解后所得多肽的ACE抑制能力。结果由图5所示,燕麦和荞麦原料经半固态酶解后ACE抑制活性显著提高(P<0.05)。燕麦随着酶添加量的增多酶解产物中多肽含量增高(图1A),则其ACE抑制活性增强。Asoodeh[29]等人的研究表明,ACE的C末端是疏水环境,ACE抑制肽采用阻止底物与ACE活性位点相结合降低其催化活性,ACE抑制肽通常在N-或C-末端位置含有疏水性氨基酸残基。本实验选用碱性蛋白酶及中性蛋白酶复配的复合酶,因此,半固态酶解所得多肽越多,即可暴露更多疏水性氨基酸残基,蛋白酶解产物ACE活性更可能越强。
由图5可得,荞麦在酶添加量为2.50%及3.75%组,酶解所得多肽ACE抑制活性无显著差异(P>0.05),但均显著高于酶添加量1.25%组(P<0.05)。Anne等[30]研究表明,低分子量的肽更容易接近ACE的活性位点,所以<1000 Da的肽具有更高的ACE抑制活性。荞麦酶添加量为1.25%组酶解产物中低分子量肽占比低于另外两组(表1),相应的酶解产物肽的ACE抑制能力低于另外两组。
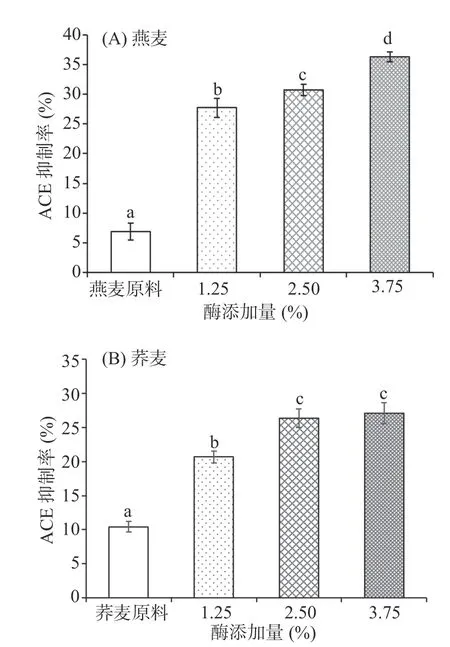
图5 半固态酶解酶添加量对酶解产物中多肽ACE抑制效果的影响Fig.5 Effect of the amount of enzyme added in semi-solid enzymatic hydrolysis on ACE inhibition of polypeptides in Hydrolysates
因此,结合半固态酶解产物中谷物肽含量及其ACE抑制活性分析可得燕麦在酶解时间为3 h,酶添加量为3.75%,荞麦在酶解时间为1 h,酶添加量为2.50%或3.75%条件下酶解效果最好。
在多肽质量浓度均为1 mg/mL条件下,比较燕麦、荞麦分别经半固态、液态酶解后所得多肽的ACE抑制活性差异,研究酶解方式对多肽ACE抑制能力的影响。由图6可得燕麦和荞麦半固态酶解产物中多肽的ACE抑制活性显著高于液态酶解组(P<0.05)。燕麦和荞麦半固态酶解所得<1000 Da的低分子量肽占比高于液态酶解(表2),所以半固态酶解所得多肽的ACE抑制活性比液态酶解更强。
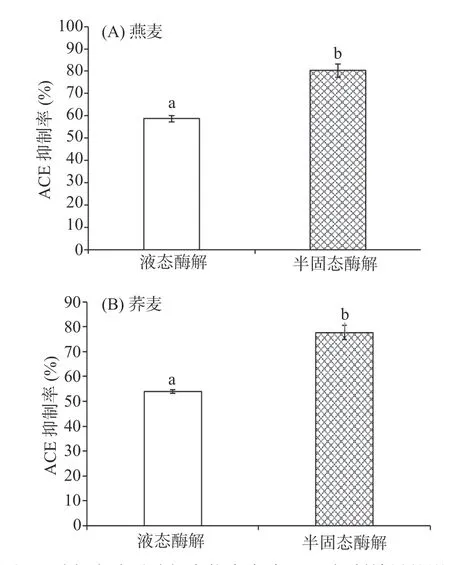
图6 酶解方式对酶解产物中多肽ACE抑制效果的影响Fig.6 Effect of enzymatic hydrolysis process on the inhibitory activity of ACE of polypeptides in hydrolysis products
Herrera Chalé[28]等用超滤膜将虎爪豆蛋白酶解产物分离成>10000,5000~10000,3000~5000,1000~3000,<1000 Da的不同组分,比较它们的抗氧化及ACE抑制活性,结果表明各组分均有一定的抗氧化及ACE抑制活性且<1000 Da的低分子量肽活性最强。多肽序列中的疏水性氨基酸和芳香族氨基酸有助于增强其抗氧化活性;芳香族氨基酸占比高的多肽,尤其是羧基末端是芳香族氨基酸的三肽,ACE抑制活性较强,疏水性氨基酸更易与ACE活性位点结合从而抑制其活性[31−33],从而达到实现降低血压。实验选用复合酶由碱性蛋白酶和中性蛋白酶复配而成,识别位点为疏水性氨基酸及芳香族氨基酸,随着酶解反应的进行,暴露出更多的疏水性及芳香族氨基酸残基,从而增强酶解所得谷物肽的抗氧化及ACE抑制活性。
3 结论
本文以燕麦及荞麦为原料,通过新型半固态酶解工艺得到具有生物活性的酶解产物,以酶解产物中多肽含量为指标进行了酶解时间和复合蛋白酶酶添加量的实验,结合酶解产物抗氧化、ACE抑制活性以及酶解效率可得燕麦、荞麦最佳半固态酶解工艺参数分别为:燕麦酶解时间3 h,酶添加量3.75%;荞麦酶解时间1 h,酶添加量2.50%。对比液体酶解工艺,半固态酶解工艺的酶解产物中低分子量肽占比较高,且其抗氧化活性、ACE抑制活性均显著高于相同条件下液态酶解所得谷物肽(P<0.05)。综上说明谷物蛋白半固态酶解工艺具有更佳效果,半固态酶解工艺应用于谷物高值化加工具有可行性。
