显微穿刺纠正人三原核合子囊胚发育潜能的临床研究
2021-08-06龙家敏阮秋燕唐秀法朱露露钟慧芝乃东红牛向丽
龙家敏 阮秋燕 唐秀法 朱露露 钟慧芝 乃东红 牛向丽
广西壮族自治区生殖医院(南宁,530021)
多原核是常规体外受精(IVF)治疗的一种常见现象,其发生率可高达1%~30%[1-2]。三原合子(3PN)早期卵裂一般为3或多细胞,晚期发育停滞或形成非整倍体[3]。有报道称3PN合子在发育过程可以完成自我纠正[4],但移植这样的胚胎最终会导致流产、葡萄胎或多倍体畸形儿的发生。如果可以通过显微操作使3PN合子变为二原合子(2PN),将增加胚胎移植机会。因此,从多原核胚胎中去除多余雌/雄原核使其恢复为二倍体胚胎成为辅助生殖技术的一项研究热点。1988年,Rawlins等[5]首次报道选择性原核减灭技术( SPnR),利用显微穿刺从人类多原核胚胎中去除多余雄原核使其恢复为二倍体。由于技术不够完善,且在常规体外受精中,2PN合子比容易获得,所以SPnR优势不大。随着辅助生殖技术的发展,显微操作设备和技术的不断完善,去除多余原核后胚胎的存活率逐步提高。2003年新加坡科学家通过SPnR技术去除人3PN合子中多余的雄原核后,获得健康新生儿[6]。2006年,Escriba等[7]报道应用SPnR技术去除过多原核后,41%的胚胎可达到囊胚期,明显高于未去原核的3PN组。实践证实通过显微操作技术纠正多原核合子,可为部分患者提供正常胚胎,增加了IVF治疗中胚胎移植和妊娠的机会,对不孕症的临床治疗具有重要意义。
1 对象和方法
1.1 研究对象
受精16~18 h在倒置显微镜下观察并记录在本院进行常规IVF 周期(非卵胞浆内单精子显微注射(ICSI))患者胚胎极体(PB)排出及原核形成情况,根据2PB+3(或以上)PN,判断为多精受精合子。本研究经本院伦理委员会批准,经患者知情同意后,共收集44例不孕患者的多精受精3PN 151个,以及观察记录同期同一患者414个2PN合子发育情况。女方年龄(32.6±4.6)岁(23~44岁),男方年龄(35.1±6.0)岁(22~56岁)。不孕因素中输卵管因素占95.4%(42/44)、内膜因素占11.9%(5/44)、排卵障碍22.7%(10/44),本研究没有纳入男方不孕占主导因素的病例。
1.2 方法
1.2.1显微操作的准备显微操作在配备有37℃热台和NARISHIGE显微操作系统的 ZEISS(1023619506,德国)倒置显微镜上进行。去核前1h预先准备操作皿,操作液为ICSI使用的PVP皿。3PN合子置于操作液后操作。
1.2.2原核的去除首先用外径120μm,内径 25~30μm持卵针(Sunlight Medical,Inc. USA)固定3PN,在内径5.0μm穿刺针(Sunlight Medical,USA)的帮助下尽量将3PN固定在一个最佳位置,即将被吸出的原核清晰地显示并最靠近穿刺针。根据雄原核一般比雌原核略大,雄原核所处位置离极体较远而雌原核在两个极体下端,第二极体比第一极体完整透明的形态学判断标准[5-6,8],吸取较大且远离第二极体的原核。在200倍倒置显微镜下,穿刺针穿过透明带,缓慢进入卵胞浆内,置于将要吸取的原核上方切面上,抽吸原核, 最好将核膜完整吸出,如果核膜破裂,将核浆及核仁完全吸出,勿伤及其他原核。操作完成后将3→2PN移入(ART-1026)培养液(Cooper Surgical,USA)微滴中,37℃ 5%CO2培养箱中继续培养,此操作与2PN组正常2PN培养方法一致。在48h后观察发育情况并记录胚胎质量。
1.2.3胚胎发育情况显微操作去核当日为第1天,第3天将培养液更换为(ART-1029)培养液,(Cooper Surgical, USA)。于第5,6天观察其发育情况,记录囊胚形成情况,如果第6天形成1期囊胚,可观察至第7天。达到≥3BC评级的囊胚行玻璃化冷冻保存(VT101, Kitazato Corporation, Japan)。2PN组只观察到第6天。
1.2.4胚胎质量评估标准优质胚胎:D3 1~2级、≥6细胞的胚胎和提前进入融合期的胚胎。可用囊胚:囊胚评级≥3BC。
1.2.5解冻、取样及基因分析解冻:于送检当天解冻,解冻程序按照玻璃化冻存胚胎解冻程序进行(VT102, Kitazato Corporation, Japan)。解冻完成后置于ART-1029培养基中培养1~2h。对同一囊胚分别进行囊胚滋养细胞层(TE)和内细胞团细胞(ICM)取样,按照PGD取样方法进行[9]。取样完成置于有细胞裂解液的PCR管中,-20℃保存。新一代基因测序技术(NGS)、染色体拷贝数变异(CNV)分析,由江苏亿康基因科技有限公司完成。
1.3 统计学方法
数据采用SPSS 16.0统计学分析。进行χ2检验。P<0.05差异有统计学意义。
2 结果
2.1 一般情况
显微操作去原核的3PN共有151个,去原核成功共141个(3→2PN组),显微穿剌抽取原核的成功率为93.4%。同期同一患者的两原核受精卵共414个(2PN组)。
2.2 胚胎发育情况
3→2PN组D3退化率、胚胎卵裂率和D5~D7囊胚形成率低于2PN组,≥6细胞胚胎形成率、优质胚胎形成率高于2PN组(均P<0.001)。3→2PN组与2PN组可用囊胚率相似(P=0.163) 。3→2PN组共冻存8枚可用囊胚(表1)。
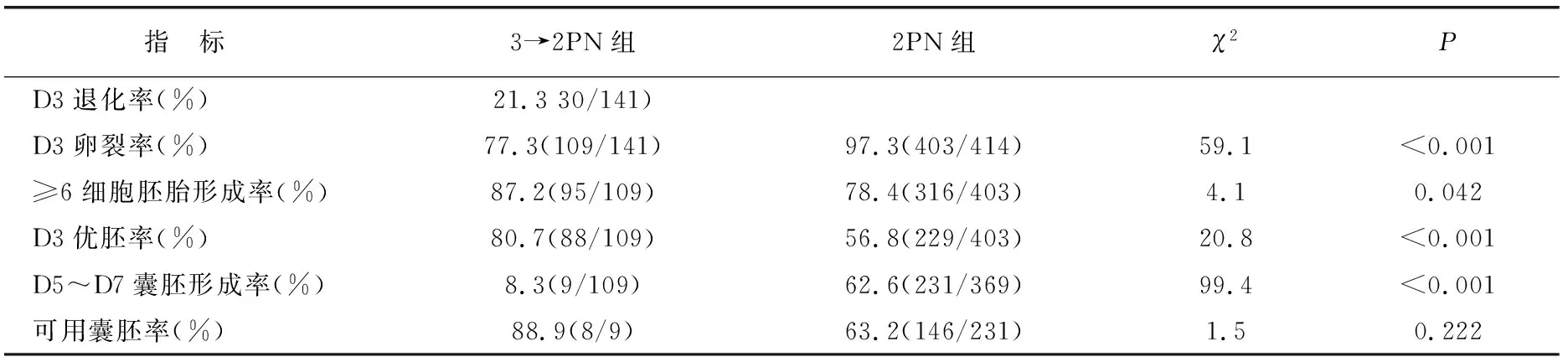
表1 3→2PN组与2PN组胚胎发育指标比较(%)
2.3SPnR后形成的囊胚基因检测
解冻8枚冻存囊胚,复苏成活6枚,复苏率为75.0%。总共检测了来自5位不孕患者的6个囊胚,其中包括6份TE样本和5份ICM样本,总共11份样本。 NGS及CNV分析结果显示,其中10份样本核型检查结果为46,XN;1份TE样本检查结果为46,XN,-6p(×1,mos,~40%),-6q(×1,mos,~50%),同一囊胚的ICM为46,XN(表2)。以TE样本计算整倍体率为83.3%(5/6),以ICM样本计算整倍体率为100%(5/5)。
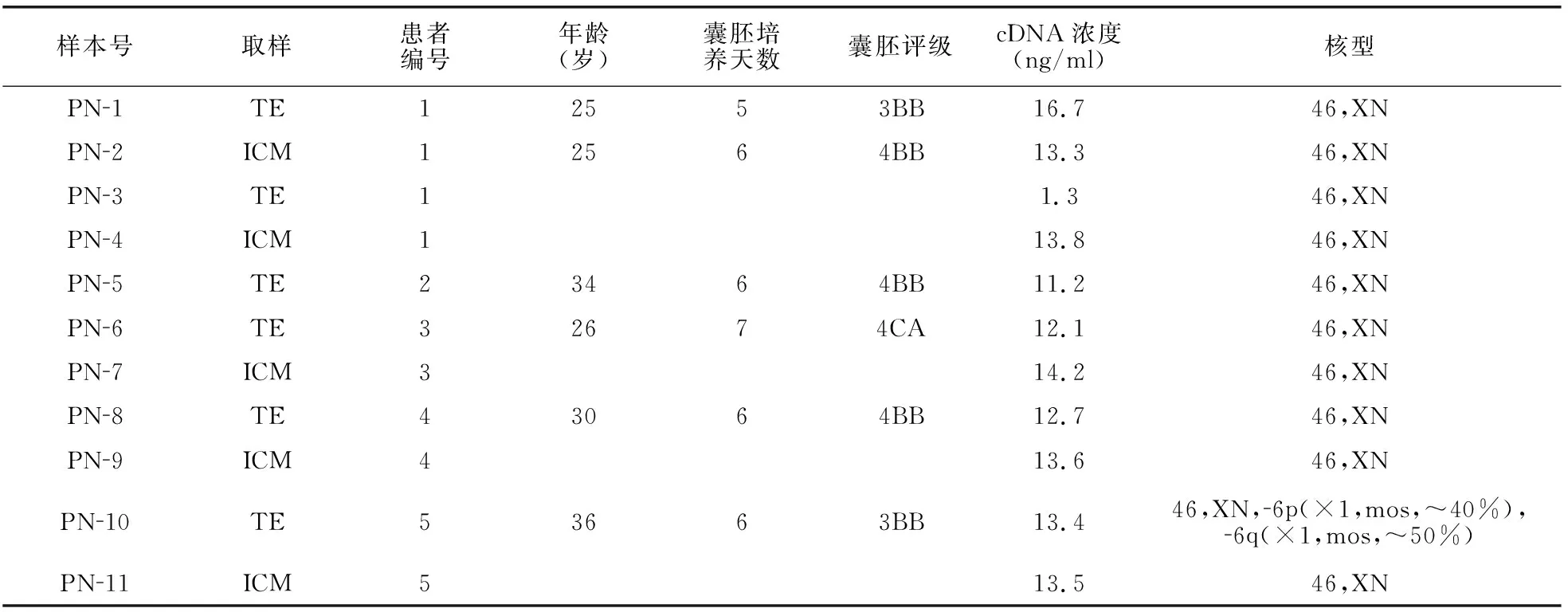
表2 3→2PN胚胎形成囊胚的非整倍体分析
3 讨论
3.1 多原核的形成机制
在常规IVF中,多原核合子的形成原因包括精子原因的多精子受精[10],其主要是多精入卵阻止机制不完善引起,与卵子的不成熟、卵子过熟、精子浓度、血清中高雌激素水平、皮质反应、透明带的异常等有关。卵子的第一、第二极体不释放导致2倍体或多倍体卵子[11-12], 或含多倍体的单精子及单倍体的卵子受精,其中多精子受精是最主要的原因。
3.2 显微操作对多3→2PN退化率的影响
在本研究中, 经显微穿刺抽吸后3→2PN第48h退化率达到了21.3%。3→2PN退化的原因是多方面的:可能是穿刺损伤了合子的胞膜,引起胞浆物质的外溢,穿刺结束后就退化;穿刺针进入胞质及抽吸力可能影响合子的细胞骨架结构稳定性,导致细胞不能分裂甚至退化。
3.3 显微操作对多3→2PN卵裂率的影响
本研究结果显示, 经显微穿刺抽吸后3→2PN第48h的多原核合子的分裂率, 低于正常2PN的卵裂率,与之前文献报道的研究结果不一致[13-14]。不卵裂的可能原因:去核不完全或保留的2个原核可能受到损伤,导致染色体数目变异,或者雌原核的核仁受到部分破坏,而母源的核仁是胚胎基因激活的必需,从而导致细胞卵裂阻滞[15];由于判断错误吸去雌原核,保留了2个雄原核,而早期卵裂所需要的物质和调控因子主要来源于母源因子,在胚胎基因激活的过程中,母源因子同样发挥了很重要的作用,例如Brg 1对染色质结构的调控是胚胎基因激活的关键,还有Npm2、Ago2、Atg5、Ring1、Rnf2及Sox2等基因的敲除和敲低都会导致胚胎基因激活异常及卵裂期胚胎发育阻滞[16-22]。
3.4 显微操作对多3→2PN囊胚形成率的影响
3→2PN组囊胚形成率低于2PN组,与之前文献报道的研究结果一致[13-14]。可能是由于胚胎卵裂模式异常,导致胚胎发育阻滞。有研究发现,精子来源的中心体及中心粒决定着人类胚胎的纺锤体形成,控制着受精后的的第 1 次有丝分裂,而卵子的中心粒可能不起作用[23]。如果合子中一个以上具有功能的中心体会导致多级纺锤体。有研究对合子第一次分裂时纺锤体的染色结果发现,多精受精的合子纺锤体形成异常,去除多余原核后有部分合子可形成正常形态的纺锤体,但是仍有一部分合子的纺锤体异常,其原因可能是因为去除多余的雄原核时未能将多余的父源中心体同时去除,而导致多级纺锤体[14,24]。因此,在去核操作时应同时吸取原核周围的少量胞浆,以期能够去除多余的中心体,使合子能够形成正常的双极纺锤体。但观察第3天胚胎发育情况, 3→2PN组≥6细胞胚胎形成率及优质胚胎率均高于2PN组,但可用囊胚率两组没有差异,说明穿刺成功的合子能够正常发育且可形成囊胚。
3.53→2PN形成可用囊胚核型分析
3→2PN形成可用囊胚冷冻后解冻复苏率为75.0%(6/8),本院同期囊胚解冻复苏率约为97.0%。3→2PN组形成的可用囊胚经NGS及CNV分析,除一个TE样本核型分析显示异常外(46,XN,-6p(×1,mos,~40%),-6q(×1,mos,~50%),其余10个样本核型分析均为正常(46,XN),且与同一个显示异常的TE样本同一来源的ICM标本显示为正常,所以3→2PN组形成的可用囊胚可利用率具有一定的临床意义。
由于对雌雄原核的鉴别并非绝对可靠, 所以并不能肯定移出的原核就是多余的。鉴于此, 对于纠正后的胚胎利用需要结合胚胎植入前遗传学诊断, 确定其染色体组为正常的二倍体 。
