不同加工处理方式对酪蛋白胶束的影响研究进展
2021-02-25赵新琦陈平华米晓磊王存芳
赵新琦,陈平华,米晓磊,程 明,王存芳,*
(1.齐鲁工业大学(山东省科学院)食品科学与工程学院,山东 济南 250353;2.山东熊猫乳品有限公司,山东 济南 251400;3.青岛市畜牧兽医研究所,山东 青岛 266000)
酪蛋白是哺乳动物乳中的主要蛋白质,也是影响液态乳、酸乳及干酪结构特性、感官品质的重要因素[1]。在乳蛋白的加工过程中,可能会使酪蛋白结构发生变化,如疏水基团外露、聚集、絮凝等,这些变化会影响蛋白功能的表达,从而影响食品的质地。对牛乳蛋白进行改性不仅可以改变其功能,而且可以提高对食品加工过程中酪蛋白胶束行为的认知。本文从结构和功能特性的角度,综述乳品工业中广泛应用的加工处理方式(温度变化、pH值调节、高压、超声处理)对酪蛋白产生的影响。通过分析不同加工处理方式对酪蛋白结构的改变,进而产生功能性质的变化,了解不同加工处理方法对酪蛋白结构的影响以及产生变化的机理,有助于更好地控制乳品的加工生产,对调整乳制品的特性和质量至关重要。
1 酪蛋白概述
酪蛋白以胶束的形式存在,是一个被结合成似球形的颗粒(图1),主要有αs1-、αs2-、β-、κ-酪蛋白(含量比4∶1∶4∶1)4 种类型[2]。αs-、β-酪蛋白主要位于胶束内部,含有磷酸化基团簇,属于钙敏感类酪蛋白,增强了酪蛋白与钙的结合能力,促进了胶体磷酸钙纳米团簇的形成,大量与酪蛋白胶体结合的钙称为胶体磷酸钙(colloidal calcium phosphate,CCP),CCP有助于维持酪蛋白胶束的完整性以及酪蛋白分子间的疏水相互作用和氢键[3],而κ-酪蛋白位于胶束外部,形成所谓的“毛层”结构,疏水的N端存在于胶束内部,亲水的C端部分(酪蛋白糖巨肽)深入溶液中(图1)。

图 1 酪蛋白胶束模型图[4-5]Fig. 1 Casein micelle model[4-5]
酪蛋白的主要功能是有效运输不溶于水的蛋白质、钙及磷酸盐,并为哺乳动物幼体的生长提供足够的营养[6]。酪蛋白具有流变性,可以对周围环境的变化做出迅速反应,所以不同加工处理方式引起的环境变化会使酪蛋白调整自身的结构,以此来适应周围环境。
2 不同加工处理方式对酪蛋白的影响
2.1 高温及低温处理
高温处理作为乳品加工的重要手段,如巴氏杀菌、超高温杀菌及乳品在加工和食用前的低温存储等都会对酪蛋白产生一定的影响。酪蛋白由于缺乏三级结构对热具有一定的稳定性,高温短时巴氏杀菌等温和的热处理并不会改变酪蛋白胶束的结构[4]。但是在热处理过程中,酪蛋白胶束的解离、胶束结构及表面电荷的改变、乳胶体溶液中盐平衡的破坏、乳清蛋白存在条件下的变性、乳清蛋白与胶束之间的相互作用等,都会影响乳体系的稳定性。
磷酸钙在低温下有更好的溶解度,所以低温状态下,胶束磷酸钙会发生部分且可逆的溶解,导致胶束体积增大[7]。矿物体系对温度变化的响应在加热过程中是瞬间的,而酪蛋白胶束的再平衡在冷却过程中较缓慢。

表 1 不同加工处理温度对酪蛋白胶束的影响Table 1 Effects of different processing temperatures on casein micelles
不同的温度会使酪蛋白发生不同程度的解离与凝聚(表1),变化过程如图2所示。乳清蛋白会对胶束稳定性产生影响,乳清蛋白是引起胶束稳定性下降的诱因,变性后的乳清蛋白与胶束表面的κ-酪蛋白发生巯基-二硫键相互作用,κ-酪蛋白的解聚行为极大影响了胶束稳定性[12]。

图 2 温度对酪蛋白胶束结构的影响[4]Fig. 2 Effect of temperature on the structure of casein micelles[4]
可溶性钙、pH值、可溶性酪蛋白、酪蛋白胶束的水合作用和颗粒体积均随温度的升高而降低,其中β-酪蛋白是主要的可溶性酪蛋白,温度升高疏水作用增强,可溶性酪蛋白的胶束化使较小酪蛋白胶束有所增加[13]。热处理对酪蛋白二级结构的影响显著,其中α-螺旋结构含量减少,而平行及反向平行的β-折叠、β-转角、无规则卷曲结构含量增加[14]。
酪蛋白水解受热处理温度与时间的影响,其中温度是主因,长时间的非高温处理有利于酪蛋白水解[14]。温度的改变会引起胶束的变化,从而对凝胶性质产生影响,在凝乳过程中,β-酪蛋白的减少使凝乳时间缩短,断裂力、硬度降低[15],附着在胶束表面的变性乳清蛋白与κ-酪蛋白的复合物不利于热诱导胶束的凝固[1]。对于乳化能力而言,适当的热处理有利于蛋白质分子在界面快速展开,疏水基团暴露,多肽链展开,分子柔性增加,以及酪蛋白溶解度的增加,增强了界面吸附,从而使乳化性能显著提高[16]。酪蛋白胶束对热处理十分稳定,可以将酪蛋白作为乳清蛋白的伴侣蛋白,从而抑制热稳定性较差的乳清蛋白发生聚集,使其超高温稳定性得以提高,扩大在食品中的应用范围[17]。
2.2 pH值调节
酪蛋白分子的结构和电荷取决于pH值。pH值改变会对酪蛋白分子间的静电及疏水相互作用产生影响,从而使酪蛋白胶束的结构产生变化。随着pH值升高,酪蛋白胶束净负电荷随之增加,更多的水分子与之发生相互作用,水化程度增加,从而使胶束尺寸增大[18]。酪蛋白胶束结构的松散有助于胶束聚集结构的解离[19]。在pH值接近等电点(isoelectric point,pI)时,酪蛋白分子间疏水作用增强,酪蛋白胶束的结构更加紧密[20]。酸化过程中,κ-酪蛋白的“毛层”结构收缩并导致最终的塌陷,削弱了胶束的空间结构稳定性[21]。在牛乳加热前将pH值升高到6.7以上,胶束中κ-酪蛋白的解离逐渐增加,在pH 6.7或更低条件下,几乎不发生酪蛋白的解离[22]。κ-酪蛋白的pH值依赖性解离是可逆的,依赖于胶束表面的电荷,在一定的负电荷下,疏水力与静电力可能会导致κ-酪蛋白从胶束相的解离[23]。
随着pH值的改变,酪蛋白胶束产生不同程度的变化(表2)。有研究显示,在碱性pH值(8.0~11.0)范围内,胶束的受破坏程度随着pH值的增加、温度升高、乳固体含量降低而增强,而且随着pH值的增加,离子钙、血清钙、磷酸盐含量呈对数下降[24]。pH<3.0时,酪蛋白分子的净正电荷可以起到稳定酪蛋白胶束的作用[20]。
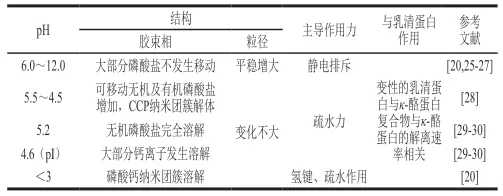
表 2 不同pH值对酪蛋白胶束的影响Table 2 Effects of different pH values on casein micelles
对于酪蛋白胶束与乳清蛋白的结合,在pH 6.5左右,乳清蛋白与酪蛋白胶束之间的结合增加,在pH值升高时由于酪蛋白胶束中κ-酪蛋白的部分分离使二者的结合减少[25]。pH 6.35~6.9条件下,当pH>6.6时加热乳清蛋白会导致酪蛋白胶束的部分覆盖,当pH<6.6时导致所有的乳清蛋白附着在酪蛋白胶束上[26]。
pH值会影响酪蛋白中离子的释放以及胶束结构的松散性,使水更容易渗透到酪蛋白胶束的聚集结构中,从而影响其溶解行为[31]。酪蛋白溶解度受pH值和盐浓度的影响显著[32]。当pH>pI时,酪蛋白由于酸性侧链的电离产生净负电荷,会使酪蛋白在稀氢氧化钠溶液中溶解;相反,pH<pI时,由于碱性侧链质子化产生净正电荷,使之在强酸性溶液中溶解[33]。在接近其pI(4.6)时,酪蛋白携带的电荷为零,溶解度达到最低,酪蛋白发生沉淀或凝胶。酪蛋白胶束在酸化后,结构稳定性丧失,开始发生聚集和凝胶,凝胶的形成与酸化的温度密切相关[34]。酸化温度不同,形成的凝胶结构不同,酸化温度为40 ℃时形成粗链凝胶网络,10 ℃形成细链凝胶网络[25]。在碱化过程中,胶束酪蛋白溶液起泡性能稳定且显著增加,酪蛋白胶束大小和结构对于泡沫的稳定性起着决定性作用[35]。
2.3 高压处理
高压处理对酪蛋白结构的改变受工艺参数(设备类型、压力水平、保持时间、压力释放速率和温度)及乳液成分(溶剂成分、蛋白质含量、pH值和离子强度)的影响[36-37]。研究发现,在200~250 MPa压力下,酪蛋白胶束粒径增加,在高达400 MPa及600 MPa的压力下,酪蛋白胶束尺寸减小,大胶束完全解体(图3)[38]。在压力≤400 MPa时,随着压力的增加,酪蛋白胶束粒径减至最小之后,不再有明显的压力效应,且在该压力域中,酪蛋白颗粒发生广泛的重排和压缩,从而很大程度上改变了乳品的理化性质和功能[38-40]。在压力作用下酪蛋白胶束粒径的增加可能是由于酪蛋白聚集体的形成,而酪蛋白胶束粒径的减小是由于破坏了疏水和静电相互作用及CCP的溶解作用[40]。

图 3 酪蛋白胶束在不同压力下的透射电子显微照片[38]Fig. 3 Transmission electron micrograph of casein micelles under different pressures[38]
不同作用力对高压的敏感性不同,疏水相互作用>静电作用>氢键>共价键[38]。酪蛋白在压力下的分解是不可逆的,高压降低了胶束内酪蛋白之间的疏水相互作用,在压力环境中随着温度的增加,抗压力解离的稳定性增加,表明疏水稳定性增强,因此分离胶束所需的压力随着温度的升高而增加[41]。
在高压处理下,酪蛋白胶束发生分解,使溶解相中各胶束组分的含量显著增加,其中β-酪蛋白最容易因压力增加而解离,其次是αs-酪蛋白和κ-酪蛋白,从而对胶束结构产生影响[42]。无论高压处理的温度如何,压力诱导的酪蛋白胶束解离都伴随着钙、磷及酪蛋白的释放[43]。乳清蛋白的变性随压力的增加发生显著增加,在对脱脂乳的压力处理中,酪蛋白的存在会促进乳清蛋白变性,而乳清蛋白发生变性的程度不会对酪蛋白向溶解相的释放产生影响[44]。
高压低温处理可以使酪蛋白的溶解度得到提高,变性的β-乳球蛋白与胶束的结合以及胶束破裂为更小的不规则颗粒都增加了酪蛋白胶束的水合作用[36]。同时小颗粒之间的交联与重组使得内部疏水性的氨基酸残基隐蔽,亲水区暴露,降低了胶束表面的疏水性,从而使溶解度得以提高[45]。压力释放的速率与溶液中酪蛋白的含量会影响从溶胶到凝胶转变的结构,酪蛋白含量越高,压力释放越快,形成的凝胶组织越牢固、越细密[46]。高压对牛乳凝乳特性的影响一方面取决于酪蛋白胶束的破坏及κ-酪蛋白的解离,另一方面取决于变性乳清蛋白与酪蛋白胶束的结合,前者使凝乳酶凝固时间缩短,凝胶形成的速率和强度明显提高,后者阻碍了牛乳中凝乳酶凝结的相对程度[47]。富含酪蛋白胶束的乳蛋白溶液经高压低温处理,往往会形成少量的大絮体,但这些絮体未对泡沫和乳液的稳定性产生特殊影响,但加压处理可能会使酪蛋白之间的吸引力增加,排斥力降低,从而使乳状液的稳定性降低[48]。适当压力水平的动态超高压改善了酪蛋白的发泡性,提高了酪蛋白溶解度、分子柔性,降低了界面张力,使酪蛋白更容易在气-水界面展开和吸附,并在界面形成硬膜,相反压力过大反而不利于泡沫的形成[49]。
2.4 超声处理
酪蛋白经超声处理会使致密的表面结构出现空洞化和层片化现象,酪蛋白结构变得松散,增加了其表面积,便于后续的酶解和处理[50]。超声波产生的剪切力不会使酪蛋白胶束矿物质发生变化,胶束结构能够保持稳定[51]。经超声作用后,酪蛋白粒径会出现略微缩小,该现象可以解释为胶束表面κ-酪蛋白片段的断裂[52]。在超声和pH值共同作用于酪蛋白的研究中发现,任何pH值条件下超声均会导致酪蛋白胶束的破碎(图4),而且pH值越高超声破碎效率越高[53]。另外,低频超声比高频超声对酪蛋白胶束的破坏性更大,导致蛋白质从胶束相释放又重新组合成小聚集体[54]。乳清蛋白在超声作用下也会发生变性,使之与自身、游离的酪蛋白及酪蛋白胶束结构形成聚集体,但是处理时间过长会导致乳清蛋白与聚集体的部分分离[51]。
超声波作用于酪蛋白会使其溶解度得以改善,原因可能是超声波产生机械剪切力作用,使其粒度变小,增大了与水的接触面积,同时空化作用导致蛋白质分子舒展开来,其亲水性残基暴露[55]。超声波的机械均质作用使酪蛋白粒度减小并均匀分散,溶解性改善、表面疏水性增加,从而使起泡性及起泡稳定性增加[56]。超声作用后的酪蛋白α-螺旋含量减少,无规则卷曲含量增加,从而使其柔性增加,更容易被酶解消化;超声可以提高酪蛋白分子的乳化性,与超声功率与处理时间有关,超声功率越大,达到最佳乳化性的时间越短[57]。超声波处理会增加酪蛋白分子的疏水性,更容易形成较稳定的聚合物,从而产生弹性更高的凝胶,并缩短胶凝时间[58]。小尺寸的胶束颗粒使凝乳酶诱导的乳凝胶中含有更紧密的结构和更强的凝胶硬度[59]。低频、高强度的超声应用于酸乳中会显著提高其硬度、保水性、黏度和凝胶强度[11]。

图 4 超声对酪蛋白胶束的影响[4]Fig. 4 Effect of ultrasound on casein micelles[4]
3 结 语
不同的加工处理方式通过改变表层的κ-酪蛋白、酪蛋白自身及与乳清蛋白的相互作用、可溶相与胶体相之间的平衡以及对胶体结构形成的氢键、二硫键、静电相互作用、疏水相互作用的影响使酪蛋白功能特性发生相应改变。酪蛋白界面性质随着溶解性、疏水性和分子柔性的增加而增加,反应位点的暴露可以使凝胶化的网络组织得到相应改善。单一的加工处理方法对于酪蛋白功能特性的改善有一定作用,但也有一定的局限性,不同加工方法之间的联合处理,如压力-温度、超声-pH值等的结合,会有更理想的效果。对于不同乳制品的生产,人们有不同的需求和期望,在干酪的生产中需要凝固时间短且牢固,对于浓缩乳粉的生产,则要求良好的热稳定性和溶解性。加工条件对乳制品的制备过程十分重要,因此,深入了解不同的加工处理方法对酪蛋白的影响,针对不同的生产加工需求选择合适的加工处理方法具有十分重要的意义。