miR-138在肝细胞癌中的表达及其对MHCC97H细胞侵袭、迁移能力的影响
2021-01-22曾保征王赣陈超黄远丽董超
曾保征,王赣 ,陈超,黄远丽,董超
1 麻城市人民医院,湖北麻城438300;2 华中科技大学同济医学院附属荆州医院
肝细胞癌(HCC)是人类常见的原发恶性肿瘤之一,具有高侵袭性的特点,患者的5 年生存率低于10%,病死率居全球肿瘤的第三位[1]。虽然近年来外科手术和药物治疗取得了明显的进步,但HCC 患者的生存率仍没有得到有效提高,患者预后仍然较差。HCC 的发生发展机制复杂,研究显示许多信号转导通路均参与其中,但目前具体机制尚不清楚,尚缺乏能够有效抑制肿瘤的药物[2]。研究显示,具有高度保守性的miRNA 在机体众多信号转导通路的调控中发挥重要作用,miRNA 能够通过靶向调控靶基因的表达,参与恶性肿瘤的发生、进展。据报道,miR-138 在恶性肿瘤生长、耐药、侵袭转移、细胞自噬方面均发挥着重要的作用[3]。既往研究发现miR-138 在HCC 患者血清中表达明显降低,但具体作用机制尚不清楚[4]。因此,本研究采用qRT-PCR检测miR-138 在HCC 组织及细胞中的表达变化,并进一步观察其对HCC 细胞侵袭、迁移能力及上皮间质转化(EMT)的影响,为HCC 治疗提供新的研究方向。
1 材料与方法
1.1 材料 收集 2016 年 7 月—2018 年 6 月在麻城市人民医院行手术治疗的60 例HCC 患者的癌组织及相对应的癌旁组织标本。60 例癌组织经术后病理证实均为HCC 组织,癌旁组织标本均为无肿瘤细胞侵犯的正常组织。术前所有患者未进行任何抗肿瘤治疗。60 例患者中,<50 岁 17 例,≥50 岁 43 例;男44 例,女 16 例;肿瘤直径<5 cm 23 例,≥5 cm 37 例;TNM 分期Ⅰ、Ⅱ期 19 例,Ⅲ、Ⅳ期 41 例;Edmondson病理分级Ⅰ、Ⅱ级32 例,Ⅲ、Ⅳ级28 例;微血管侵犯26例,无微血管侵犯34例。本研究经过医院伦理委员会备案批准,所有患者及家属对本研究知情同意。miRNA分离纯化试剂盒购自美国Ambion公司;反转录试剂盒和qRT-PCR 检测试剂盒均购自美国Applied Biosystems 公司;所有引物购自广东锐博生物公司;TRIzol 试剂和Lipofectamine2000 购自美国Invitrogen 公司;Matrigel 胶购自美国 BD 公司;Tran⁃swell 小室购自美国 Millipore 公司;miR-138 mimics及 NC-mimics 均购自上海吉玛公司;E-cadherin、Vi⁃mentin抗体均购自美国Santa Cruz公司。
1.2 细胞培养及转染 高侵袭性人HCC 细胞系MHCC97H、低侵袭性人 HCC 细胞系 MHCC97L 和HepG2 以及正常人肝细胞系L02 均购自中国科学院上海细胞库,应用RPMI1640 培养基(含10%胎牛血清)在37 ℃、5% CO2细胞培养箱中培养,每3 d 更换培养液1 次。转染操作时,将对数生长期的MHCC97H 细胞接种于6 孔细胞板,细胞分为miR-138 mimics 组 和 NC-mimics 组 ,分 别 应 用 Lipo⁃fectamine2000 将 miR-138 mimics 及 NC-mimics 转 染至MHCC97H 细胞,转染后6 h 更换为正常细胞培养液继续培养,取转染后24 h的细胞进行后续实验。
1.3 miR-138检测 采用qRT-PCR。应用miRNA分离纯化试剂盒提取HCC组织及癌旁组织、MHCC97H、MHCC97L、HepG2 及 L02 细胞的总 RNA,紫外分光度计测定浓度及纯度。取1µg 总RNA,应用反转录试剂盒反转录生成cDNA,反应条件:15 min 37 ℃,5 s 85 ℃。取 PCR 引物,以cDNA 为模板,按照 qRTPCR 反应试剂盒说明书配置反应液进行反应,miR-138 引物序列上游:5"-GGTGTCGTGGAGTCGGCAA-3",下游:5"-AACTTCACAACACCAGCTTA-3"。U6引物序列上游:5"-CTCGCTTCGGCAGCACA-3",下游:5"-AACGCTTCACGAATTTGCGT-3"。 qRT-PCR 反 应条件:10 min 95 ℃;10 s 95 ℃,20 s 60 ℃,15 s 72 ℃,共进行 40 个循环。采用 2-ΔΔCt计算 miR-138 的相对表达量。
1.4 细胞侵袭能力检测 采用Transwell侵袭实验。取转染后 24 h 的 miR-138 mimics 组和 NC-mimics 组MHCC97H细胞,对细胞预先饥饿处理24 h后,接种于预铺Matrigel胶的Transwell 小室上室内(含2×105个细胞),Transwell 小室下室加入含10%胎牛血清的RPMI1640培养液,置入细胞培养箱中培养24 h后取出小室,4%多聚甲醛溶液固定细胞,0.1%的结晶紫溶液染色30 min,棉签擦去上室内的细胞,PBS 清洗3 次,倒置晾干,高倍显微镜下随机选取5 个高倍视野进行细胞观察计数,取平均值。
1.5 细胞迁移能力检测 采用划痕实验。收集转染 后 24 h 的 miR-138 mimics 组 和 NC-mimics 组MHCC97H 细胞,以2×105个/孔的细胞密度接种于6孔细胞板中,在37 ℃,5%CO2的细胞培养箱中培养,待细胞长满至90%后,用200µL 微量移液枪头在细胞板上垂直进行“一”字划痕,PBS 冲洗细胞2 次去除脱落的细胞,继续培养24 h 后在倒置显微镜下观察细胞的划痕愈合情况,计算划痕愈合率(%)。
1.6 E-cadherin、Vimentin 蛋白检测 采用Western blotting 法。取转染后 24 h 的 miR-138 mimics 组和NC-mimics 组MHCC97H 细胞,抽取细胞总蛋白,BCA 法测定蛋白样品的浓度。每个样本取得20µg总蛋白上样,进行10%十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分离,电转移至聚偏二氟乙烯(PVDF)膜,PVDF膜以5%脱脂奶粉封闭1 h,4 ℃孵育过夜,分别加入E-cadherin(1∶1 000)、Vimentin(1∶1 000)、β-action(1∶2 000)一抗,次日TBST 洗膜后,加入二抗后37 ℃孵育 1 h,TBST 洗膜后,ECL 显影。应用Quality One 分析条带灰度值,以β-action作为内参照,计算E-cadherin、Vimentin 蛋白的相对表达量。
1.7 统计学方法 采用SPSS22.0 统计软件。计量资料以±s表示,组间比较采用单因素方差分析或独立样本t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 HCC 组织及癌旁组织中miR-138 表达比较HCC 组织及癌旁组织中miR-138的相对表达量分别为0.41±0.09、1.08±0.06,两者相比P<0.05。
2.2 HCC 组织中miR-138 的表达与患者临床病理特征的关系 以60 例HCC 组织中miR-138 表达的均值为截断值,将60 例HCC 患者分为miR-138 高表达27 例和miR-138 低表达33 例。进一步统计分析显示,miR-138 的表达与HCC 患者的微血管侵犯、TNM 分期密切相关(P 均<0.05),而与患者年龄、性别、肿瘤直径、Edmondson 分级、AFP 水平、HBV 感染等临床病理特征无关,见表1。
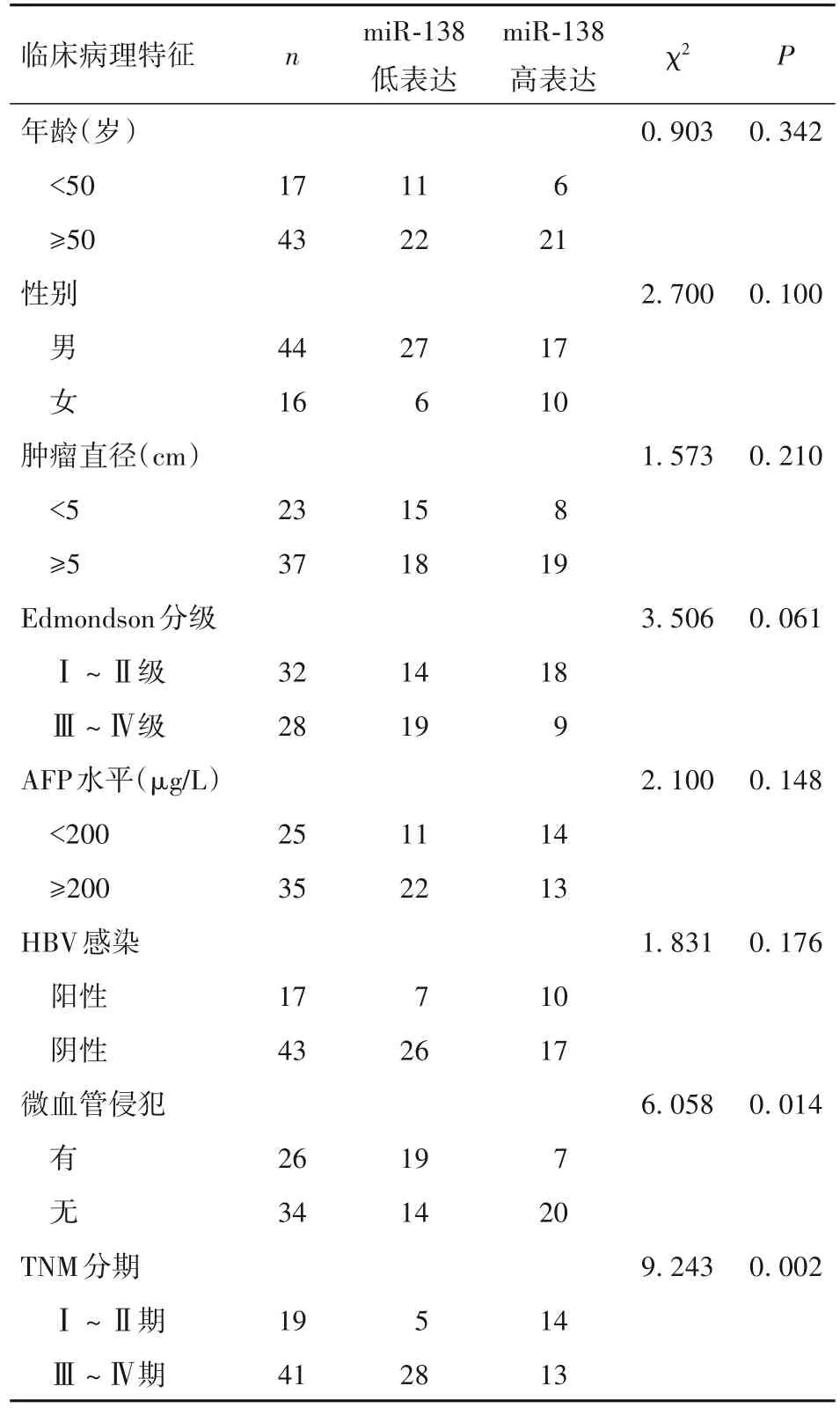
表1 HCC组织中miR-138的表达与患者临床病理特征的关系(例)
2.3 HCC 细胞与正常肝细胞中miR-138 表达比较 HCC 细胞系 MHCC97H、MHCC97L 和 HepG2 中miR-138 的相对表达量分别为 0.26 ± 0.12、0.58 ±0.10、0.62 ± 0.11,均低于正常人肝细胞系 L02 中miR-138的相对表达量(1.02±0.04),P均<0.05,且MHCC97H 细胞中miR-138 的相对表达量低于MHCC97L 细胞和 HepG2 细胞(P均<0.05)。选择miR-138 表达最低的MHCC97H 细胞作为后续实验研究对象。
2.4 miR-138 对MHCC97H 细胞侵袭能力的影响miR-138 mimics 组、NC-mimics 组细胞划痕愈合率分别为(86± 18)、(180± 21)个,两组相比P<0.01。
2.5 miR-138 对MHCC97H 细胞迁移能力的影响miR-138 mimics 组、NC-mimics 组细胞中 miR-138的相对表达量分别为 1.01 ± 0.03、4.89 ± 0.27,两组相比P<0.05。miR-138 mimics 组、NC-mimics 组细胞划痕愈合率分别为(21.4 ± 2.6)%、(65.8 ±4.6)%,两组相比P<0.01。
2.6 miR-138 对 MHCC97H 细 胞 EMT 的 影 响miR-138 mimics 组 MHCC97H 细 胞 E-cadherin 蛋 白表达高于NC-mimics 组(P<0.05),Vimentin 蛋白表达低于NC-mimics组(P<0.05),见表2。
表2 两组MHCC97H细胞EMT相关蛋白表达比较(±s)

表2 两组MHCC97H细胞EMT相关蛋白表达比较(±s)
组别NC-mimics组miR-138 mimic组t P E-cadherin蛋白表达0.22±0.08 1.39±0.19 9.830 0.001 Vimentin蛋白表达1.89±0.23 0.79±0.15 6.939 0.002
3 讨论
手术切除是目前治疗HCC 的首选方案,但患者术后常较早出现复发、转移,导致HCC 患者预后较差。HCC 复发转移的分子生物学机制尚未明确,尚缺乏有效的治疗手段。近年来,随着基因组学和蛋白组学的发展,恶性肿瘤侵袭进展的分子生物学机制逐渐被发现,为阻断恶性肿瘤的复发转移提供了新的方向。
miRNA 是一类非编码小分子RNA,长度21~24个碱基,通过调控下游靶基因的翻译,在人体生命活动中起着极其重要的作用。近年来,越来越多的相关研究显示miRNA 在恶性肿瘤的发生进展、微环境改变、侵袭转移等方面发挥着重要的调控作用[5]。随着研究的深入,在HCC 发生发展过程中也发现了许多起着重要调控作用的 miRNA。SUN 等[6]发现HCC 组织中miR-5692a 高表达,并且与临床分期、远处转移及不良预后密切相关。WANG 等[7]报道,上调miR-200b 能明显抑制HCC 细胞的生长和转移。miR-212[8]、miR-539[9]、miR-371[10]等 miRNA 相继被发现与HCC 发生进展、侵袭转移有关。但至今尚未发现在HCC 发生进展过程中起着关键作用的miR⁃NA。miR-138 是新近发现的miRNA 家族重要成员之一,研究发现 miR-138 在口腔鳞癌[11]、胆囊癌[12]、肾细胞癌[13]、非小细胞肺癌[14]等恶性肿瘤中异常低表达,扮演着“抑癌基因”的角色。目前有关miR-138 在HCC 中的研究甚少。本研究发现,HCC 组织中miR-138的表达低于癌旁组织,并且miR-138的表达与HCC 患者的微血管侵犯、TNM 分期关系密切。进一步研究发现,HCC 细胞中miR-138 的表达低于正常肝细胞,并且高侵袭性MHCC97H 细胞中miR-138 的表达低于低侵袭性的MHCC97L 细胞和HepG2 细胞,提示 miR-138 可能参与了 HCC 的发生发展,可能与HCC的侵袭转移有关。
为了进一步明确miR-138是否与HCC的侵袭转移有关,本研究在体外实验中选择高侵袭性MHCC97H 细胞做为后续研究对象,通过脂质体转染的方法,转染miR-138 mimics至MHCC97H细胞成功上调其miR-138 的表达,划痕实验和Transwell 侵袭实验显示,转染后MHCC97H 细胞划痕愈合率和穿膜细胞数明显下降,提示上调miR-138 能够明显抑制MHCC97H 细胞的迁移和侵袭能力。EMT 是肿瘤细胞侵袭迁移的重要启动环节[15-16]。EMT 发生时,上皮细胞源性标志物E-cadherin 表达会显著降低,而间质细胞源性标志物Vimentin 表达会显著增加[17]。本研究发现,上调miR-138的MHCC97H细胞E-cadherin 蛋白表达升高,而Vimentin 蛋白表达降低,提示上调miR-138能够明显抑制MHCC97H细胞的EMT,从而对细胞的迁移和侵袭能力起明显的抑制作用。
综上所述,miR-138在HCC 中表达降低,并且与HCC 细胞的侵袭能力有关;上调miR-138 能够抑制HCC细胞的EMT及侵袭迁移能力,这为HCC的治疗提供了新的研究方向。
