肾移植后新发性血栓性微血管病的研究进展
2021-01-22毛自陶冶
毛自,陶冶
四川大学华西医院,成都610041
血栓性微血管病(TMA)是一组表现为微血管病性溶血性贫血、血小板减少、微血管血栓形成、多器官受累的急性临床病理综合征[1]。药物、自身免疫性疾病、妊娠、感染、肿瘤、移植等均是引发TMA的病因[2]。肾移植后TMA 是肾移植后极其严重的并发症,目前尚无统一的定义,全身表现与其他TMA 相似,可观察到微血管病性溶血性贫血、血小板减少和血清乳酸脱氢酶水平升高等现象,但不同的是肾移植后TMA 患者终末器官损害仅限于肾脏移植物本身,且除肾功能不全外,很少会出现神经和胃肠道等多器官损伤相关的临床症状[3]。肾移植后TMA 通常分为新发性TMA 和复发性TMA,已有研究证明新发性TMA 更常见且预后更差[4]。如何早期识别诊断肾移植后新发性TMA 仍是一个难题,且对该病的治疗管理仍具挑战。现就肾移植后新发性TMA的研究进展情况作一综述。
1 流行病学
1926 年 MOSCHKOWITZ 首次报道,一位 16 岁的女性患者出现贫血、发烧、偏瘫和昏迷等TMA 引发的症状。1952年SYMMERS 根据该类疾病的临床表现进一步正式定义了TMA,TMA 的主要病理特点为全身微循环中内皮细胞损伤、血小板异常聚集以及血栓形成,大多数的TMA 患者均有血小板减少、溶血性贫血及全身各器官不同程度受损甚至衰竭等临床表现。TMA 可分为原发性TMA 和继发性TMA,而药物、自身免疫性疾病、妊娠、感染、肿瘤、移植等均可在特定条件下触发TMA,统称为继发性TMA[5]。BAYER 等最近的研究纳入了法国四家医院 2009—2016 年 564 例诊断为 TMA 的患者,其中有33 例(6%)是原发性TMA、531 例(94%)是继发性TMA,表明继发性TMA 占大多数;移植相关性TMA亦属于继发性,占17%。移植相关性TMA 主要指造血干细胞、肾、肝、肺等器官移植后发生TMA,1980年第一次被提出,发病率在0~74%[6]。目前,已有临床指南明确了造血干细胞移植后TMA 的诊断标准[7],但是没有针对肾移植后TMA 的诊断标准。对于肾移植患者来说,TMA 是一种严重且致命的并发症,常导致移植物失功及患者预后不佳。据报道,肾移植后TMA 的发病率为1.1%~14%,诊断后3 年病死率为50%[8]。REYNOLDS 等[8]对美国肾脏病数据系统15 870 例肾移植受者进行统计研究发现,肾移植后TMA 中新发数量为112 例,而复发仅有12 例;OZDEMIR 等[9]对 272 例肾移植受者研究发现,肾移植后新发性TMA 有74例(27.2%);即肾移植后新发性TMA 越来越常见,但临床上对该病的认识和管理仍有很多欠缺。
2 病因及发病机制
肾移植后新发性TMA 与许多因素相关,最常见的包括抗体介导的排斥反应(AMR)或使用免疫抑制剂[10]。其他罕见的病因有病毒感染、抗病毒药物、局部缺血再灌注损伤、抗血管内皮生长因子抑制剂或C3肾小球病在移植后发生表型转化等[2,4]。
肾移植后新发性TMA 的发病机制尚不完全清楚。临床上大多数肾移植后新发性TMA 的病例以AMR或免疫抑制剂相关为主,AMR与免疫抑制剂相关的TMA有不同的发病机制。
有研究证实了AMR 是肾移植后新发性TMA 最常见也是最重要的原因[9]。AMR的主要作用部位集中在移植肾肾小管周围毛细血管(PTC)和肾小球毛细血管的内皮细胞,PTC C4d 的阳性检测是AMR 的间接证据[11]。SATOSKAR 等[12]对 960 例进行移植肾活检的患者进行回顾性研究,比较了PTC C4d 阳性(n=243)和C4d 阴性(n=715)患者的TMA 患病率,两组中有超过90%的患者接受环孢素治疗;结果共有59 例患者诊断为新发性TMA,该作者表示免疫抑制剂的使用可能对TMA 的发生具有累积效应,但PTC C4d阳性患者TMA的患病率(13.6%,33/245)与C4d阴性患者TMA 的患病率(3.6%,26/715)比较差异有统计学意义,表明体液排斥反应在肾移植后新发性TMA的发病机制中发挥作用。
免疫抑制剂相关的TMA 主要是指肾移植受者使用钙调神经磷酸酶抑制剂(CNIs)或雷帕霉素靶蛋白抑制剂(mTORi)后发生TMA。目前认为CNIs 相关的TMA 的发病机制可能为:血管活性肽之间失去平衡,增加血管收缩因子(如:内皮素)和血小板凝集因子(如:血栓素A2)的合成,同时减少血管舒张因子(如:前列环素E2和前列环素)和血小板聚集抑制因子(如:一氧化氮)的合成,从而导致血小板聚集和微血管血栓形成[13];CNIs 的血小板活化、促凝作用和抗纤维蛋白溶解作用均与TMA 的发生有关,特别是当由于其他机制(如缺血再灌注损伤、抗体介导的排斥反应等)导致血管内皮细胞受损时[14];环孢素使血管内皮细胞释放微粒激活补体替代途径是明确的导致 TMA 发病的机制[15]。mTORi 相关的 TMA 的发病机制可能为:mTORi 具有抗血管生成的特殊作用,并且可以随着血管内皮祖细胞的死亡而降低肾脏血管内皮生长因子的表达[16],与TMA 的发生发展相关;血管内皮生长因子受抑制已被证实与肾脏补体因子H(CFH)水平降低有关[17],故有潜在CFH 基因突变的患者在使用mTORi 的情况下更容易发生移植后 TMA[18];mTORi 使用可能会妨碍内皮损伤的修复[16];mTORi 的促凝血和抗纤维蛋白溶解作用可能也会导致TMA 的发生[19]。与单独使用任何一种药物相比,联合CNIs和mTORi抑制剂的免疫抑制方案可使TMA的发生风险更高[20]。
目前尚不清楚接触相同危险因素时为什么只有少部分的肾移植受者发生TMA。一种假设是,只有内皮损伤和(或)促凝血状态具有潜在易感性的患者才会出现这种并发症。CHUA 等[21]认为,在肾脏中的补体激活是移植后出现TMA的共同特征。
3 诊断
移植相关的TMA 常用的临床诊断标准为[22]:①乳酸脱氢酶大于正常值;②血小板降低(血小板计数<50×109/L 或减少50%以上);③贫血或需要输血治疗;④外周血涂片破碎红细胞数>4%;⑤无凝血功能障碍且直接、间接抗人球蛋白试验(Coombs 试验)阴性。此诊断标准要求所有的实验室检查必须同时进行,并且标准①~④需至少2 次连续检测为阳性结果。JODELE等[23]把蛋白尿(随机尿蛋白>30 mg/L)、控制血压需使用2种以上降压药或恶性高血压以及补体攻膜复合物C5b-9 的检测增加作为移植相关TMA 的部分诊断标准,提高了移植后TMA 的诊断效率。TMA 的肾脏组织病理学变化在临床上是非特异性的,常影响肾小球和肾小管管周微循环,病理过程可分为急性(或活动性)和慢性。急性或活动性TMA 病理特点为:内皮细胞损伤、血小板聚集、破碎红细胞出现和血栓形成以及较小程度的活动性炎症占优势(图1);慢性TMA的病理特点为:持续性内皮损伤,肾小球基底膜增厚形成双轨征,动脉和小动脉内膜和中膜有重塑的迹象,增加了动脉和小动脉壁中的基质和细胞层,导致血管壁硬化,呈洋葱皮样改变(图2)[20]。
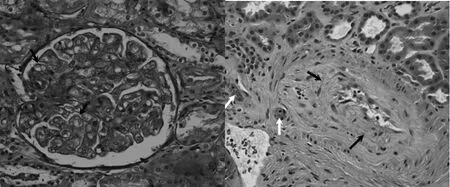
图1 急性TMA肾组织病理

图2 慢性TMA肾组织病理
肾移植后TMA 目前没有统一的诊断标准,肾移植后新发性TMA 的临床表现是多种多样的,部分患者的实验室检查可能会因无异常而导致漏诊,确诊肾移植后新发性TMA 主要还是结合患者的临床特点以及肾活检的结果[24]。在许多文献报道中,肾移植后新发性TMA 被分为全身性和局部性两种类型。以往全身性TMA 是指肾移植后出现典型的TMA 临床特征,TEIXEIRA 等[25]最近的研究定义全身性TMA 为发生在肾移植后3 个月内,出现血小板减少及微血管性溶血性贫血症状的综合征。大多数患者仅限于移植肾有TMA 的病理特征,可表现出缓慢进展性肾功能不全和(或)高恶性高血压等症状,称为局部 TMA[24]。SAIKUMAR 等[26]纳入了 1989—2015年经肾活检诊断为新发性TMA 的17 例患者作回顾性研究,其中AMR 相关的有5 例、CNIs 相关的有12例,发现大多数患者在移植后的早期被确诊,并且没有出现全身性TMA 的任何症状,研究内的大多数患者在肾活检前3 个月中均未出现高CNIs 谷浓度,因此正常的CNIs 谷浓度并不排除与CNIs 相关的TMA。该研究中与CNIs 相关的TMA 的临床表现为血清肌酐(SCr)的缓慢升高,而与AMR 相关的TMA临床表现为急性移植肾功能障碍,即SCr 绝对值在48 h 内增加到 3 mg/L 以上或 7 d 内增加至 1.5 倍基础值以上。故由此可知许多肾移植后新发性TMA患者不一定表现出全身性TMA 的临床症状,且TMA诊断标准相关的实验室检查数据可能在正常范围内或未发生改变,仅出现Scr 的异常变化,所以基于TMA 典型临床症状和诊断标准的实验室检查对肾移植后新发性TMA 进行诊断非常不可靠,诊断的金标准仍然是肾活检[20]。SCHWIMMER 等[27]发现全身性TMA 患者比局部TMA 患者更容易发生肾衰竭,且早期移植物失功率更高;局部TMA 的短期预后比全身性TMA 更好,但与全身性TMA 相比,局部TMA 在移植后的过程中常不容易被发现和诊断。目前尚不清楚是否是因为全身性TMA 常发生更严重的功能障碍所以更易进行肾活检和确诊。因此根据移植后TMA 最新的诊断标准,结合肾移植患者全身性、局部性TMA 的临床特征,早期行肾活检以识别、诊断TMA对肾移植患者非常重要。
4 治疗
针对肾移植后新发性TMA 不同的病因具有不同的发病机制,因此需给出个性化的治疗方案。目前常见的治疗方法如下。①免疫抑制剂的管理。一些研究发现,将CNIs 调整为另一种CNIs 或mTORi后出现 TMA 的缓解[28]。相反,SATOSKAR 等[12]研究表明,在肾移植后新发性TMA 患者中持续使用、暂时停药、再调节或停用环孢素的结果没有差异,且目前没有前瞻性的临床对照研究评估这种方法的有效性。但是停用可能致病的免疫抑制剂是临床治疗免疫抑制剂相关的 TMA 的第一步[26]。SCHWIMMER等[27]研究显示,全身性 TMA 患者除停用 CNIs 外,还需行血浆置换治疗;局部TMA 患者通常对减少或暂时停用CNIs 有治疗反应,并且无需常规进行血浆置换来挽救移植物。②血浆置换。血浆置换是血栓性血小板减少性紫癜患者的首选治疗[29]。IKEZOE等[30]在移植后TMA 的指南中提出,血浆置换治疗造血干细胞移植后TMA 患者的平均缓解率为36.5%(0~80%)、病死率为80%(44%~100%)。但在肾移植后新发性TMA 中的疗效尚不确定。血浆置换治疗肾移植后CNIs 相关的TMA 的机制可能是去除血小板聚集因子(如血栓素A2),并补充前列环素刺激因子等缺乏因子,恢复了血管收缩和血管舒张之间的平衡[13]。对于一部分有潜在补体失调的TMA 患者,血浆置换可通过去除有缺陷的突变蛋白和(或)补体因子的自身抗体来改善预后[20]。对于AMR 诱导的TMA,治疗的主要手段是血浆置换,伴或不伴静脉输注免疫球蛋白,这可能是通过去除和(或)下调抗供体 HLA 抗体的产生来发挥作用的[3,24]。有些研究认为血浆置换的疗效取决于何时开始治疗,在疾病早期开始血浆置换可降低移植后TMA 患者的病死率,改善患者的预后[6]。③贝拉西普。贝拉西普常作为替代CNIs或mTORi的免疫抑制剂,是一种CTLA4-IgG1 融合蛋白,该蛋白可阻断CD28 共刺激途径,防止T淋巴细胞活化,从而避免钙调神经磷酸酶的产生[31]。目前仅个案病例报道了使用贝拉西普后TMA 得到缓解,并没有大型的临床研究证明贝拉西普的有效性[31-32]。④依库珠单抗。依库珠单抗是抗C5 人源化鼠单克隆抗体,通过竞争性阻断C5 裂解形成攻膜复合物,来抑制补体终末阶段的活化,从而减轻内皮受损和减少炎症反应的发生。已有临床研究证实,依库珠单抗能有效抑制补体介导的aHUS,改善患者预后,且不良反应少[33]。依库珠单抗在国外已被批准用于治疗aHUS,对于那些对血浆置换治疗效果欠佳或者依赖的患者来说是首选治疗。一些国家的指南认为一旦确诊aHUS 后应立即启动依库珠单抗治疗且需终身维持,也有指南推荐应先进行5 次血浆置换治疗,如病情无改善再转用依库珠单抗治疗[34]。补体异常激活机制是肾移植后TMA 发病的核心,移植相关的TMA 的治疗参照aHUS 的治疗方案,诱导期为每周 900 mg(4 周),维持期为每周 1 200 mg(2 周)[35]。EPPERLA 等[13]对 5例使用了依库珠单抗治疗免疫抑制剂相关的移植后TMA 的患者进行回顾性研究发现,3 例患者经治疗后得到了临床缓解。JODELE 等[36]使用依库珠单抗治疗18 例严重移植后TMA 患者,治疗过程中主要抑制血清总补体活性小于正常下限的10%,维持依库珠单抗的血药浓度大于99µg/mL,最终有11例患者病情得到缓解,与未使用依库珠单抗的11例同样严重移植后TMA 患者1 年的生存率为56% vs 9%(P=0.003)。
5 结语
新发性TMA 是肾移植的严重并发症,预后差,对肾移植后新发性TMA 进行早期诊断、干预与治疗能够明显提高多数患者的预后。根据移植后TMA最新的诊断标准,同时结合本文中总结的肾移植患者全身性、局部性TMA 的临床特征,早期行肾活检以识别、诊断TMA 对肾移植患者非常重要,局部性TMA 的短期预后比全身性TMA 更好。治疗方面,免疫抑制剂相关的TMA 治疗的第一步就是停用相关免疫抑制剂,许多肾移植后新发性TMA 患者血浆置换的疗效尚不确切。补体系统异常激活是肾移植后新发性TMA 发病机制的核心,在治疗选择中发挥重要作用,抗C5单克隆抗体依库珠单抗在某些国家和地区的使用已获得了较为满意的结果,但由于依库珠单抗的治疗成本高,临床使用仍受到一定限制,我国对肾移植后新发性TMA 的治疗仍以血浆置换为主。国内外对依库珠单抗治疗移植后TMA 的研究的样本量仍相对较少,应开展前瞻性、多中心临床对照试验进一步验证依库珠单抗的疗效。除此之外,还应开发更多抑制补体系统的靶向药物。
