AFP对正常肝细胞和肝癌细胞生物钟基因表达的影响
2021-01-22何前进毛伟明张喜华岑红兵杨盛力赵东明
何前进,毛伟明,张喜华,岑红兵,杨盛力,赵东明
1 黄冈市中心医院,湖北黄冈438000;2 华中科技大学同济医学院附属协和医院;3 华中科技大学同济医学院附属同济医院
越来越多的研究表明,甲胎蛋白(AFP)除了扮演肝癌诊断生物学标志物的角色外,还和肝癌患者的恶性预后以及肝癌细胞的恶性生物学行为密切相关[1-2]。AFP 可以促进肝癌细胞增殖,抑制肝癌细胞凋亡,促进肝癌细胞的侵袭和转移,还介导了肝癌的化疗耐药[1-4]。近年来许多研究发现,生物钟以及生物钟基因的紊乱和肿瘤的发生发展密切相关。一些大规模流行病学调查发现,倒夜班的人群更易患乳腺癌、前列腺癌和结直肠癌[5-7]。且一些动物实验表明,生物钟紊乱的负瘤小鼠肿瘤生长更快[8-9]。甚至有细胞实验显示,改变细胞中生物钟基因的表达可以改变细胞的增殖能力、侵袭能力和对化疗药物的敏感性[10-11]。我们前期研究发现,过表达AFP可以促进肝癌细胞的侵袭和迁移,其还可以通过上调MDR1的表达引起肝癌细胞对阿霉素产生耐药性[3-4]。本研究拟在前期研究的基础上,进一步探索AFP对正常肝细胞和肝癌细胞生物钟基因表达的影响。
1 材料与方法
1.1 材料 兔抗人AFP 单克隆抗体购于Cell Sig⁃naling 公司,鼠抗人β-actin 单克隆抗体购于Santa Cruz 公司,兔抗人 Cry1、Cry2、Clock、Bmal1、NPAS2多克隆抗体购于Abcam 公司,鼠抗人Per1、Per2 和Per3 多克隆抗体购于Novus 公司,胎牛血清购于Hy⁃clone 公司,AFP 过表达的慢病毒载体购于上海吉凯基因化学技术有限公司,TRIzol、SYBR®Green PCR Master Mix、PCR 引物购于Life公司,正常肝细胞L02细胞和肝癌细胞株SMMC-7721 细胞由武汉同济医院董汉华博士馈赠。
1.2 构建AFP 过表达细胞 ①细胞培养:将正常肝细胞L02 细胞和肝癌细胞株SMMC-7721 细胞解冻后置于含10%FBS、100 U/mL 青霉素和100µg/mL链霉素的 DMEM 培养基中于 37 ℃、5% CO2、饱和湿度条件的培养箱中培养,待细胞培养融合至80%时,用0.25%胰酶消化后按照1∶3 进行传代。②细胞转染及分组:取传3 代、对数生长期、生长状态良好的正常肝细胞L02细胞和肝癌细胞株SMMC-7721细胞,分别接种于6 孔板,每孔1×105个。随机将正常肝细胞L02细胞分为AFP过表达组1、AFP空转组1,将肝癌细胞株SMMC-7721 细胞分为AFP 过表达组2、AFP 空转组2,每组设3个复孔。AFP 过表达组按10 MOI 加入AFP 过表达慢病毒和含聚凝胺的培养基,AFP 空转组按10 MOI 加入AFP 空载体和含聚凝胺的培养基。转染12 h 后,吸弃含聚凝胺的上清液,加入新鲜培养基(含5%嘌呤霉素)继续培养60 h。③转染效率验证:采用real-time PCR 法。遵照TRIzol 使用说明书提取各组细胞总RNA,测定RNA的浓度和纯度后取2 µg 的mRNA 逆转录为cDNA。按照SYBR®Green PCR Master Mix(2×)说明书操作步骤进行定量PCR 反应,每个样本设3 个复孔。经过预实验后将逆转录后的cDNA 进行10 倍稀释做为模板。荧光定量PCR 扩增反应体系:模板2 µL,10 µmol/L 的上游和下游引物各1 µL,SYBR®Green Mix 10µL,ddH2O 6µL,总反应体系为20µL。反应条件:95 ℃预变性 1 min,94 ℃变性 60 s,56 ℃退火 45 s,72 ℃延伸45 s,共 33 个循环,72 ℃再延伸10 min。以 β-actin 为内参,采用 2-ΔΔCt法计算 AFP 相对表达量。所用引物序列见表1。

表1 PCR所用引物序列
1.3 AFP 对正常肝细胞和肝癌细胞中生物钟基因表达的影响
1.3.1 生物钟基因mRNA 检测 采用real-time PCR法,方法同1.2中③。
1.3.2 生物钟基因蛋白检测 采用Western blot⁃ting 法。裂解并提取细胞蛋白,通过BCA 法测定蛋白浓度,进行蛋白定量后在10%~12%的十二烷基硫酸钠—聚丙烯酰胺凝胶(SDS-PAGE)上以每孔20µL蛋白上样,进行电泳后将蛋白转移至聚偏二氟乙烯(PVDF)膜上。分别加入鼠抗人Per1、Per2和Per3多克隆抗体(均1∶500 稀释);兔抗人NPAS2、Clock、Bmal1、Cry1、Cry2 多克隆抗体(均1∶400 稀释);兔抗人AFP 单克隆抗体(1∶300 稀释);鼠抗人β-actin 单克隆抗体(1∶2 500 稀释)。分别加入HRP 标记的兔抗鼠二抗、羊抗兔二抗(均1∶2 500稀释)。化学发光法显色,计算机扫描蛋白质条带后,采用Image J 软件进行灰度分析。将β-actin 作为内参照,以生物钟蛋白与β-actin 的比值代表该生物钟蛋白的相对表达水平,实验重复3次取平均值。
1.4 统计学方法 采用SPSS22.0 统计软件。计量资料以±s表示,两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
AFP mRNA 在 AFP 过表达组 1、AFP 空转组 1 中的相对表达量分别为372.00±14.0、1.00±0.06,两组相比P<0.05。AFP mRNA在AFP过表达组2、AFP空转组2 中的相对表达量分别为492.67 ± 7.02、1.00 ± 0.06,两组相比P<0.05。AFP 转染对 L02、SMMC-7721细胞生物钟基因表达的影响见表1~4。
表1 AFP转染对L02细胞生物钟基因mRNA表达的影响(±s)

表1 AFP转染对L02细胞生物钟基因mRNA表达的影响(±s)
组别AFP空转组1 AFP过表达组1 P生物钟基因mRNA Clock 1.00±0.07 1.70±0.09<0.05 Bmal1 1.00±0.05 0.66±0.05<0.05 Per1 1.00±0.04 0.26±0.03<0.05 Per2 1.00±0.05 0.80±0.05<0.05 Per3 1.00±0.01 0.12±0.04<0.05 Cry1 1.00±0.05 1.00±0.09>0.05 Cry2 1.00±0.05 0.98±0.07>0.05 NPAS2 1.00±0.03 1.02±0.09>0.05
表2 AFP转染对L02细胞生物钟基因蛋白表达的影响(±s)
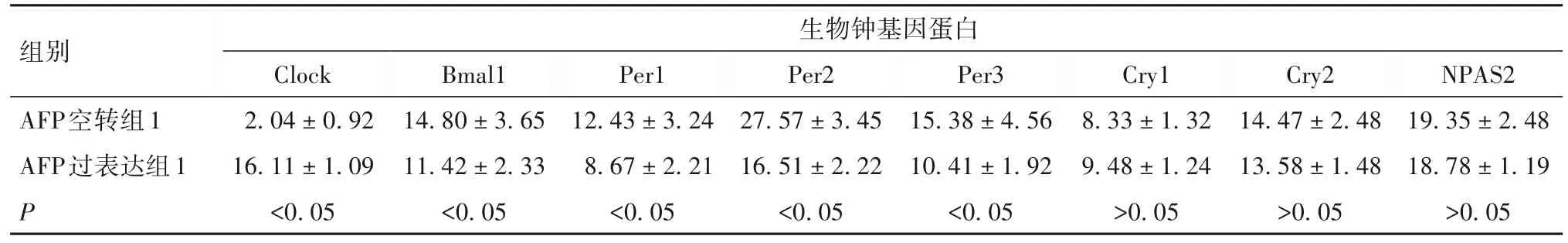
表2 AFP转染对L02细胞生物钟基因蛋白表达的影响(±s)
组别AFP空转组1 AFP过表达组1 P生物钟基因蛋白Clock 2.04±0.92 16.11±1.09<0.05 Bmal1 14.80±3.65 11.42±2.33<0.05 Per1 12.43±3.24 8.67±2.21<0.05 Per2 27.57±3.45 16.51±2.22<0.05 Per3 15.38±4.56 10.41±1.92<0.05 Cry1 8.33±1.32 9.48±1.24>0.05 Cry2 14.47±2.48 13.58±1.48>0.05 NPAS2 19.35±2.48 18.78±1.19>0.05
表3 AFP转染对SMMC-7721细胞生物钟基因mRNA表达的影响(±s)

表3 AFP转染对SMMC-7721细胞生物钟基因mRNA表达的影响(±s)
组别AFP空转组2 AFP过表达组2 P生物钟基因mRNA Clock 1.00±0.07 2.03±0.07<0.05 Bmal1 1.00±0.05 0.75±0.03<0.05 Per1 1.00±0.04 0.11±0.01<0.05 Per2 1.00±0.04 0.81±0.02<0.05 Per3 1.00±0.01 0.23±0.03<0.05 Cry1 1.00±0.05 0.83±0.07<0.05 Cry2 1.00±0.05 1.00±0.09>0.05 NPAS2 1.00±0.07 1.00±0.03>0.05
表4 AFP转染对SMMC-7721细胞生物钟基因蛋白表达的影响(±s)
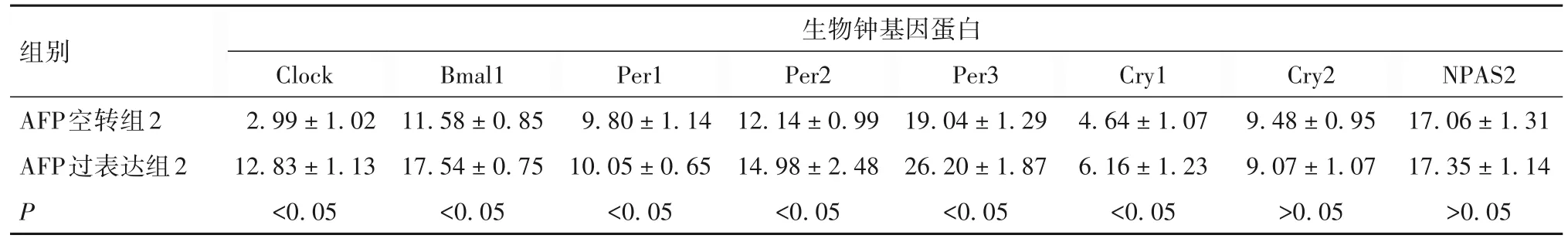
表4 AFP转染对SMMC-7721细胞生物钟基因蛋白表达的影响(±s)
组别AFP空转组2 AFP过表达组2 P生物钟基因蛋白Clock 2.99±1.02 12.83±1.13<0.05 Bmal1 11.58±0.85 17.54±0.75<0.05 Per1 9.80±1.14 10.05±0.65<0.05 Per2 12.14±0.99 14.98±2.48<0.05 Per3 19.04±1.29 26.20±1.87<0.05 Cry1 4.64±1.07 6.16±1.23<0.05 Cry2 9.48±0.95 9.07±1.07>0.05 NPAS2 17.06±1.31 17.35±1.14>0.05
3 讨论
AFP 是白蛋白家族中糖蛋白的一员,胎儿时期主要由胎儿肝细胞及卵黄囊合成,在成人血清中含量极低,但在肝癌患者的血清中却明显升高,因而在临床上常被作为肝癌的诊断标记物[1]。除了扮演肝癌诊断标记物的角色外,AFP 还是一种具有多种功能的蛋白,与肝癌的发生、发展关系密切。研究发现AFP可以与肝癌细胞膜上的受体结合,进而激活Ca2+和 PI3/AKT 等信号通路,通过上调 c-fos、Src、c-jun、Ras 等癌基因的表达,促进肝癌细胞的增殖[12-13]。此外AFP 还可通过抑制Caspase-3 的活性诱导肝癌细胞产生凋亡[12-13]。我们的前期研究发现AFP 能够上调肝癌细胞中的多药耐药基因MDR1 的表达,进而引起肝癌细胞对阿霉素产生耐药性[3]。本研究则发现AFP还可以引起正常肝细胞和肝癌细胞中生物钟基因的表达紊乱。主要表现为引起Clock 的表达上调和Bmal1、Per1、Per2、Per3 的表达下调。正常肝细胞和肝癌细胞中生物钟基因的变化趋势基本一致,只是在Cry1 基因上略有差异,在L02 细胞中AFP 引起Cry1的表达下调,在SMMC-7721细胞中Cry1的表达无明显变化。
生物钟是自然界中的生命物质在漫长的进化过程中形成的与自然界同步的内在生物节律。在分子水平上由Clock、Bmal1、Per1、Per2、Per3、Cry1和Cry2等基因共同调控[14-15]。调控方式为Clock和Bmal1形成异二聚体,结合到Per1、Per2、Per3 和Cry1、Cry2 基因的启动子上并激活其转录,表达产物Per1-3 和Cry1-2 蛋白又作为负性元件与Clock/Bmal1 结合并抑制其活性,进而阻遏Per1-3 和Cry1-2 的进一步转录。因基因转录、翻译和蛋白入核需要一定时间,使得生物节律分子振荡以近24 h 为周期自主进行,生物钟基因的这种反馈调节构成了细胞内精准的内源性“分子钟”。长期的昼夜和饮食不规律以及一些致癌因素可导致机体生物钟紊乱,进而引起下游钟控基因表达异常,促进了肿瘤的发生和发展[14-15]。
Clock基因是生物节律的必要调控者,在生物钟体系中起着中心作用。Clock 在肿瘤组织中呈过表达状态,研究显示Clock 过表达可以促进肿瘤细胞的侵袭和迁移[14-15]。Bmal1则和Clock基因的功能相反,Bmal1 过表达可抑制肿瘤形成和增加肿瘤细胞化疗药物敏感性[14-15]。Per1、Per2 和 Per3 结构和功能相似,均能抑制肿瘤细胞的生长和增殖,诱导细胞凋亡,在肿瘤组织中普遍呈低表达状态,被认为是潜在的抑癌基因[14-15]。AFP 上调促癌基因 Clock,下调抑癌基因 Bmal1、Per1、Per2 和 Per3 的表达,正好和AFP 促进肝癌细胞增殖,抑制肝癌细胞凋亡的生物学行为相一致,也和临床上AFP 高表达的患者较易出现复发和转移、预后不良的临床现象相一致。
本研究的意义在于揭示了AFP 不仅是肝癌的诊断和预后标记物,还是一个有生物学功能的蛋白。AFP可以引起正常肝细胞和肝癌细胞中生物钟基因的表达紊乱,进而引起正常肝细胞和肝癌细胞内生物节律紊乱,加速正常细胞的恶变和肿瘤细胞的增殖和侵袭迁移。在临床上,对血清AFP 偏高的肝炎、肝癌患者均应加强监测和随访,警惕肝癌的发生和发展。另一方面,最新的研究显示逆转生物钟紊乱可能是治疗肿瘤的途径之一[16],能否通过抑制AFP的表达进而逆转正常肝细胞和肝癌细胞生物钟紊乱达到控制肝癌的作用,还需要进一步研究和探索。
