4种非洲猪瘟核酸检测试剂盒性能比较分析
2021-06-02喻恒军喻正军
蔡 行 ,石 建 ,喻恒军 ,冯 静 ,陈 娟 ,谢 惠 ,喻正军 *
(1.湖南国测生物科技有限公司,湖南 长沙 410000;2.湖南中净生物科技有限公司,湖南 长沙 410000)
非洲猪瘟病毒(African Swine fever virus,ASFV)是一类古老的病毒,早在1921年在非洲肯尼亚首次发现,至今有约100年的历史。非洲猪瘟(African swine fever,ASF)即是由非洲猪瘟病毒引起的家猪、野猪的一种急性、热性、高度接触性动物传染病,所有品种和年龄的猪均可感染,发病率和死亡率高,可达100%[1]。世界动物卫生组织将其列为法定报告动物疫病,中国也将其列为一类动物疫病。ASF 最早于1921年在非洲肯尼亚被发现,1957年传入欧洲,1971年传入加勒比海地区和南美洲,2007年传入高加索地区,现仍在非洲、南撒丁岛和高加索地区流行,给世界各国的养猪业造成了巨大经济损失[2]。2018年8月3日,中国确诊首例非洲猪瘟疫情,之后不断蔓延,2020年4月19日,海南报道非洲猪瘟疫情后,我国内地31个省份,已全部发现非洲猪瘟疫情。
目前尚无有效的疫苗对非洲猪瘟进行防控,各地养殖场需依赖生物安全措施,并组建快速诊断实验室,使用高精准的检测方法,对进出入猪场物质进行监测。该研究旨在通过比对不同厂家的非洲猪瘟核酸诊断试剂盒的主要性能,为猪场实验室提供科学的试剂盒选择方案,帮助猪场合理选择试剂盒,构筑稳固的生物安全检测防线,阻击非洲猪瘟的入侵。
1 材料与方法
1.1 试剂盒与标准物质
4种商品化的非洲猪瘟病毒实时荧光PCR检测试剂盒,A厂家试剂盒(非预混型)批次342020005,B厂家试剂盒(非预混型)批次202006,C厂家试剂盒(预混型)批次20191118,D厂家试剂盒(预混型)批次20200301;B646L基因标准品GBW(E)091034(批号:2020001)购自中国牧工商集团有限公司。
1.2 试验仪器
实时荧光定量PCR仪SLAN-48P购自上海宏石医疗科技有限公司。
1.3 试验方法
1.3.1 线性扩增试验
将B646L基因标准品稀释至1 000 copies/μL、100 copies/μL、20 copies/μL、4 copies/μL、0.8 copies/μL,共5个稀释度,使用4种试剂盒,按照其说明书配置PCR体系,进行荧光 PCR 检测,每个稀释度重复3 次,同时设置阴阳性对照。分析各试剂盒对不同梯度核酸检测Ct值,比较不同试剂盒对各稀释度的检出率和变异系数。
1.3.2 敏感性试验
将B646L基因标准品稀释至20 copies/μL,使用4种试剂盒对稀释后的标准品进行荧光 PCR 扩增,每种试剂盒重复检测48个孔,统计该拷贝数下不同试剂盒的检出率。
1.3.3 假阳性检测试验
使用纯化水做无模板阴性对照,每种试剂盒配置46个阴性反应,设置阴阳性对照。统计不同试剂盒出现假阳性的次数,假阳性概率最低者为佳。
2 结果与分析
2.1 线性扩增结果
使用纯水做无模板阴性,每种试剂盒配置46个阴性反应,设置阴阳性对照,统计不同试剂盒出现假阳性(有Ct值且曲线不典型)的次数,A试剂盒未检到阳性,B试剂盒未检测到阳性,C试剂盒检测2个非特异性阳性反应,D试剂盒检测到1个非特异性阳性反应,具体结果见图2与表4。
使用4种试剂盒对稀释后的标准品进行检测时,4种试剂盒在1 000 copies/μL、100 copies/μL两种拷贝数的检出率均为100%,在拷贝数稀释至20 copies/μL时出现检出率的差异:A试剂盒的检出率为100%(3/3),B试 剂:检 出 率为33.33%(1/3),C试剂盒的检出率为33.33%(1/3),D试剂盒的检出率为66.67%(2/3)。A试剂盒在20 copies/μL的检出率高于其他试剂盒,具体结果见表1与表2。
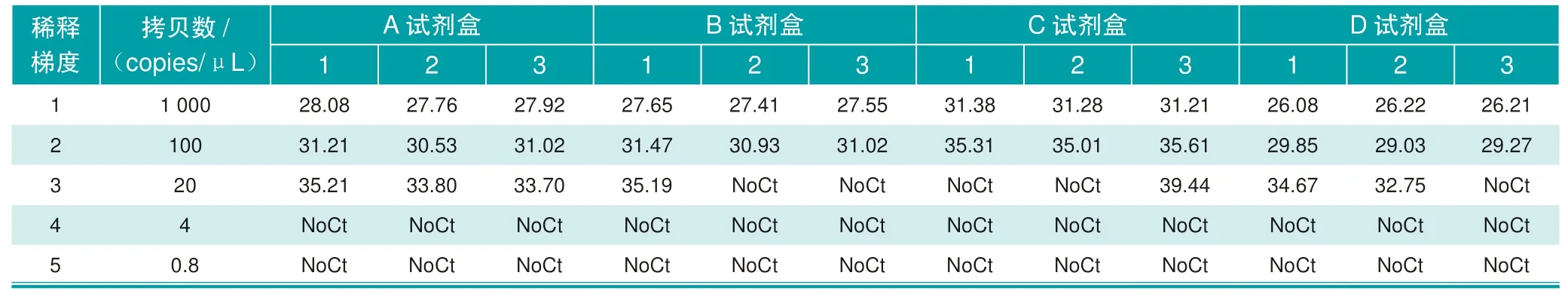
表1 4种非洲猪瘟核酸检测试剂盒对梯度稀释后的标准品检测Ct值
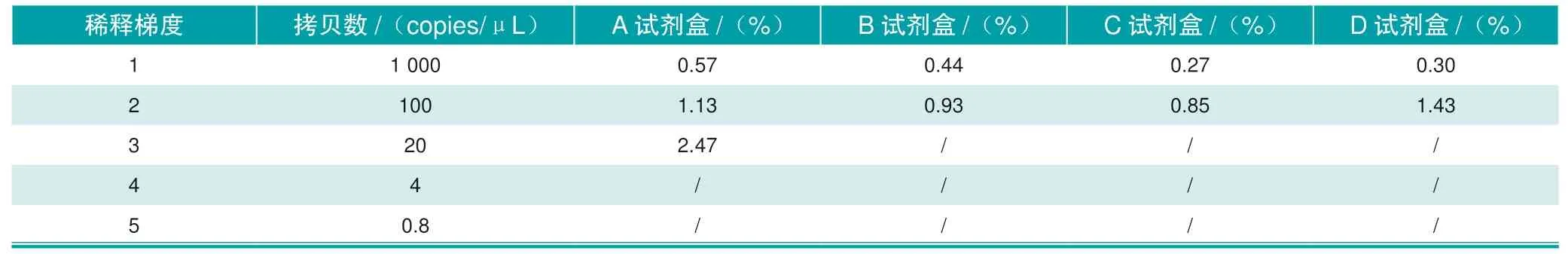
表2 4种非洲猪瘟核酸检测试剂盒对标准品检测Ct值的变异系数
2.2 敏感性试验结果
使用4种试剂盒对稀释至20 copies/μL的标准品进行检测,结果显示A试剂盒的检出率最高为91.67%(44/48),B试剂盒的检出率次之为85.42%(41/48),C试剂盒的检出率为79.17%(38/48),D试剂盒的检出率为58.33%(28/48),具体结果见图1与表3。
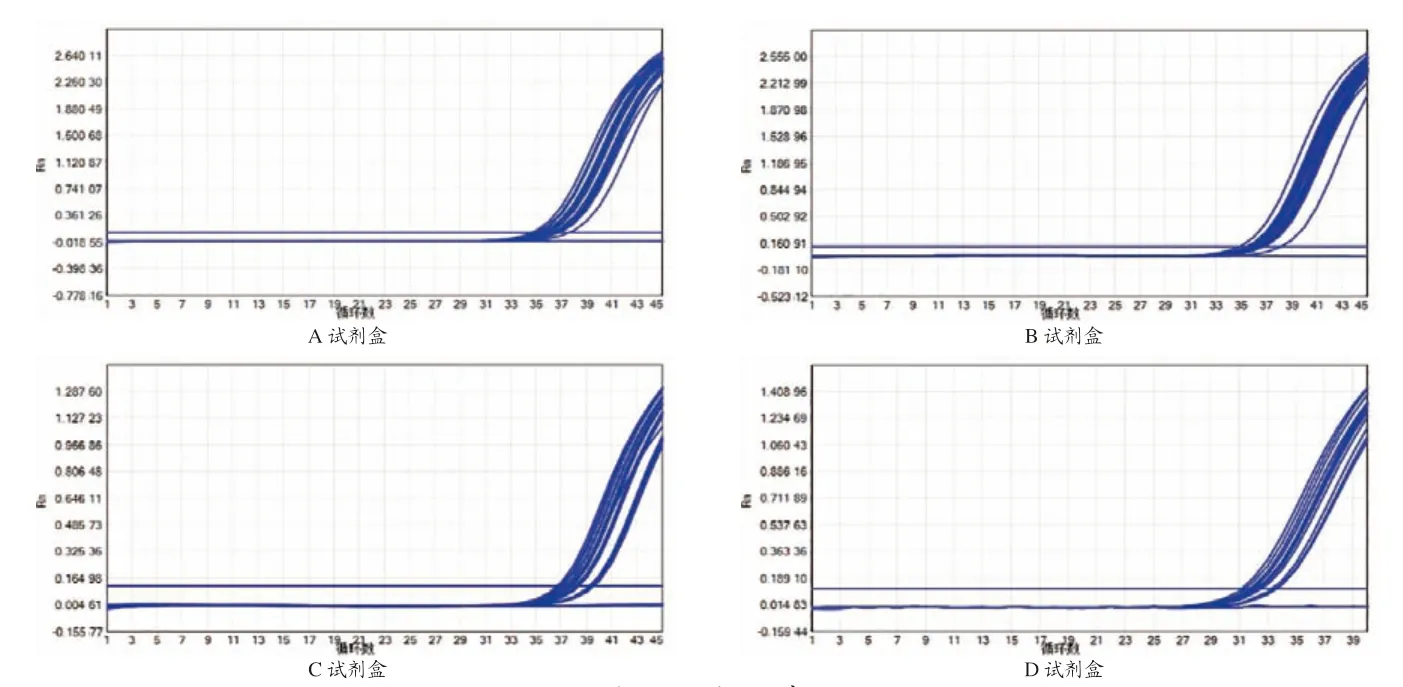
图1 4种试剂盒敏感性试验
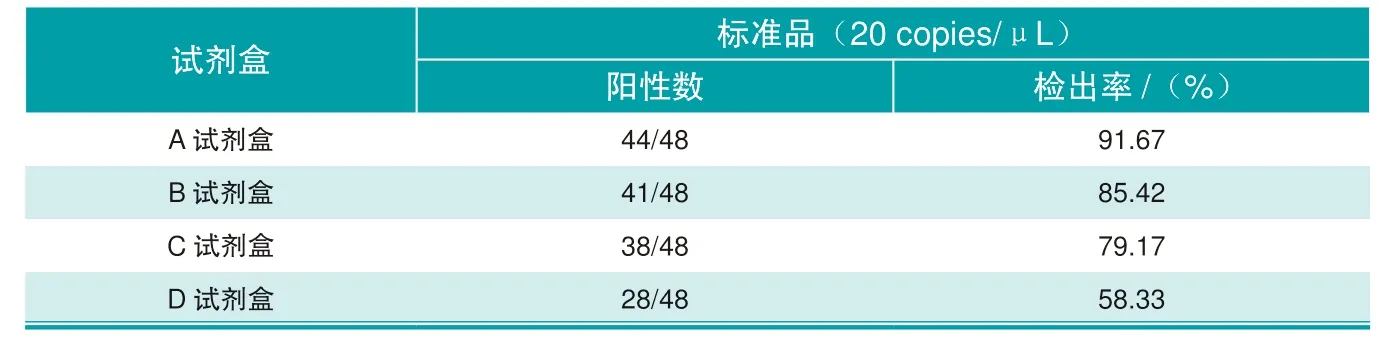
表3 4种非洲猪瘟核酸检测试剂盒对20 copies/μL标准品的检测结果
2.3 假阳性检测试验结果
3 讨论
该研究比较了4个厂家生产的非洲猪瘟核酸诊断试剂盒对B646L基因标准品的检测结果,结果显示:线性扩增试验中,A试剂盒对20 copies/μL浓度的标准品检出率为100%(3/3),其他试剂盒对该浓度下的标准品的检出率均未达到100%;敏感性试验中,A试剂盒对稀释至 20 copies/μL的48个重复,检出率为91.67%(44/48),其他试剂盒的检出率分别为85.42%(41/48)、79.17%(38/48)、58.33%(28/48);假阳性试验中,A试剂盒和B试剂盒,未出现阳性反应,C、D试剂盒分别出现2、1个非特异阳性反应。综合3个试验的结果,A试剂盒在不同稀释浓度下的检出率、低浓度(20 copies/μL)的检出率、假阳性出现频次上领先其他试剂盒,更符合猪场实验室对于高敏感性和低假阳性的需求,可以应用于猪场实验室非洲猪瘟病毒的核酸诊断。
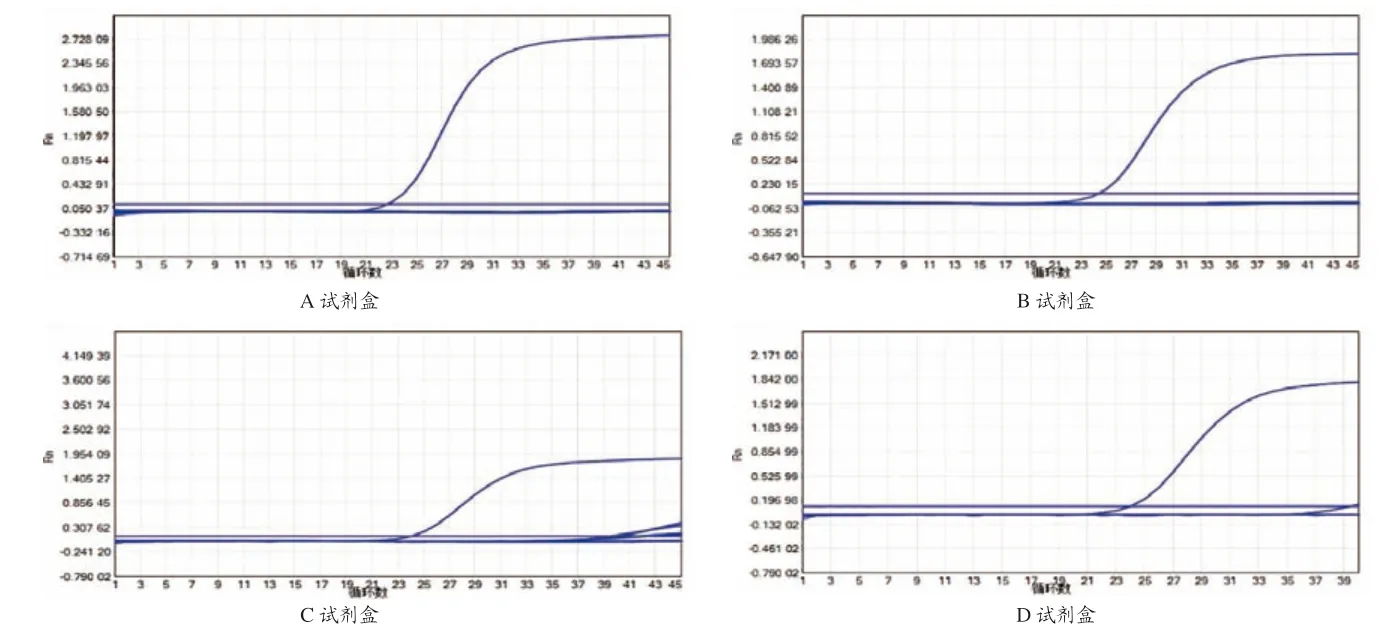
图2 4种试剂盒假阳性检测结果
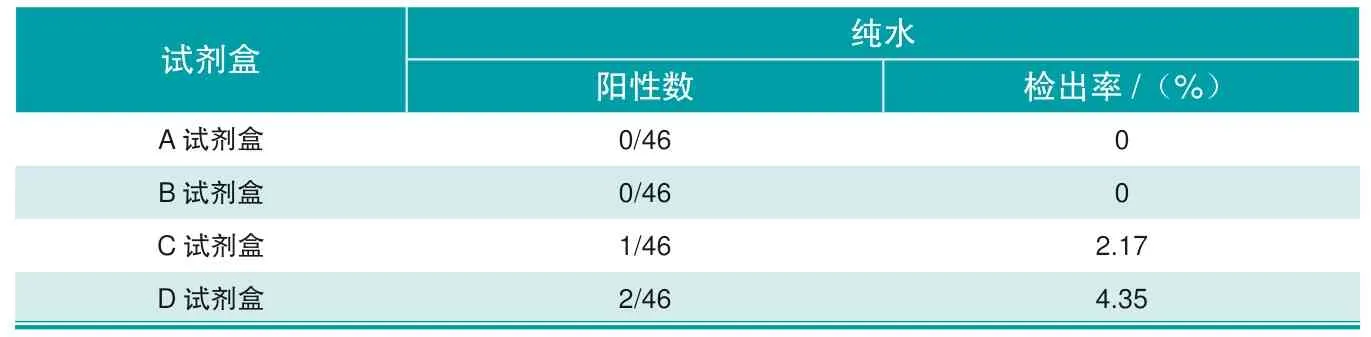
表4 4种非洲猪瘟核酸检测试剂盒对纯水的检测结果
非洲猪瘟病毒对腐败、温度、干燥及消毒剂都具有较强的抵抗力。在适宜的蛋白质环境下,非洲猪瘟病毒可在较大的温度范围和pH范围内存活,在血液、尿、粪中非常稳定,能长时间存活于经加工过的猪肉制品中[3]。由于ASFV在环境中稳定、存活时间长,生物安全是防控该病毒的唯一方案,进入猪场的物质和人员必须进行执行严格的生物安全洗消,并进行核酸检测。选择一款敏感性高、假阳性少的试剂盒,能大大提升猪场生物安全牢固程度。
试剂盒的敏感性较低,可能与引物和探针序列、试剂盒生产工艺相关。在临床检测过程中,检出率偏低除与试剂盒敏感性有关外,还可能与样本复杂程度、样本采集运输、样本核酸提取等各种因素相关;实验室出现假阳性,可能与试剂盒不稳定、实验室污染、设备的阈值线设定等方面相关,猪场实验室需要综合各方面的因素进行判断,该研究中C、D试剂盒为预混装,产生的假阳性可能与试剂预混后,发生非特异性反应有关。
该研究仅对4个厂家试剂某一批号的检测能力做了简要比较分析,样本量有限,并不能代表各试剂的整体检测性能,仅作为一种试剂盒比对方案,供猪场实验室参考,实验室检测能力除与试剂盒相关性能相关外,还需要实验室的操作人员严格遵循标准操作流程,执行严格的质量控制,避免因操作原因引起的假阴性和假阳性结果。
