直肠间质瘤MRI 表现及临床分析
2021-01-20周爱平
周爱平 王 春 于 骞
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是由具有多种分化潜能的肿瘤细胞异常增殖而形成的一种间叶源性肿瘤,可发生于消化道的任何部位,位于直肠者约占5%[1]。由于缺乏特异的临床症状和实验室检查指标,术前容易误诊为直肠癌、淋巴瘤等[2]。直肠间质瘤具有侵袭性较弱,很少沿肠壁浸润,不易发生淋巴结转移等生物学特性,对放化疗不敏感,手术方式及术后治疗方案均不同于直肠癌和淋巴瘤,术前误诊易给患者带来不必要的损伤,降低患者的生活质量。因此,术前明确诊断具有重要的临床意义。笔者收集经病理学证实9 例直肠间质瘤患者的MRI 及临床资料进行回顾性分析,并复习有关文献,报道如下。
1 资料和方法
1.1 一般资料 收集自2013 年6 月—2019 年9 月间经浙江新安国际医院(3 例)、温州医科大学附属慈溪医院(6 例)诊治的9 例直肠间质瘤进行回顾性分析。9 例患者资料完整,其中男6 例,女3 例,年龄37~74 岁,中位年龄61 岁。1 例无明显临床症状,其余8 例均出现程度不等的下腹部胀痛不适,其中伴有肛门坠胀感5 例,便血2 例,排便困难并大便变细1例。实验室检查大便潜血阳性并伴有轻度贫血3 例,其余化验检查包括肝、肾功能、电解质、血糖均未见异常;肿瘤指标CEA 轻度增高(6.5~7.4μg/L)2 例,其他肿瘤指标包括AFP、CA199、CA125 均在正常范围。
1.2 MRI 检查 9 例均行盆腔MR 平扫及增强扫描,其中3 例补充上腹部MRI 平扫及增强扫描。仪器均采用SIEMENS AVANTO 1.5T 超导型磁共振机,体部相控阵线圈,扫描范围自两肾下缘至耻骨联合下缘。平扫T1WI 行横断面(TR 112~180ms,TE 2.46~4.76ms)扫描,T2WI 行横断面、矢状面及冠状面(TR 4000~6000ms,TE 70~120ms) 扫描,并均行T1WI、T2WI 脂肪抑制扫描。扫描层厚5mm,间隔1mm,视野350~380mm,矩阵270×360。DWI 采用ASSET 校正,SE-EPI 采集,TR 3900ms,TE 85ms,层厚4mm,FOV 320×272mm,矩阵320×233,采集次数4。增强扫描采用快速扰相梯度回波(FSPGR)脂肪抑制T1WI 扫描,对比剂为Gd-DTPA(0.1mmol/kg)。由肘静脉高压注射器团注,速率为3mL/s,总量15mL,分别延迟15s、55s 行动脉期、静脉期横断面扫描,120s 矢状面延迟扫描。
1.3 图像分析 两名高年资MRI 副主任医师共同对图像进行回顾性分析。观察内容:(1)肿瘤的部位、形态、边界、大小;(2)MRI 平扫与增强特点,平扫与相邻盆壁肌肉比较分为低、等和高信号3 级;增强强化程度与肌肉相近者称轻度强化,高于肌肉而低于血管者称中度强化,强化程度与血管强化相近或高于血管者称为明显强化[3];(3)继发改变,如邻近肠管及其他邻近组织器官的变化,有无腹水、腹腔及腹膜后淋巴结转移及肝脏转移等。
2 结果
2.1 MRI 表现 9 例肿瘤均表现为单发肿块。以肛提肌起点与身体正中线垂直连线为第一分界平面,肛管直肠环平面为第二分界平面,将直肠分为上中下3 段:上段为第一分界平面以上,中段为第一分界平面以下第二分界平面以上,下段为第二分界平面以下。本组1 例位于直肠上段,5 例位于直肠中段及下段(见图1)、3 例位于下段(见图2-3)。5 例类圆形、2 例分叶状、2 例哑铃状,最大直径2.7~11.3(6.3±1.6)cm。7 例呈肠腔外生长,2 例腔内、外生长,界限均清楚。
MRI 平扫:9 例肿块信号不均匀,T1WI 以等信号为主(见图2A),T2WI 上1 例高信号、8 例稍高信号(见图1A),内部均见范围不等的T1WI 低、T2WI 高信号区(见图1A)。DWI 上9 例呈明显高信号(见图2B),其中8 例ADC 值明显降低(见图2C)。
MRI 增强:动脉期9 例肿块均中度强化(见图2D,图3),静脉期中度及以上强化(见图1B,2E),延迟期持续强化。8 例周边见完整或不完整的延迟强化假包膜,以静脉期显示清楚(见图1B,图2E);1 例界限不清,未见明显假包膜样结构。9 例内部均见范围不等无强化液化坏死区,5 例直肠缘见滋养血管延续于肿瘤(见图1B,图2D)。
7 例肠腔外生长肿块对邻近直肠壁呈不同程度的压迫(见图1-2),1 例见相应肠腔狭窄。2 例肠腔内外生长者,肠腔内肿块表面可见肠黏膜隆起且尚连续(见图3);9 例均未见淋巴结转移及腹、盆腔积液,3 例发现直肠原发灶后行B 超及上腹部MRI 增强检查发现肝脏单发转移灶。
2.2 手术、病理及随访 9 例均经手术根治性切除肿瘤。其中5 例行经骶直肠肿瘤切除术(Kraske 术),2 例行经肛门直肠肿瘤切除术,1 例经腹会阴联合直肠肿瘤切除术(Miles 术);1 例直肠前切除术(Dixon术)。2 例术前肿瘤体积较大细针穿刺病理证实为直肠间质瘤,而行伊马替尼辅助治疗,每天400mg,持续6~9 个月,肿瘤明显缩小后手术切除;3 例伴有肝脏单发转移者,并行肝转移灶切除术。根据术后病理学镜下及免疫组化指标表现,9 例最终病理学均诊断为直肠间质瘤,根据2008 年美国国立研究院(NIH)修订的GIST 危险度分级标准[4],低度危险性1 例,中度危险性3 例,高度危险性5 例。
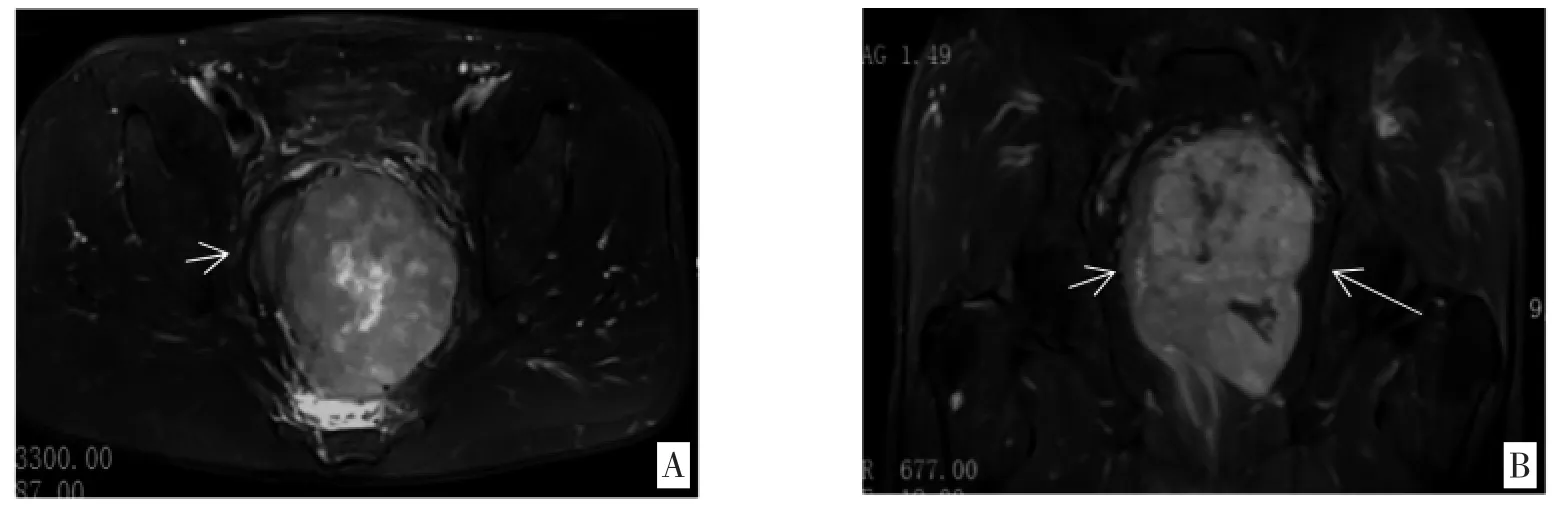
图1 病例1 直肠中下段间质瘤(高度危险性)
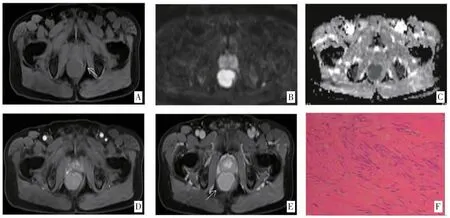
图2 病例2 直肠下段间质瘤(中度危险性)(HE ×100)
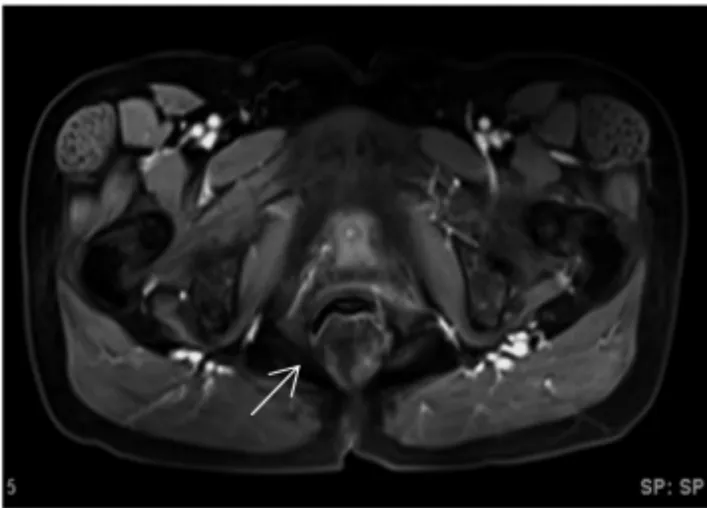
图3 病例3 直肠下段间质瘤(轻度危险性)
术后9 例均未接受放射治疗,3 例中度危险性及5 例高度危险性患者行伊马替尼辅助治疗,服药时间4~53 个月,剂量每天400mg。9 例术后随访时间为6~71 个月,随访期间3 例肝脏转移者,分别于术后39个月、33 个月、47 个月死亡,死亡原因均为肿瘤广泛转移衰竭死亡;其余6 例经CT 检查均未复发,至发稿前存活。
3 讨论
3.1 临床与病理学特征 直肠间质瘤临床罕见,约占直肠恶性肿瘤的0.6%[5]。该病多见于中老年人,以直肠中下段居多,发病机制与c-kit 及血小板源性生长因子受体α(platelet derived growth factor receptor-alpha,PDGFRA)的活化突变有关[6]。由于倾向于肠壁外生长以及盆腔结构相对疏松,肿瘤较小者症状不明显,体积较大者多以下腹部胀痛不适、排便困难等为首诊的常见症状,部分患者肛诊时可触及直肠壁外生性肿物[7]。本组8 例位于直肠中下段,仅2例伴发便血,不同于直肠癌。病理组织学上,肿瘤组织富于梭形细胞和上皮样细胞,偶见多形性肿瘤细胞,体积较大时易发生坏死、囊变或出血,CD117、DOG-1 强阳性是其免疫组化特征表现[8]。GIST 均具有恶性倾向,在同等肿瘤大小或核分裂像的情况下,直肠间质瘤的恶性危险度高于胃[9]。本组3 例中度危险性、5 例高度危险性。
3.2 MRI 诊断 直肠间质瘤多表现为肠壁外生性肿块,形态较规则、肠梗阻不明显。MRI 有利于显示肿瘤的一些病理学特征,平扫T2WI 呈高或稍高信号,DWI 高信号,ADC 值越小,越倾向于高度危险性[10-11]。本组8 例中、高危肿瘤T2WI 呈稍高信号、ADC 值降低明显。结合术后病理分析,肿瘤恶性程度较高,肿瘤细胞异型性明显、细胞排列紧密是T2WI 稍高信号的病理学基础,同时也是导致细胞内外水分子活动受限加重,DWI 明显高信号、ADC 值降低的主要原因。
间质瘤血供一般较丰富[12],肿瘤较大时内部易发生坏死、囊变,假包膜多见[13]。本组9 例即是如此,动态增强扫描持续中度以上明显强化,呈“快进慢出”的强化模式,符合梭形细胞排列紧密导致造影剂排空延缓的特性。低级别神经内分泌肿瘤亦表现为黏膜下富血供肿物,但其体积多较小,内部坏死、囊变少见,此外结合临床及实验室检查有助于二者鉴别。本组8 例肿块边缘见假包膜,静脉期显示清楚。5 例肿块直肠缘滋养血管的显示对肿瘤的定位亦具有一定价值。
直肠间质瘤易发生种植转移和血行转移,但淋巴结转移较少见,可能与悬垂式生长而非浸润性生长有关[14]。本组9 例均未见淋巴结转移,其中3 例肝脏转移灶呈富血供占位伴强化假包膜,类似原发性肝癌,但其动脉期强化程度高于同层静脉,此外强化假包膜相对较厚,均有别于原发性肝癌。
直肠间质瘤主要应与直肠癌鉴别。直肠癌表现为直肠壁不规则增厚,黏膜面突向腔内生长呈软组织肿块,或沿管壁浸润生长导致肠腔狭窄甚至肠梗阻;MR 平扫T1WI 等或稍低信号,T2WI 高、低混杂信号;增强扫描往往早期较明显强化,但静脉及延迟期强化相对减弱,假包膜少见;此外直肠癌容易发生邻近及远处淋巴结转移[2]。结合临床大便带血,肿瘤指标CEA 增高,部分病例直肠指诊可触及直肠病灶。
3.3 治疗和预后 GIST 对放、化疗不敏感,手术切除是治疗直肠间质瘤的最佳方法,手术原则遵循完全切除,保持包膜的完整性,避免破裂。根据肿瘤具体情况选择局部切除、直肠前切除和腹会阴联合切除等手术方式,由于淋巴结转移罕见而无需淋巴结清扫[15]。对于肿瘤巨大、术中易出血、肿瘤距离肛缘较近者,可以考虑伊马替尼术前辅助治疗,不仅能使肿瘤降期效果明显,提高保肛率,降低切缘阳性率,而且能够改善患者的预后[13]。本组2 例肿块直径>5cm,术前细针穿刺活检证实为恶性间质瘤,应用伊马替尼每天400mg 治疗6~9 个月,期间经两次影像学检查显示肿瘤缩小至不再退缩后,予以手术顺利切除。此外肿瘤的恶性危险度决定是否需进行术后辅助治疗,低危无需术后辅助,中高危建议至少接受3 年辅助治疗[16]。总之,直肠间质瘤一旦确诊,应积极治疗。
