乳双歧杆菌Probio-M8氧气耐受性驯化研究
2021-01-15王元弛姚国强张文羿张和平
王元弛,姚国强,张文羿,张和平
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室农业部奶制品加工重点实验室 呼和浩特010018)
1899年,Tissier[1]首次在婴儿粪便中分离到双歧杆菌。双歧杆菌对人体保持健康具有重要作用,大量动物和临床试验研究表明双歧杆菌具有促进营养物质代谢及吸收,增强宿主免疫能力,改善神经焦虑的作用[2-7]。其既可作膳食补充剂,又可作保健食品的功能成分[8-10]。然而,双歧杆菌氧气耐受性差,菌体活力会受到较大影响,不利于益生特性发挥,阻碍了其生产及应用。本试验中采用改变培养基中氧分压的方法对乳双歧杆菌Probio-M8 进行氧气耐受性驯化。通过测定生理特性、氧气耐受性相关NADH 氧化酶活性及细胞膜流动性变化,评价氧气对乳双歧杆菌Probio-M8 的影响。供试菌株乳双歧杆菌Probio-M8 (Bifidobacterium animalis subsp.lactis Probio-M8,B.lactis Probio-M8)分离自内蒙古自治区呼和浩特市健康妇女母乳。本试验对乳双歧杆菌Probio-M8 氧气耐受性能力进行研究,为其应用及开发提供思路。
1 材料与方法
1.1 试验材料
供试菌株乳双歧杆菌Probio-M8 由内蒙古农业大学乳品生物技术与工程教育部重点实验室菌种资源库提供。
1.1.1 主要试剂 MRS 培养基,英国Oxoid 公司;MRSC 培养基:MRS 培养基添加0.5 g/L 的L-半胱氨酸盐酸盐;TPY 培养基,英国Oxoid 公司;脱脂乳培养基[11]:脱脂乳9.5 g,酵母提取物0.5 g,葡萄糖2 g,L-半胱氨酸0.05 g,双蒸水100 mL;NADH氧化酶活性检测试剂盒,北京索莱宝科技有限公司。
1.1.2 主要仪器与设备 ZHJH-C1112C 无菌工作台,上海智城分析仪器有限公司;SX-500 全自动高压灭菌锅,日本Tomy Digital Biology;LRH-500F 恒温培养箱,上海一恒科技有限公司;TGL-16B 台式高速离心机,德国Eppendorf 公司;DG250 厌氧工作站,英国DWS 公司;GRX-9203A全自动干热灭菌器,上海一恒科学仪器有限公司;EF20 pH 计,瑞士梅特勒-托利多公司;Synergy H1 酶标仪,美国BioTek 公司;Research plus 移液器,德国Eppendorf 公司;BX50 光学显微镜,日本OLYMPUS。
1.2 试验方法
1.2.1 乳双歧杆菌Probio-M8 的制备和保藏 将保存于冻存管中的乳双歧杆菌Probio-M8 液体于TPY 固体培养基上划线;37 ℃恒温厌氧培养48 h,随机选取6~8 个单菌落接入10 mL 的TPY 液体培养基试管中;37 ℃恒温厌氧培养24 h,镜检后,挑选1 个符合乳双歧杆菌Probio-M8 典型菌体形态的试管,按体积分数2%接入350 mL 的TPY 液体培养基中;37 ℃恒温厌氧培养24 h,离心得到菌泥,与脱脂乳培养基混合均匀,吸取500 μL 保存于冻存管中,于-80 ℃冰箱保存。
1.2.2 生长代数的计算 将活化后的初始菌株在MRSC 固体培养基平板上进行多次划线纯化后,挑取单菌落于MRSC 液体培养基,置于37 ℃生化培养箱中进行培养,30 h 后按2%的接种量进行液体传代培养1 次,每隔2 h 取样测定菌株生长过程中活菌数变化情况,绘制生长曲线。可得到乳双歧杆菌Probio-M8 到达稳定期的时间,并且以该时间作为下一次接种新鲜培养基的时间,以保证菌株稳定传代。将菌株以2%接种量接入新鲜MRSC 液体培养基的活菌数记为N0,进入稳定期时的活菌数记为Nf,通过公式log2(Nf/N0)计算1个生长周期内的生长代数[12]。
1.2.3 氧气耐受性驯化 通过控制液体培养基中L-半胱氨酸盐酸盐添加,以改变培养基中氧分压的方法进行氧气耐受性驯化试验[13]。首先,挑取纯化培养后的单菌落接种到MRSC 液体培养基于厌氧工作站37 ℃下进行培养,采用2%的接种量,连续传代驯化培养25 d,每隔10 d 冻菌留样。再于MRS 液体培养基中连续驯化培养125 d,每隔10 d 冻菌留样。不同驯化代数样品均于MRS 液体培养基中活化后进行指标测定。
1.2.4 形态学观察 将原始菌株乳双歧杆菌Probio-M8 与氧气耐受性驯化后1 000 代菌株进行革兰氏染色,显微镜观察并照相记录,对传代菌株细胞形态进行观察[14]。将传代菌株于MRS 固体培养基上划线培养,对菌落大小、形态和颜色进行观察。
1.2.5 生长情况测定 利用酶标仪测定每传约70 代驯化菌株处于 (24.00±0.500)h 时培养液的菌体密度(OD600nm)。
1.2.6 产酸能力测定 利用pH 计测定每传约70代驯化菌株处于(24.00±0.500)h 时培养液的pH值。
1.2.7 氧气耐受性测定 每传代约70 代,将氧气耐受性驯化条件下培养的菌株分别置于有氧及厌氧环境中37 ℃培养,在(0.00±0.500)h 和(24.00±0.500)h 分别取样测定其菌体密度,计算RBGR值[15](有氧环境下菌体密度/厌氧环境下菌体密度),以评价其氧气耐受性。
1.2.8 NADH 氧化酶活性测定 按照试剂盒说明书,每200 代菌株进行NADH 氧化酶活性测定。
1.2.9 细胞膜流动性测定 依据李宝坤[16]的方法进行脂肪酸含量测定,对比乳双歧杆菌Probio-M8原始菌株与驯化后菌株细胞膜的脂肪酸含量。
1.3 数据分析
采用SPSS 18.0 进行单因素方差分析;折线图、散点图等使用GraphPad Prism 5.01,Oringin 7.5 绘制。
2 结果与分析
2.1 乳双歧杆菌Probio-M8 生长代数计算结果
细菌处于不同生长时期,细胞生理状态具有较大的差异,对应激环境的反应也不相同。由图1看出,乳双歧杆菌Probio-M8 在0~4 h 为延滞期,最初接入活菌数约为1.26×107CFU/mL;4~16 h 活菌数迅速增加,为对数生长期;16 h 后活菌数趋于稳定,进入稳定期,活菌数为1.58×109CFU/mL。参照1.2.2 节生长代数的计算方法,到达稳定期时菌株的生长代数约6.97 代。陶天申等[17]研究发现菌株在对数生长期后期或者稳定期早期是进行菌种传代和保藏的最佳时期。因此,本研究为了方便试验的长期操作,选择(24.00±0.500)h 为一个驯化传代周期。

图1 乳双歧杆菌Probio-M8 原始菌株生长曲线Fig.1 Grow curve of B.lactis Probio-M8 original strain
2.2 乳双歧杆菌Probio-M8 驯化前、后形态变化
将乳双歧杆菌Probio-M8 原始菌株及氧气耐受性驯化后1 000 代菌株活化培养后进行平板划线,观察菌落形态特征,挑取单菌落进行革兰氏染色并在显微镜下观察菌体形态,对比结果如表1,图2,图3。发现乳双歧杆菌Probio-M8 驯化前、后的菌落及菌体形态均属于双歧杆菌典型形态[18]:氧气耐受性驯化后菌株与原始菌株相比,菌落形态较小、菌体变细。

表1 原始及氧气耐受性驯化后乳双歧杆菌Probio-M8 形态特征[18]Table 1 Morphological characteristic of oxygen-tolerance B.lactis Probio-M8 and original strain[18]
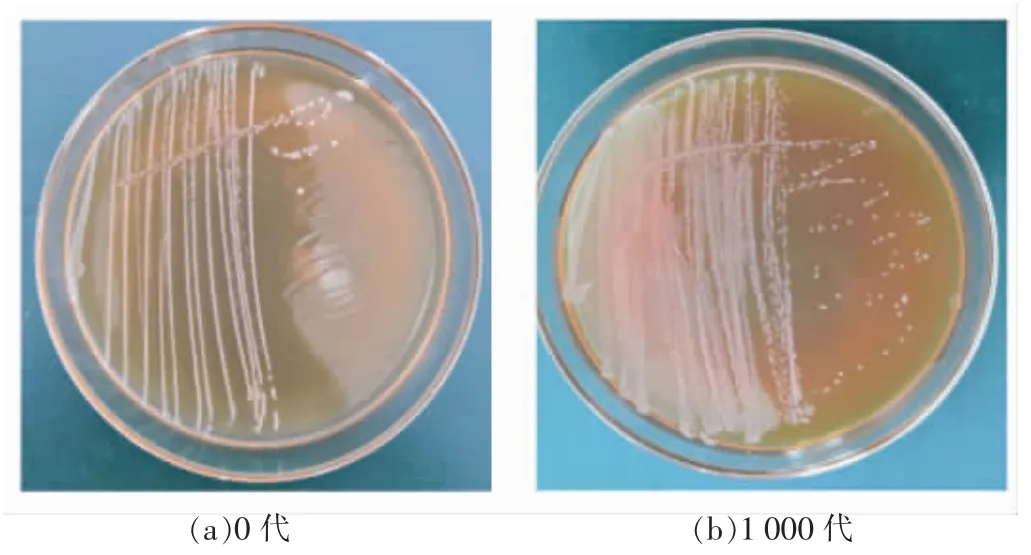
图2 原始及氧气耐受性驯化后乳双歧杆菌Probio-M8 菌落形态Fig.2 Colony morphology of oxygen-tolerance B.lactis Probio-M8 and original strain
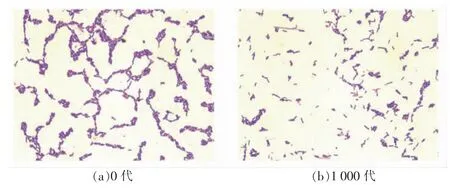
图3 原始及氧气耐受性驯化后乳双歧杆菌Probio-M8 菌体形态(×1 000)Fig.3 Morphology of oxygen-tolerance B.lactis Probio-M8 and original strain
2.3 乳双歧杆菌Probio-M8 驯化过程生长情况变化
测定不同代数乳双歧杆菌Probio-M8 在有氧及厌氧环境中菌体密度(OD600nm)变化,可反映出其在氧气耐受性驯化过程中生长情况。由图4可看出,0~270 代之间菌体密度无显著变化;驯化至340 代时,较0 代菌株相比在有氧环境下菌体密度增加4.64 倍,厌氧环境下增加3.86 倍(P<0.05);400~1 000 代时,菌体密度无显著差异;至1 000 代时,有氧环境下菌体密度为1.11±0.047,厌氧环境下为1.08±0.047,较0 代菌株相比均有显著增加,分别增加10.47 倍及7.77 倍(P<0.05)。王猛等[19]对乳双歧杆菌BZ11 氧气耐受性驯化后,发现驯化后菌株在有氧环境下菌体密度显著增加,能更好地适应有氧环境。经氧气耐受性驯化后乳双歧杆菌Probio-M8 的菌体密度显著上升,生长情况较好。
2.4 乳双歧杆菌Probio-M8 驯化过程产酸能力变化
测定不同代数的乳双歧杆菌Probio-M8 在有氧及厌氧环境中pH 值变化,可直观反映出其在氧气耐受性驯化过程中产酸能力情况。如图5所示,0~270 代之间pH 值无显著变化;驯化至470代时,较0 代菌株相比有氧条件下pH 值显著降低0.15,厌氧环境下显著降低0.14(P<0.05);470~1 000 代之间,pH 值无显著差异;至1 000 代时,有氧环境下为4.38±0.023,厌氧环境下为4.36±0.000,较0 代菌株相比pH 值均显著降低(P<0.05)。有研究表明,双歧杆菌氧气耐受性驯化后,菌株在有氧环境生长pH 值显著降低[19-20]。乳双歧杆菌Probio-M8 在有氧及厌氧环境中的pH 值随氧气耐受性驯化时间延长而呈现递减趋势,产酸能力明显增强。

图4 氧气耐受性驯化过程中乳双歧杆菌Probio-M8 的OD600nm 变化Fig.4 OD600nm of B.lactis Probio-M8 during the oxygen-tolerant domestication in the different conditions

图5 氧气耐受性驯化过程中乳双歧杆菌Probio-M8 的pH 值变化Fig.5 pH change of B.lactis Probio-M8 during the oxygen-tolerant domestication in the different conditions
2.5 乳双歧杆菌Probio-M8 驯化过程氧气耐受性变化
1986年,Kikuchi 等[15]提出RBGR 值,一种通过测定有氧条件与厌氧环境下OD600nm变化比率以评价厌氧菌氧气耐受性的方法。由图6可以看出,0~270 代,RBGR 值缓慢增加,无显著变化;驯化至340 代时,较0 代菌株相比RBGR 值显著上升0.39(P<0.05);至400 代时,较370 代时RBGR 值显著上升0.11 (P<0.05);400~1 000 代时,RBGR值无显著变化;至1 000 代时,RBGR 值为1.03±0.063,较0 代菌株相比RBGR 值发生显著上升0.47(P<0.05)。Talwalkar 等[21]研究表明氧气耐受性好的菌株RBGR 值显著高于其它菌株。综合上述结果可推测,乳双歧杆菌Probio-M8 氧气耐受性驯化后1 000 代菌株较原始菌株氧气耐受性明显增强。
2.6 乳双歧杆菌Probio-M8 驯化过程NADH 氧化酶活性变化
双歧杆菌为严格厌氧细菌,菌株之间氧气敏感性存在差异。研究人员对氧气与双歧杆菌存活的关系进行了大量研究,发现活性氧化物(超氧化物、过氧化氢、羟自由基)的产生造成了双歧杆菌氧中毒,从而导致细胞死亡[22]。而需氧菌可以通过某些酶(超氧化物歧化酶、过氧化氢酶)分解活性氧化物,是防御氧中毒的主要成分[23]。根据已有研究,推测厌氧菌可能因为缺乏这2 种酶而造成氧中毒。然而一些研究发现,NADH 氧化酶活性可能决定了双歧杆菌对氧气的耐受能力[24]。乳双歧杆菌Probio-M8 在驯化过程中NADH 氧化酶活性的变化情况如图7所示,原始菌株NADH 氧化酶活性处于较低水平,为(53.03±7.57)U;驯化至800代时,NADH 氧化酶活性达到最高,较0 代菌株相比酶活性发生显著上升(P<0.05)。至1 000 代时,为(84.17±1.46)U,较800 代菌株相比酶活性略有下降,无显著性变化;而较0 代相比菌株酶活性显著升高(P<0.05)。Shimamura 等[24]研究了双歧杆菌氧敏感性背后的酶促机制,发现NADH 氧化酶水平与菌株氧气耐受性之间存在相关性,氧敏感菌株中NADH 氧化酶活性较低。Shin 等[25]研究证实氧气最敏感双歧杆菌菌株暴露在有氧环境中,NADH 氧化酶活性最低;氧气耐受性最强菌株NADH 氧化酶活性最高。综合上述结果可推测,由于乳双歧杆菌Probio-M8 氧气耐受性驯化后1 000 代中NADH 氧化酶活性显著上升,而导致其氧气耐受性增强。
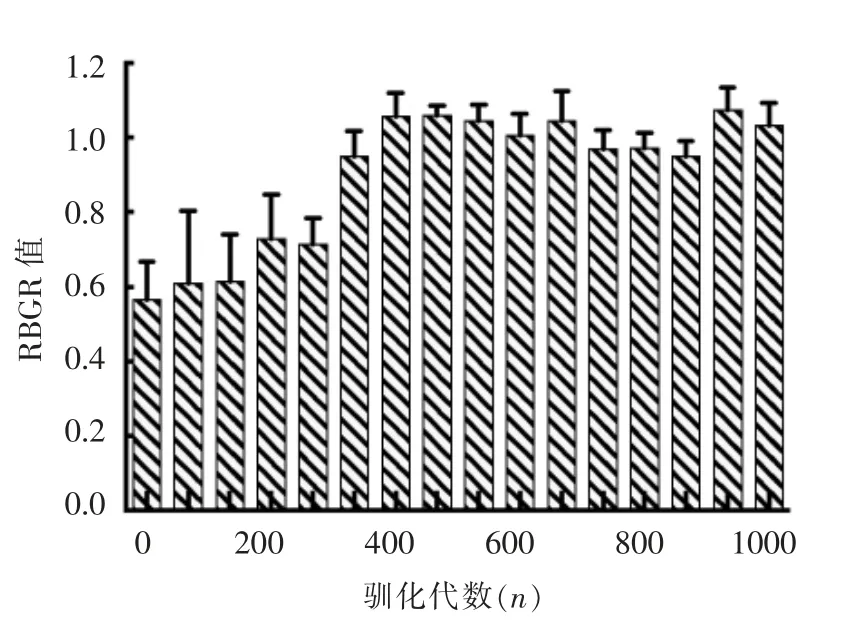
图6 氧气耐受性驯化过程中乳双歧杆菌Probio-M8 的RBGR 值变化Fig.6 RBGR of B.lactis Probio-M8 during the oxygen-tolerant domestication

图7 氧气耐受性驯化过程中乳双歧杆菌Probio-M8 的NADH 氧化酶活性变化Fig.7 NADH oxidase activity of B.lactis Probio-M8 during oxygen-tolerant domestication
2.7 乳双歧杆菌Probio-M8 驯化前、后细胞膜流动性变化
细胞膜脂肪酸成分是影响细胞氧气耐受性的重要指标[26-27]。外界环境发生变化,微生物细胞膜首先受到冲击,细胞对氧气的耐受性取决于脂肪酸组成,特别是不饱和程度。在下面的研究中,对氧气耐受性驯化前后乳双歧杆菌Probio-M8 细胞膜脂肪酸成分进行了比较分析,结果见表2,细胞膜脂肪酸成分分别是C12:0(月桂酸)、C14:0(肉豆蔻酸)、C16:0(棕榈酸)、C16:1(棕榈油酸)、C18:0(硬脂酸)、C18:1(油酸)、C18:2(亚油酸)、C19cyc11(环丙烷脂肪酸)。这8 种脂肪酸占总脂肪酸含量的85%以上,说明这8 种脂肪酸是乳双歧杆菌Probio-M8 主要脂肪酸。经过氧气耐受性驯化后1 000 代菌体中不饱和脂肪酸比例为50.39%,相比原始菌株菌体不饱和脂肪酸含量显著上升17.26%(P<0.05),其中C18:1及C18:2比例均显著上升(P<0.05)。而饱和脂肪酸含量为49.60%,相比原始菌株68.87%显著下降(P<0.05)。其中氧气耐受性驯化后1 000 代菌体 中C12:0,C14:0,C16:0,C18:0比例较原始菌株菌体有所下降,C18:0显著下降(P<0.05)。自然环境中,细菌面临诸多不利因素影响时,细胞会启动自身的临时适应性机制,对细胞进行自我调控,增强适应能力[28]。如增加膜脂质中不饱和脂肪酸的比例,维持细胞膜的流动性[16,29]。综合上述结果可推测,乳双歧杆菌Probio-M8 氧气耐受性驯化后1 000 代菌株不饱和脂肪酸含量显著上升是其氧气耐受性增强原因之一。

表2 原始及氧气耐受性驯化后乳双歧杆菌Probio-M8 膜脂肪酸相对含量Table 2 Membrane fatty acid composition of oxygentolerance B.lactis Probio-M8 and original strain
3 结论
本试验结果表明,与乳双歧杆菌Probio-M8原始菌株相比,氧气耐受性驯化后1 000 代菌株在有氧及厌氧环境下生长情况良好、产酸能力提升、氧气耐受性增强、细胞膜流动性提高。即通过改变培养基氧分压提高乳双歧杆菌的氧气耐受性具有一定应用潜力,为乳双歧杆菌Probio-M8 生产及应用提供了参考依据。
