OPO结构脂在模拟婴儿胃肠道消化环境中脂肪酸的释放特性
2021-01-15曲国强孙雪婷刘丽波
王 静,李 春,曲国强,孙雪婷,刘丽波
(东北农业大学乳品科学教育部重点实验室 哈尔滨150030)
OPO(1,3-二油酸2-棕榈酸甘油三酯)结构脂是通过酶法酯交换生成的一种母乳化结构脂[1-2]。母乳是婴儿生长过程中不可取代的食物[3]。然而,生活节奏的加快和个人身体状况的不同,一些母亲不能通过母乳而需借助婴儿配方奶粉喂养婴儿。婴幼儿配方奶粉需求量从2013年的82.6万t 增至2017年的110 万t,增长了33.17%。植物油作为传统婴儿配方粉中重要组成,提供婴儿生长的能量,然而传统配方奶粉中添加的油脂中棕榈酸主要分布在Sn-1,3 位上,被脂肪酶水解后生成的游离棕榈酸极易与钙离子形成不溶性的皂钙脂肪酸,不仅造成钙的损失,婴儿还会出现大便干燥甚至便秘的情况[4]。事实上,母乳脂肪的基本成分是甘油三酯,棕榈酸含量占17%~25%,其中高达70%的棕榈酸在Sn-2 位上,消化后只有Sn-2位上的棕榈酸易被肠道吸收而进入血液,进而促进婴儿能量代谢[5-6]。研制与母乳消化后结构特性相似的结构油脂,成为目前的研究热点和难点。越来越多的研究表明,添加母乳化OPO 结构脂的婴幼儿配方奶粉,能有效降低皂钙脂肪酸的形成,有利于婴儿对脂肪酸和钙的吸收,从而改善婴儿大便困难、腹痛等问题[7-8]。
近年来,随着OPO 结构脂制备工艺的成熟,市面上已出现很多相关产品。早在2008年,我国原卫生部公告批准了营养强化剂OPO 结构脂可运用于婴幼儿配方食品的文件 (2008年第13号)。直到2018年6月19日,国家认监委发布《有机产品认证增补目录(六)》公告,将OPO 结构脂收录到有机产品认证目录中。由于我国结构脂的研究起步晚,产品几乎被国外企业垄断,导致婴儿奶粉企业OPO 结构脂添加成本高居不下,造成巨大生产压力。研制出具有自主知识产权的结构脂,是提高婴幼儿配方奶粉品质的关键技术。
OPO 结构脂的营养价值虽已被证实,但对于OPO 结构脂在体外的脂肪酸释放特性却鲜有研究,其消化机理成为近几年的研究热点。有研究表明,液滴粒径越小(比表面积越大)越有利于油脂的消化分解[9]。根据母乳脂肪酸组成特点[10],本试验自制OPO 结构脂,构建婴儿体外消化模型。以混合植物油作对比,制备粒径更小的乳液。根据消化前、后脂肪酸组成成分的变化、消化曲线的分析以及消化过程中平均粒径和zeta 电位的变化来研究油脂在体外消化的情况[11],为进一步研究婴幼儿配方奶粉中脂肪的消化吸收提供理论依据。
1 材料与方法
1.1 原料与试剂
OPO 结构脂,实验室自制;高油酸葵花籽油、玉米油、菜籽油、椰子油,均为市售;胃蛋白酶(比活力1∶3 000)、胃脂肪酶(50 U/mg)、猪胰酶(100~350 U/mg)、牛胆盐、37 种脂肪酸甲酯混标(色谱级),Sigma 公司;柠檬酸脂肪酸甘油酯,河北润步生物科技有限公司;氯化钠、氢氧化钠、磷酸二氢钾、正己烷、甲醇、氯仿,天津市天力化学试剂有限公司;所有试剂均为分析纯级。
1.2 仪器与设备
气相色谱质谱联用仪GC7890/MS5975C,安捷伦(美国)有限公司;Zetasizer nano ZS 粒度分析仪及ZETA 电位仪,马尔文公司;高剪切乳化机,美国欧姆尼公司;SPCH-10 高压均质机,英国Stansted Fluid Power 公司;pH 计,梅特勒-托利多仪器有限公司;自动电位滴定仪,上海雷磁分析仪器厂;水浴恒温磁力搅拌器,金坛市富瑞实验仪器厂。
1.3 方法
1.3.1 油脂乳液的制备 OPO 结构脂(O 组)和混合植物油(Z 组)制备方法如下:
1)OPO 结构脂的制备 以PPP(三棕榈酸甘油三酯)和酰基供体(椰子油、玉米油、菜籽油、高油酸葵花籽油)按物质的量比1∶4 混合,通过酶法酯交换,制成OPO 结构脂(即O 组);
2)根据所用植物油中脂肪酸组成情况[12],将椰子油、玉米油、菜籽油、高油酸葵花籽油按27∶26∶27∶20 比例混匀,制成混合植物油(即Z 组)。
3)油脂乳液的制备 将柠檬酸脂肪酸甘油酯以0.2%的体积分数溶解于超纯水,用磁力搅拌器加热搅拌至完全溶解,将体积分数为95%完全溶解水化的溶液分别与体积分数5%的O 组油脂和Z 组油脂混合搅拌,高速剪切乳化5 min(12 000 r/min),然后30 MPa 均质3 次,得白色乳状液体即油脂乳液[13-14],油脂乳液需现配现用。
1.3.2 婴儿体外消化模型的建立 本试验所采用的婴儿体外消化模型,参考Minekus 等[15]和Tagliazucchi 等[16]的研究方法并根据实际情况做调整。
模拟婴儿胃液(SGF)的配制:准确称取0.20 g NaCl 溶于70 mL 超纯水中,用1 mol/L HCl 溶液调节溶液至pH 值为5.0,加水定容至100 mL,再加入0.45 g 胃蛋白酶(比活力1∶3 000)和0.032 g脂肪酶(50 U/mg),在恒温37 ℃下以10 r/min 磁力搅拌10 min,将溶液混匀,即为模拟婴儿胃液。
模拟婴儿肠液(SIF)的配制:准确称取0.68 g K2HPO3溶于超纯水中,用1 mol/L HCl 溶液调节溶液至pH 值为6.8,加水定容至100 mL,再加入0.12 g 的胆盐和0.10 g 胰酶,恒温37 ℃下以10 r/min 磁力搅拌10 min,使溶液混匀,即为模拟婴儿肠液。
1.3.3 油脂的体外消化 参照Devle 等[17]的方法并做适当修改,取10 mL 油脂乳液在37 ℃恒温水浴锅中温浴10 min,加入5 mL 模拟胃液,搅拌均匀,于37 ℃,95 r/min 下恒温水浴搅拌消化30 min,期间用0.10 mol/L NaOH 溶液滴定,中和水解释放出的脂肪酸,记录不同时间滴加的NaOH溶液的体积。调节模拟胃液中消化后的溶液pH值至6.8,加入10 mL 模拟肠液,在37 ℃,95 r/min 下恒温水浴搅拌2 h 模拟小肠消化,期间用0.10 mol/L NaOH 溶液滴定,中和水解释放出的脂肪酸,记录不同时间NaOH 溶液消耗的体积。每个样品各做3 次重复。
1.3.4 油脂体外消化过程中脂肪酸释放率的测定测定油脂乳液在消化过程中脂肪酸的释放率可以反映出其消化率和消化程度,脂肪酸的释放率根据消化过程中消耗的NaOH 溶液体积来计算,计算公式如下[18]:

式中:C0——NaOH 溶液的浓度 (0.1 mol/L);VC——消耗NaOH 溶液的总体积(mL);m——油脂乳液中加入样品的质量(g);M——样品的平均分子质量(g/moL)。
1.3.5 油脂平均粒径和粒径分布的测定 采用静态光散射技术,利用Nano-ZS90 粒度分析仪测定油脂乳液粒径。将油脂乳液稀释10 倍,混合均匀后取1 mL 进行测定。测定温度为25 ℃,分散剂为水,折射率为1.056。每个样品平行测定3 次[19]。
1.3.6 油脂zeta 电位的测定 将乳液样品稀释10 倍后采用Nano-ZS 电位测定仪测定2 组油脂乳液的zeta 电位。上样量为1 mL,测定温度为25℃,每个样品平行测定3 次[20]。
1.3.7 消化后乳液的脂肪酸分析
1.3.7.1 脂肪酸的甲酯化[21]
1)取样品100 mg 于圆底烧瓶中,加入8 mL 2%氢氧化钠甲醇溶液,连接回流冷凝器,80 ℃水浴回流20 min。
2)从冷凝器上端加入7 mL 0.50 mol/L 硫酸甲醇溶液,继续于80 ℃水浴回流15 min,停止加热,取下烧瓶,冷水浴使其快速冷却至室温。
3)准确量取20 mL 正己烷加入圆底烧瓶中,振荡2 min,再加入饱和NaCl 水溶液,静置分层,吸取约10 mL 上层有机相于试管中。
4)往试管中加入3 g 无水硫酸钠,吸收残留水分,振荡均匀,静置10 min,吸取上层溶液,经0.22 μm 滤膜过滤至进样瓶中用于气相分析。
1.3.7.2 气相色谱检测条件 使用安捷伦GC7890/MS5975C 对样品进行定性和定量分析。仪器的工作条件为:色谱柱:毛细管柱hp-5ms(30 m×0.25 mm,0.25 μm);进样口温度:280 ℃;升温程序:70 ℃保持5 min,以5 ℃/min 升至200 ℃,保持5 min,再以20 ℃/min 升至280,保持25 min;进样量:1 μL;不分流模式,流量50 mL/min;载气:氦气,流速1.0 mL/min。质谱条件:离子源为EI;质谱扫描范围为m/z 50~500;电子能70 eV;离子源温度230 ℃;溶剂延迟时间4 min,四级杆温度150℃。
1.3.7.3 油脂的Sn-2 位脂肪酸测定 测定油脂的Sn-2 位脂肪酸分布首先需要对其进行酶解,根据胰脂酶具有专一水解Sn-1,3 位上的脂肪酸的性质,用猪胰酶对样品进行水解,之后采用薄层色谱法对Sn-2 位脂肪酸进行分离纯化,再使用气相色谱法测定Sn-2 位脂肪酸的组成[22],色谱条件同1.3.7.2 节。
1.4 数据统计分析
2 结果与讨论
2.1 油脂的脂肪酸组成分析及Sn-2 位脂肪酸分布
资料研究表明:脂肪的消化率与它的饱和度有关,一般而言,饱和度与消化率成反比,即饱和度越低消化率越高[23]。本试验制备的O 组和Z 组油脂中脂肪酸组成如表1所示。由表可知,在2 组油脂中,占比例较大的游离脂肪酸主要是棕榈酸、油酸、亚油酸,O 组棕榈酸占(21.73±0.75)%、油酸占(37.71±0.45)%、亚油酸占(22.43±1.01)%;Z 组棕榈酸占(26.43±0.61)%、油酸占(31.48±1.08)%、亚油酸占(23.62±0.31)%,与蒋与燕[10]描述的母乳脂肪中各脂肪酸种类大致相同。不同的是,O 组棕榈酸含量与母乳更相近,Z 组棕榈酸含量较高,对比表2可知,O 组可被婴儿吸收的棕榈酸比Z 组高10%,O 组不饱和脂肪酸含量为60.14%,高于Z组不饱和脂肪酸含量(55.1%);因此可推断在模拟胃肠道消化时,O 组比Z 组表现出更高的消化率。
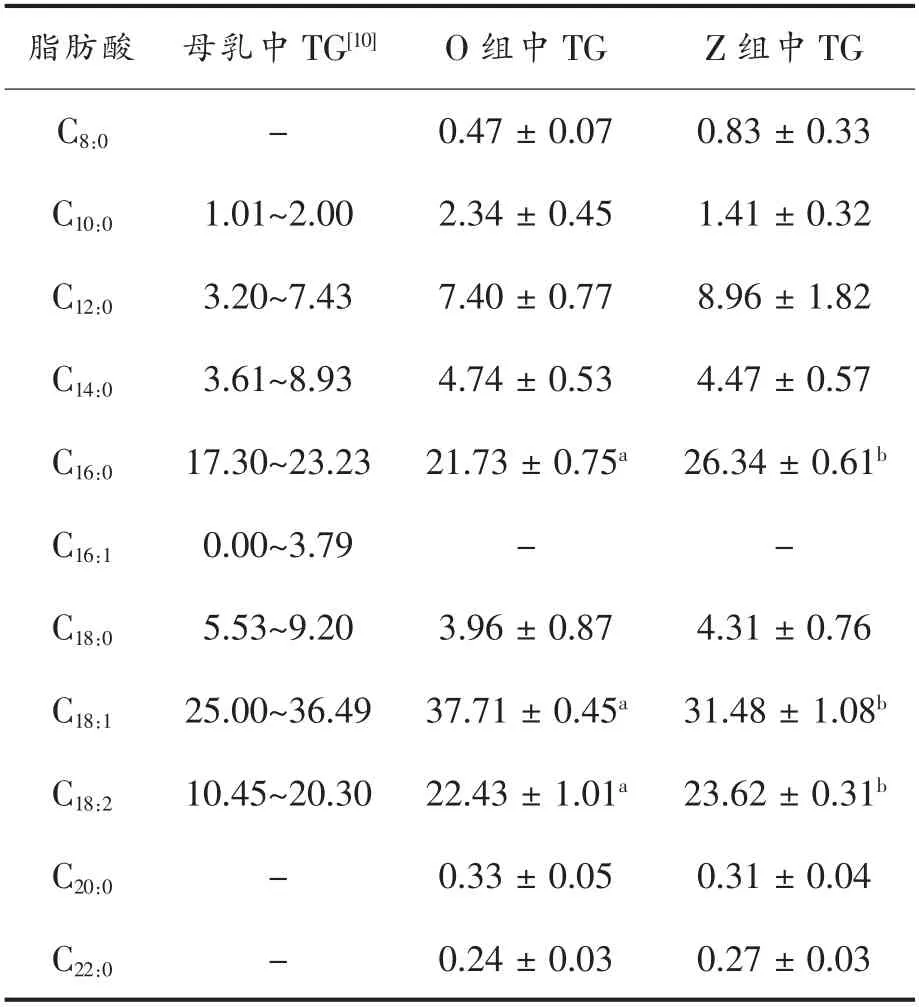
表1 母乳及2 种油脂乳液的脂肪酸组成(%)Table 1 Fatty acid composition of breast milk and two oil emulsions (%)
表2中描述了Sn-2 位脂肪酸分布及含量情况,由表可知,O 组Sn-2 棕榈酸含量为(39.93±1.21)%,与母乳更接近,Z 组Sn-2 位棕榈酸含量仅为(19.84±1.02)%,O 组与Z 组具有显著性差异(P<0.05)。对比2 种油脂乳液和母乳中Sn-2 位脂肪酸分布,发现Sn-2 位脂肪酸分布差别较大,母乳中Sn-2 位脂肪酸主要为棕榈酸,而O 组油脂中Sn-2 位脂肪酸为棕榈酸、油酸和亚油酸且含量较高,Z 组油脂Sn-2 位脂肪酸主要为油酸、亚油酸。

表2 母乳及2 种油脂中Sn-2 位脂肪酸分布(%)Table 2 Distribution of Sn-2 fatty acids in breast milk and two oil (%)
2.2 油脂平均粒径分布
不同结构的物质在形成乳化液之后形成的体系颗粒大小不同,不同的乳化状态则影响了体外消化过程中酶与底物结合的效率[24]。本试验利用纳米粒度仪测定O 组和Z 组油脂乳液在模拟婴儿体外胃肠道消化前的平均粒径分布(图1)。
由图1可知,O 组的平均粒径相对较小,大多分布在(198±9.72)nm 处,而Z 组的平均粒径集中分布在(229±15.61)nm 处,说明在消化初始阶段O 组油滴暴露出来的比表面积比Z 组大,较大的比表面积为与脂肪酶快速结合提供了重要条件,从而表现出较快的消化速率及较高的脂肪酸释放率。与其它研究相比,本试验所制备的油脂粒径更小,相关研究表明,液滴粒径越小(比表面积越大)越有利于油脂的消化分解[9]。
2.3 油脂消化曲线的分析
油脂在消化过程中会释放脂肪酸和单甘酯,消化过程中不同时间段的脂肪酸释放率可以反映出油脂的消化速率和消化程度。本试验测定了O组和Z 组在消化150 min (模拟胃液中消化30 min 和模拟肠液中消化120 min)过程中不同时间的脂肪酸释放率,结果如图2。
由图2可知,在整个消化过程中2 组样品脂肪酸的释放率都呈先增大后平稳的趋势,这说明在消化初期油滴与酶等物质结合,加快了消化速率,但随着消化时间的延长,2 组的油脂消化速率均趋于平稳。
在模拟胃液消化时,O 组脂肪酸的释放率高于Z 组,此时O 组脂肪酸释放率为(12.83±1.35)%,Z 组为(8.92±1.68)%,具有显著性差异(P<0.05)。在相同条件下,油滴粒径大小应与消化释放率呈负相关,由于O 组平均粒径较Z 组小13.54%,比表面积较大,增加酶反应的底物位点,更有利于与酶结合发生反应,因此提高了脂肪酸的释放率。
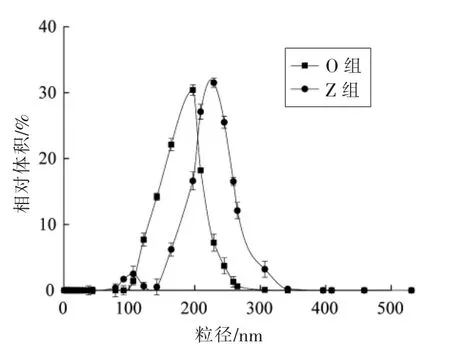
图1 油脂的平均粒径分布Fig.1 Average particle size distribution of oil

图2 油脂在模拟胃肠液消化过程中的脂肪酸释放率Fig.2 Fatty acid release rate of oil in simulated gastrointestinal fluid digestion
图2结果表明,在模拟胃肠液中消化30~60 min 时,2 组乳液样品脂肪酸的释放率迅速上升,其中O 组释放率达到 (61.63±2.57)%,Z 组为(50.71±1.94)%,原因可能是由于胃液消化产物的附着以及胆盐等的强乳化作用将油滴乳化成细小的乳糜微粒,增大了酶与底物的接触面积,使得专一性酶胰脂肪酶可以很好地与油滴结合,从而破坏油滴结构,使脂肪酸释放率迅速增加。OPO 结构油脂的Sn-2 位主要是饱和脂肪酸 (棕榈酸),Sn-1,3 位上连接的主要是不饱和脂肪酸,而普通油脂则相反[25],由于肠液中含有的胰脂肪酶是Sn-1,3 位专一性酶,因此,O 组油脂饱和度比Z 组低,可推测出O 组的脂肪酸释放率更高,与图中结果相符。
在模拟胃肠液中消化90 min 后,2 组乳液的释放率都逐渐趋于平稳,可能是随着模拟婴儿胃肠道消化环境中的脂肪酶的逐渐耗尽,导致消化进程基本停滞,脂肪酸的释放率几乎不变。从消化程度来看,O 组脂肪酸最终释放率为(62.67±3.21)%,而Z 组最终释放率为(51.83±0.98)%,高于Devle 等[17]描述的单一油脂的消化率,且O 组与Z 组相比具有显著性差异(P<0.05)。
2.4 油脂在消化过程中平均粒径的变化
本试验测得2 组油脂消化过程中平均粒径的变化情况如图3所示。
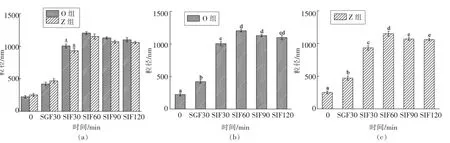
图3 油脂在体外模拟消化过程中平均粒径的变化Fig.3 Changes in average particle size of oil during simulated digestion in vitro
由图3可知,在消化初始阶段和模拟胃液中消化30 min 后,O 组平均粒径均小于Z 组,粒径大小与消化速率有关,粒径越大,对应的消化速率越小[26],与消化曲线相符。脂肪在胃中进行的只是初步水解,其主要的消化作用在小肠中进行[27]。
在模拟胃肠液中消化60 min 后,O 组平均粒径为(1 004.83±17.75)nm,Z 组为(931.29±20.53)nm,O 组和Z 组具有显著性差异(P<0.05),这可能是由于肠液中含有能够特异性水解OPO 结构脂的专一性胰脂酶,而其特殊结构使得油滴与酶、胆盐等物质的亲和力更强[28]。在模拟胃肠液中消化90 min 后,2 组油脂的平均粒径继续增大,此时O组平均粒径为(1 203.42±20.52)nm,Z 组平均粒径为(1 149.81±32.06)nm,可能是由于消化产物和酶、胆盐等物质包裹在油滴的表面,使粒径继续增大[23]。消化120 min 后,2 组油脂的平均粒径均有所降低,可能是在胆盐的作用下,使得被消化的油滴分子再次乳化,乳液平均粒径变小[29]。之后随着消化时间的延长,2 组乳液的平均粒径呈现出大致平稳现象,原因可能是随着模拟婴儿胃肠道消化环境中脂肪酶的耗尽,油滴表面包裹的物质达到饱和,脂肪酸的释放速率与物质的粘连速率相同,导致两者的平均粒径变化不大。
2.5 油脂在消化过程中zeta 电位的变化
本试验测得2 组油脂消化过程中zeta 电位的变化情况如图4所示。

图4 油脂在体外模拟消化过程中电位变化Fig.4 Potential changes of oil in simulated digestion in vitro
测定体外消化过程中乳液的zeta 电位可以反映出油滴表面组成的变化,一般情况下,液体体系的电位小于-30 mV 时,说明体系中颗粒之间的静电排斥力越强,体系越稳定[30]。由图4可知,2 组油脂乳液均带负电荷,且在消化初始阶段的zeta 电位均处于-30~-45 mV 之间,说明乳液处于稳定状态。在消化过程中2 组油脂乳液的电位均呈先增大后平稳的趋势。
在模拟胃液中消化30 min 后,O 组电位由初始电位 (-37.71±1.37)mV 变为 (-36.02±1.21)mV,而Z 组电位由(-40.29±2.61)mV 变为(-34.62±2.47)mV,说明在这个阶段,O 组油滴表面的电荷量变化并不显著(P>0.05),而Z 组油滴表面的电荷量变化较显著(P<0.05),因此,在这一过程中O 组电位变化较小,相对较稳定。
进入模拟胃肠液消化60 min 后,Z 组电位为(-31.74±1.21)mV,变化并不显著(P>0.05),O 组电位为(-29.16±0.85)mV,与在模拟胃液中相比变化显著(P<0.05),究其原因可能是由于肠液中含有的胰脂酶能够特异性水解OPO,破坏了油滴结构,使得表面的负电荷迅速减少,颗粒间的静电斥力减小,体系的电位增大。由于胰脂肪酶是等电点为5.0 的酸性蛋白,在模拟肠液中带负电荷,因此可以排除由胰脂肪酶吸附在乳液微粒上造成电位变化的因素[31]。进入模拟胃肠液中消化90 min 之后,随着消化时间的延长,2 种乳液的电位均趋于平稳,原因可能是在消化过程中模拟婴儿胃肠道体系中脂肪酶的消耗,油滴表面的附着物达到饱和,使得油滴表面的电荷量基本保持不变,电位趋于平稳。
2.6 油脂消化后的脂肪酸组成分析
油脂中的脂肪酸具有特定的生理功能,经消化后释放的脂肪酸种类和数量不同,人体对其吸收也会有差异[32]。表3为本试验测定的2 种油脂在体外模拟消化后的产物中游离脂肪酸和甘油单酯的脂肪酸组成情况。
由表3可知,2 组油脂乳液消化后产生的游离脂肪酸和甘油单酯的种类基本相同。其中O 组游离脂肪酸中占较高比例的主要是油酸 (41.21±3.63)%、棕榈酸(21.23±1.02)%、亚油酸(14.81±1.24)%,Z 组游离脂肪酸中油酸占 (30.63±2.86)%,棕榈酸占(31.71±1.73)%,亚油酸占(18.69±0.94)%,由此可见2 组油脂消化产生的脂肪酸在含量上具有显著性差异(P<0.05),且O 组中不饱和脂肪酸含量与母乳消化后不饱和脂肪酸含量[33]更接近。
O 组生成的甘油单酯主要是棕榈酸甘油单酯、油酸甘油单酯和十四碳酸甘油单酯,Z 组生成的甘油单酯主要有棕榈酸甘油单酯、油酸甘油单酯和亚麻酸甘油单酯。从饱和度上看,O 组生成饱和脂肪酸甘油单酯 (棕榈酸甘油单酯)较多,占(47.23±1.62)%,而Z 组棕榈酸甘油单酯含量较少,仅占(19.02±1.29)%,因此,O 组中Sn-2 位棕榈酸含量更高,较Z 组相比更易被婴儿肠道吸收。

表3 体外模拟消化后的乳液中脂肪酸组成(%)Table 3 Fatty acid composition in emulsion after in vitro simulated digestion (%)
3 结论
本试验通过制备OPO 母乳化结构油脂,模拟婴儿体外胃肠道消化环境,测定OPO 母乳化结构油脂与普通植物油脂在在体外胃肠道消化过程中脂肪酸释放率、粒径及zeta 电位的变化,从而分析OPO 结构脂在消化过程中脂肪酸释放特性。主要得出结论如下:首先,在模拟消化初始阶段,OPO油脂组与混合植物油组相比,分子粒径在预期范围内分布更加合理;其次,OPO 油脂组Sn-2 位棕榈酸含量比普通植物油脂含量高,且与母乳更接近,在模拟婴儿体外消化过程中表现出较高的脂肪酸释放率;此外,通过对比2 组油脂消化后的消化产物中脂肪酸和甘油单酯的含量,发现OPO 油脂组生成的游离不饱和脂肪酸和棕榈酸甘油单酯含量较高,更易于婴儿消化吸收,而混合植物油组则生成较多游离的饱和脂肪酸和不饱和亚油酸甘油单酯。本研究表明,与混合植物油相比,试验制备的OPO 结构脂,消化释放率高,脂肪酸组成更接近母乳,为母乳化脂肪在婴儿配方粉中的良好应用奠定了重要的技术基础。
