新型模式平台
——蜜蜂用于肠道菌群与营养健康研究
2021-01-15郎浩宇王小斐廖小军胡小松
郎浩宇,王小斐,陈 芳,廖小军,胡小松*,郑 浩*
(1 中国农业大学食品科学与营养工程学院 国家果蔬加工工程技术研究中心农业部果蔬加工重点开放实验室 食品非热加工北京市重点实验室 北京100083 2 中国农业大学(兴化)健康食品产业研究院 江苏兴化225700)
人类及动物的肠道是微生物的重要栖息地,人体肠道内的菌群数以亿计,菌群密度高达1011个/g[1]。肠道微生物能够影响宿主对膳食的摄取能力,与宿主的消化、营养代谢、免疫等密切相关[2]。例如高纤维饮食可以富集短链脂肪酸产生菌,增加肠道内短链脂肪酸浓度,降低内毒素产生菌的丰度,减少脂多糖进入血液引起的组织器官炎症[3]。正常状态下,肠道菌群与体内环境维持着动态平衡,一旦平衡被打破,肠道微生物结构发生失调,会导致人体多种疾病发生,例如肠胃疾病、糖尿病、肥胖、肠胃炎症、神经退行性疾病等[4-5]。与健康人群相比,肠道中厚壁菌门与拟杆菌的比例增加,双歧杆菌的丰度降低[6]。另外在治疗疾病时,一些药物可与肠道微生物配合达到更好的治疗效果。如在治疗II 型糖尿病时,补充二甲双胍联合益生菌可使肠道中双歧杆菌、霍氏真杆菌等有益菌显著增多,另支菌属等有害菌属显著减少,表明二甲双胍通过改变肠道微生物的组成,更好地发挥调节血糖作用[7-8]。因此,肠道微生物对食品营养的消化吸收、疾病的发生发展、干预治疗等都发挥着重要作用,基于肠道微生物的研究也为未来相关领域提供了新的方法与思路。
人类肠道菌群是个极其复杂的生态体系[9],大部分肠道菌株无法体外培养,并且由于人体试验的复杂性及伦理问题等,研究者们通常利用模式动物体系进行研究。目前研究的动物模型主要是啮齿动物,然而小鼠等动物模型成本较高,研究周期长且无菌个体难于获得。无脊椎模式动物,如果蝇、线虫等因寿命短,维护成本低,通量高等优点逐渐受到广泛利用[10]。然而,它们的肠道菌群组成不稳定,大部分为环境菌种,易受到外界因素、试验条件等影响[11]。例如:即使采用相同的饲养条件,黑腹果蝇肠道中的某些菌属在不同性别、不同年龄的宿主中仍存在偏向性[11]。与上述几种研究对象相比,蜜蜂具有生命周期短,成本低,不受伦理问题制约以及通量高等优势,蜜蜂的许多代谢相关基因和途径与哺乳动物具有保守性,并且在肥胖和糖尿病患病机制、致病菌抵抗等方面已具备相关研究基础[12-13]。
蜜蜂肠道菌群组成简单、稳定,仅由少数的核心菌种组成,且在肠道不同部位的分布具有一定规律。蜜蜂肠道菌均为特异性菌种,与外界环境菌种无关[14],并且核心肠道菌均可进行体外培养[15]。研究发现肠道菌可以帮助蜜蜂代谢食物组分,产生短链脂肪酸和氨基酸等,促进胰岛素样肽等激素信号相关基因的表达,进一步证明了蜜蜂与人等动物的肠道菌群具有相似的功能[16,18]。基于蜜蜂肠道微生物与人类等哺乳动物的肠道菌群结构和功能相似性,且蜜蜂个体具备相关健康和疾病的表型及途径、机制[12,19],奠定了其作为“肠道微生物-宿主疾病”模型的基础。本文首先就蜜蜂肠道菌群的特点进行总结,并对蜜蜂构造疾病模型的发展进行归纳,最后提出通过饮食干预蜜蜂进行相关疾病评价的可能性,为建立蜜蜂模式平台用于研究肠道菌群及营养健康的关联及干预和治疗疾病提供了理论依据和可行性操作流程。
1 蜜蜂作为肠道微生物研究的模式生物
蜜蜂在出生后经过卵、幼虫、蛹和成虫4 个发育阶段,通过普通PCR 或者荧光原位杂交显微镜检测发现幼虫的肠道菌群较为稀少[10]。美国德克萨斯大学Moran 实验室首次构建和验证了无菌蜜蜂体系,将羽化前的蜜蜂放入无菌培养杯中,通过正常培养就可以获得大量无菌个体[20](图1)。目前哺乳动物通过剖宫净化构建无菌模型,具有步骤繁琐、培养条件苛刻、代价高昂、容易污染等缺点,而其它模式昆虫也需要通过HgCl2、乙醇等化学试剂在其卵表面灭菌构建无菌模型[20]。无菌蜜蜂的获得较为简单且蜂王每日产卵量大,为蜜蜂成为模式生物提供了巨大优势。

图1 实验室蜜蜂培养示意图Fig.1 Cultivation of honey bee in the lab
近年来研究发现蜜蜂肠道微生物的结构组成简单且特异性强。蜜蜂肠道菌群主要有9 种细菌,占蜜蜂肠道总菌量的95%以上[23]。其中5 个核心菌种几乎存在于所有的蜜蜂个体当中:包括2 种革兰氏阴性菌Snodgrassella alvi (β-变形菌纲)和Gilliamella apicola (γ-变形菌纲);3 种革兰氏阳性菌:属于厚壁菌门的2 个乳杆菌属类群乳杆菌Firm-4、Firm-5 (Lactobacillus Firm-4、Firm-5)以及属于放线菌门的双歧杆菌 (Bifidobacterium),这5 个类群的细菌形成了蜜蜂肠道的核心菌群[16,21]。除核心菌以外,其余的4 个菌种:Bartonella apis,Apibacter adventoris,Frischella perrara 和Acetobacteraceae 数量不多且分布不稳定,但在肠道里也有专属的生态位[22-23]。蜜蜂肠道菌群在肠道内的分布具有一定的规律,菌群多存在于后肠且数量丰富,可达到108~109个。后肠又可以分为回肠和直肠2 个独立部分,回肠直径约2 mm 并带有6 个纵向褶皱。S.alvi 形成一层生物膜紧密黏附在回肠肠腔内侧肠壁上,G.apicola 则附着生长在S.alvi 之上;革兰氏阳性菌乳杆菌Firm-4、Firm-5 和双歧杆菌则作为优势菌种分布在后肠末端的直肠中。
基于无菌操作成本低、饲养简单、繁殖能力强、子代数量多、无菌个体易获得、肠道菌组成简单等特点,蜜蜂被认为是一个优秀的肠道微生物模型,其肠道菌的定植也具有实际可操作性,其它模式动物不可比拟。目前所有的蜜蜂肠道核心菌种均可以进行体外培养,部分可以进行基因操作,这些都有利于无菌/限菌蜜蜂体系的构建[10]。研究者将RNAi 技术应用于蜜蜂肠道共生菌,使改造后的工程菌能在蜜蜂肠道中持续释放特定的双链RNA,激活蜜蜂的RNAi 应答,减少特定病原体(病毒、寄生螨虫等)对蜜蜂的感染[25]。基于无菌蜜蜂构建平台通过对比无菌蜜蜂及粪菌移植再造的含有正常肠道菌的蜜蜂个体,研究发现肠道菌可以帮助宿主代谢食物组分,产生短链脂肪酸和氨基酸等物质,促进胰岛素样肽、胰岛素接收蛋白、卵黄蛋白原等激素信号相关基因的表达,对宿主的吻屈伸反应行为产生影响[16]。Zheng 等[17]通过对蜜蜂肠道菌群宏基因组及肠道菌基因组的数据分析,发现双歧杆菌和γ-变形菌是食物中半纤维素和果胶的主要分解者,证明相关基因位点对特定食物多糖组分(木聚糖、阿拉伯聚糖、半乳聚糖)的重要作用及调控情况,揭示了蜜蜂肠道微生物与人体肠道微生物群落的相似性,为解析肠道菌群对食物的高效降解提供了基础。综上所述,由于蜜蜂生活史短、易饲养、成本低且肠道微生物组成简单稳定、可在体外培养等特点,因此其为研究宿主与肠道微生物之间相互作用的理想动物模型。
2 蜜蜂作为疾病模型的研究进展
肠道微生态的平衡是影响宿主健康的重要因素。蜜蜂作为疾病模型对研究人类疾病发生和发展机制具有很大的优势:人类和蜜蜂的细胞生物学方面非常相似,包括调节基因表达、跨膜运输、细胞骨架构建、神经元和突触形成、细胞信号转导和细胞凋亡[26-28];人类的许多疾病基因与蜜蜂具有一定的同源性,通过对同源基因的深入研究进而对人类发病机制深入了解,不仅可以揭示疾病发生的细胞分子通路,还可以研究对疾病有调控作用的基因及其表达产物,寻找可能的干预作用靶点[29-30]。随着蜜蜂高质量基因组的获取[31]以及物种内变异与进化的研究,蜜蜂模式动物作为衰老、糖尿病、行为障碍等疾病的模型被越来越多的科学家所关注。
2.1 肥胖症
研究表明健康的肠道菌群可以调节宿主的体重,免于肥胖[32]。宏基因组测序结果显示双胞胎中较为肥胖个体者肠道中碳水化合物代谢相关的菌群丰度较高,且肥胖者肠道菌群定植的无菌小鼠体重明显高于其它小鼠[33]。Caesar 等[34]发现11 周龄的小鼠喂食猪油组体重显著增高,且拟杆菌丰度较高,而鱼油组中双歧杆菌、乳杆菌、链球菌和艾克曼菌(Akkermansia muciniphila)的相对丰度较高。艾克曼菌的丰度与体内甘油三酯的含量呈负相关,被认为在控制肥胖等代谢疾病中起着重要作用。这表明肥胖与肠道微生物有直接关系,肠道菌群通过促进机体对食物的吸收,因而蓄积脂肪导致增重。通过改变饮食可达到缓解肥胖症的目的,喂食白藜芦醇的小鼠,可改善肠道菌群组成和功能,从而改善肥胖及相关的代谢指标[35]。
最早的肥胖模型主要以传统的大鼠、小鼠等啮齿类动物为模式生物,随着研究的推进,啮齿类动物饲养成本高、周期长,应用模型向线虫、斑马鱼、果蝇等其它模式生物转变。食物诱导肥胖与人体肥胖的产生最为接近,模型构建主要包括高脂肪和高碳水化合物诱导2 种方法。哺乳动物肥胖模型中通常对体重、体脂指数、脂肪质量、脂肪细胞形态、血脂指数、甘油三酯、总胆固醇、高低密度脂蛋白胆固醇等进行评估,而果蝇肥胖模型中通常对寿命、体重、脂肪体、甘油三酯、糖异生和β-氧化有关的几种基因的表达进行评估[36-37]。
蜜蜂除了以花蜜、花粉、蜂粮为正常食物外,在实验室内也可以通过配置不同比例的糖、脂质、蛋白质来干预饮食。通过喂食高糖、高蛋白、高脂饮食来干预蜜蜂的饮食也可以建立如同果蝇一样的肥胖模型[19]。给成年工蜂喂食高糖饮食后脂肪和体重显著增加,类似的成年工蜂在喂食高蛋白花粉、低蛋白花粉和无蛋白饮食后,卵黄蛋白原(Vg)、总蛋白浓度和脂肪体内的蛋白质浓度具有显著差异[12]。高蛋白和高糖饮食对蜜蜂的存活率、体重、脂肪、总蛋白质含量以及血淋巴中的Vg 浓度均有影响,表明可以通过干预饮食,构建蜜蜂的肥胖模型。
2.2 II 型糖尿病
II 型糖尿病 (Type 2 diabetes mellitus,T2D)是一种由遗传和环境因素共同引起的复杂内分泌疾病。T2D 患者肠道内微生物菌群紊乱,种类和数量发生改变,肠球菌数量增多,双歧杆菌和肠杆菌丰度减少,尤其是产生丁酸盐的细菌数量差异较大[38]。研究表明通过改变果蝇、大鼠和秀丽隐杆线虫的碳水化合物、脂质和蛋白质等饮食的结构可以构建II 型糖尿病模型[39-41]。2011年,Musselman等[42]首次明确提出高糖饮食可以诱导果蝇出现胰岛素抵抗,血糖升高,脂肪大量储存的症状。Na等[43]通过给成年果蝇喂食高糖饮食,发现果蝇寿命缩短,心脏功能恶化,出现胰岛素抵抗,这些表型与人类II 型糖尿病患者的临床症状十分相似。在果蝇T2D 模型中,可以通过检测寿命、血淋巴中的葡萄糖和海藻糖含量、游离脂肪酸含量、胰岛素的分泌水平、胰岛素样肽(Insulin Like Peptide,ILP)的表达水平、β 氧化相关基因的表达水平,对T2D 进行评估。研究表明喂食灵芝孢子粉促进糖原合成和抑制糖异生来降低血糖水平,调节胆固醇稳态以改善II 型糖尿病血脂[44]。
与其它动物一样,蜜蜂也利用胰岛素/胰岛素样信号传导途径维持体内的营养稳态。蜜蜂与人类的ILP 基因序列、结构和功能较为相似,同时具有调节身体生长和葡萄糖稳态的功能。蜜蜂具有2 种胰岛素样肽(AmIlp1,AmIlp2),在脂肪体内不同的位置表达。喂食高脂饮食的蜜蜂比高蛋白饮食的蜜蜂AmIlp 1 表达明显更高,而AmIlp 2 和胰岛素受体底物基因的表达不受饮食的影响。当蜜蜂以30%或15%的蔗糖为食时,其中喂食高蔗糖的蜜蜂的血淋巴中,葡萄糖和果糖含量显著升高,其代谢率也显著提高[18,44]。长期给蜜蜂喂食高果糖和高蔗糖将引发有关蛋白质、酪氨酸和苯丙氨酸代谢的表达差异,其中胰岛素的分泌水平和ILP 的表达水平的差异是评估II 型糖尿病的重要指标之一。因此可以通过寿命、体重、血淋巴中的葡萄糖和海藻糖含量变化对蜜蜂II 型糖尿病进行评估,其II 型糖尿病的表型和评估方法与人类患者和其它模型生物有很多共同点。
2.3 神经退行性疾病
人类神经退行性疾病主要包括阿尔茨海默病、Tau 蛋白病、帕金森病、朊病毒病、多谷氨酰胺疾病和肌萎缩侧索硬化。近年来热度较高的“脑肠轴” 概念描述了中枢神经系统与胃肠道之间的关联。维持肠道的稳态对于宿主的健康至关重要,肠道营养不良可能会对肠道生理产生不利影响,导致脑肠轴信号异常,进而造成中枢神经系统的损伤。同时中枢神经系统的压力也会影响肠道功能,导致微生物群的改变。营养失衡、重金属摄取或其它环境刺激也会导致肠道菌群的平衡被打破,进而改变与疾病相关基因的表达,最终导致神经退行性疾病。研究表明可以通过喂食除草剂百草枯、农药鱼藤酮、1-甲基-4-苯基-1,2,3,6-四氢吡啶等环境相关毒素构建果蝇和小鼠帕金森症模型[46-48],这些毒素导致活性氧的形成从而破坏多巴胺神经元并选择性杀死神经元。通过对运动试验的评估、神经递质的检测以及产生神经递质和谷氨酸信号相关的基因表达的变化,评估帕金森症模型。而通过特殊饮食也可以改善神经退行性疾病,通过给自闭症谱系障碍小鼠模型喂食生酮饮食,显著改变其肠道菌群组成,缓轻疾病症状。通过饮食调控改善宿主肠道菌群,缓解神经退行性疾病是未来的重要方向[49]。
与人类相似,蜜蜂的视觉、听觉、嗅觉等本体感觉都通过大脑处理信息并传递给中枢神经系统。蜜蜂中振动信号和某些行为相关的基因,与人类帕金森症中涉及的基因(例如DJ-1,SUMO-1,UBC 7,EAAT2)是同源的[50]。给蜜蜂喂食新烟碱类农药可导致其体重、基础代谢率降低,且对蜜蜂的学习行为、活动行为和神经生理学产生负面影响[50]。此外,研究表明给蜜蜂喂食锰金属元素会影响蜜蜂的运动行为,下调运动相关基因 (DJ-1,SUMO-1,UBC7)和多巴胺生成基因(Dop1)的表达,上调一些与谷氨酸信号传导的相关基因的表达[51]。含有除草剂、杀虫剂、重金属以及缺乏营养的饮食会显著降低蜜蜂的成活率,且明显降低绛色细胞和王浆腺的大小,严重影响与嗅觉和触觉相关的学习行为,使其表现出与人类神经退行性疾病相似的症状[51,53]。蜜蜂体内与学习、振动信号有关基因的表达水平以及神经递质(如章鱼胺、多巴胺、5-羟色胺和酪胺)的浓度检测方法较为成熟,为其作为神经退行性疾病模型的研究提供了可靠依据。
2.4 炎症性疾病
肠道菌群可以保护肠道免受外源病原体和潜在的有害本体细菌的侵害,并调节宿主的免疫表达。肠道微生物可通过产生乳酸和短链脂肪酸来控制肠道pH 值,从而防止病原体的入侵[54]。炎症性肠炎患者的免疫系统存在缺陷,导致宿主体内的细菌炎症反应不当。化学物质诱导(例如,葡聚糖硫酸钠、2,4,6-三硝基苯磺酸TNBS、右旋糖酐硫酸钠等)通过破坏上皮细胞的通透性,激活巨噬细胞和中性粒细胞等免疫细胞,引起免疫应答,导致中肠细胞死亡率增加、中肠组织损伤,引起炎症并导致肠炎从而构建肠道炎症模型[55-56]。研究表明富含不饱和脂肪及纤维的地中海饮食,可改善肠道菌群及减少代谢内毒素从而改善宿主的炎症表现[57]。
蜜蜂通过激活高度保守的免疫途径,系统性地表达和释放抗菌肽来抵抗细菌、真菌和病毒病原体的入侵,这是哺乳动物和昆虫固有的免疫应答标志之一。细菌入侵感染后,细菌数量的增加会导致蜜蜂抗菌肽表达增强,以配合免疫系统清除细菌病原体。定植Snodgrassella alvi 及Gillimella apicola 的西蜂对于血淋巴感染的大肠杆菌具有显著抑制效果,且宿主会表达更多的抗菌肽,证明抑菌肽是宿主抵抗致病菌检测指标之一。在寄生虫感染后同样也会引起蜜蜂宿主免疫基因的表达。研究表明定植昆氏乳杆菌 (Lactobacillus kunkeei)、植物乳杆菌(Lactobacillus plantarum)乳酸菌后,可通过降低肠道内的pH 值及调节宿主的免疫从而抑制东方蜜蜂微孢子虫 (Nosema ceranae)及幼虫芽孢杆菌(Paenibacillus.larvae)的定植。抗生素使蜜蜂肠道细菌减少且免疫功能受损,导致编码抗菌肽的基因(Defensin 1)表达下调[58]。蜜蜂炎症的评估标准包括免疫反应基因表达水平的变化,对外来病原体和有害环境因素的抗菌活性的变化,以及蜜蜂肠道形态、上皮细胞和围食膜的变化,因此蜜蜂也可作为免疫和炎性疾病的潜在模型[59]。
3 蜜蜂肠道微生物与饮食干预和疾病发生的研究思路
蜜蜂幼虫的肠道菌群很少,因此构建无菌蜜蜂模型也较为简单。通常的操作流程为:从蜂脾中取出未羽化的成虫,置于无菌培养箱中1~2 d。将羽化后的蜜蜂饲喂无菌糖水及无菌花粉,置于无菌环境中培养即可获得无菌蜜蜂。类似地,可通过对无菌蜜蜂进行粪菌移植,再造含有正常肠道菌的蜜蜂个体,或者定植特殊肠道微生物构建单菌蜜蜂个体,定植后5~7 d 肠道菌群可达到稳定状态。将带有特殊肠道微生物菌的蜜蜂模型,通过饮食或者化学物质进行5~15 d 的干预、造模,可构建成所需要的蜜蜂疾病模型(见图2)。干预之后通过检测蜜蜂的生理生化指标(见图3),对蜜蜂疾病模型进行评估。“肥胖和糖尿病类蜜蜂”通过对血糖含量以及胰岛素抵抗、TOR 信号通路和糖异生相关基因的表达的改变、脂肪体脂滴形态以及甘油三酯含量等进行评估;“神经类疾病蜜蜂”可以通过对嗅觉、视觉、记忆等相关的行为、吻屈伸、学习等行为试验,以及神经递质的产生和神经元的表达等进行检测;“炎症病类蜜蜂” 通过对抗菌肽的产生、血细胞浓度及酶活的变化等进行评估(见图3)。蜜蜂疾病评价模型从蜂脾中取未羽化的成虫算起,到评价疾病指标,共需要12~24 d时间。蜜蜂疾病模型具有构建方法简单、易于操作、饲养简单和通量大的优点,会在未来人类疾病探究中起到重要作用。
4 总结和展望
近年来,肠道微生物在宿主健康、疾病发生和发展、营养干预及治疗等方面备受关注。作为非哺乳动物的蜜蜂生命周期短、成本低、通量高,且肠道微生物与人类等哺乳动物的肠道菌群结构和功能相似,许多基因及代谢途径和哺乳动物保守性高,个体具备相关健康和疾病的表型,奠定了其作为“肠道微生物-宿主疾病”模型的基础。本文综述了蜜蜂作为肠道微生物模型和疾病模型具有的特点和优势。但肠道微生物如何影响人类健康,仍然存在许多悬而未解的问题。蜜蜂具有诸多人类及动物的同源器官和生物学途径、相似的疾病表型以及易于调控的肠道微生物组。以饮食干预为指导治疗疾病,利用蜜蜂模式动物对饮食进行多指标活性评价,有利于阐释疾病病理机制及食物的作用机制,为食品营养与健康疾病的研究做出新的贡献。
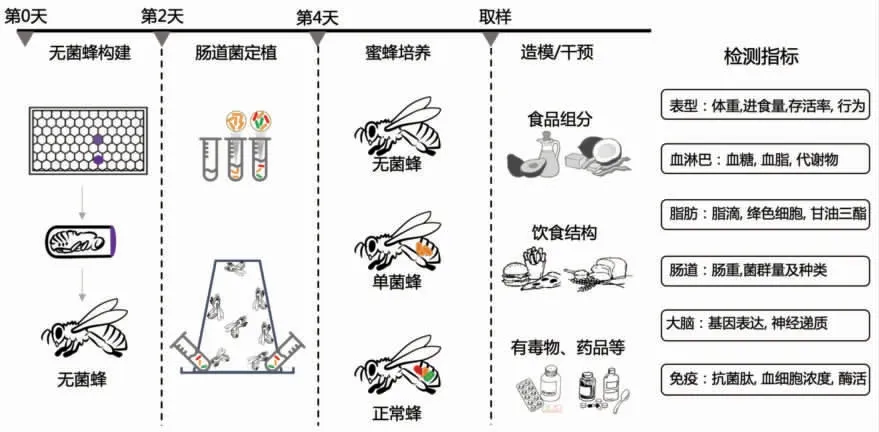
图2 蜜蜂肠道微生物与饮食干预和疾病发生的研究流程Fig.2 Using honey bee to study interactions among gut microbiota,dietary intervention,and diseases
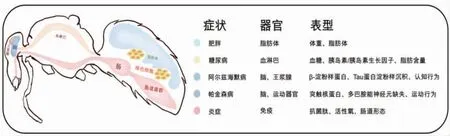
图3 蜜蜂作为模式动物研究肠道菌群与健康疾病Fig.3 Honey bee as model organism for the research of gut microbiota and diseases
