以癫痫发作为首发症状的临床中脑孤立综合征1例并文献复习
2021-01-07李萌萌王亚男鲁莹雪李光健
李萌萌,王亚男,仲 瑞,赵 嵌,鲁莹雪,李光健
临床孤立综合征(CIS)是指由中枢神经系统炎症或脱髓鞘引起的神经系统症状的首次发作,持续时间至少为24 h[1]。据统计,10%的CIS患者可表现为单一脑干症状,如复视、面部麻痹、构音障碍、共济失调等[2],而癫痫发作比较少见。既往实验研究表明:电或化学刺激脑干被盖特别是中脑网状结构(MRF)可诱发癫痫发作[3]。但目前为止有几例中脑损伤导致癫痫发作的报道均局限在脑血管疾病,本文我们报道1例以癫痫发作为首发症状的中脑CIS。
1 临床资料
患者,女,17岁,在校大学生,因“发作性言语不能、四肢僵硬1 m”于2019年7月18日就诊于我院。患者1 m前无明显诱因出现发作性舌根发硬、言语不能,四肢僵硬,维持一个姿势数秒钟缓解,运动和静止时均可发生,发作时意识清楚,每小时发作20~30次。既往体健,否认相关疾病家族遗传史。体格检查:未见神经系统阳性体征。辅助检查:入院当天头部MRI平扫+弥散(见图1A):中脑近中线两侧见对称性异常信号。入院后查铜蓝蛋白0.18 g/L(0.2~0.6 g/L);免疫5项:补体C3 0.63 g/L(0.7~1.4 g/L);双眼角膜未见“K-F”环;肝肾功、血清铜、甲功5项、红细胞沉降率、风湿3项、抗磷脂综合征抗体、抗中性粒细胞抗体筛查+确证、ANA系列、腹部彩超、头部MRA等均未见异常。腰椎穿刺术检查:脑脊液(CSF)呈无色透明、压力150 mmH2O;常规及生化:氯 130.9 mmol/L(119~129 mmol/L),余(-);血清及CSF中枢神经系统脱髓鞘疾病自身抗体结果示:仅于CSF中见到寡克隆带(OB);血清及CSF自身免疫性脑炎抗体、副肿瘤综合征抗体均为阴性。24 h脑电图(EEG)(见图2A):发作间期额区-额中线区见较多棘慢波、尖慢波,前头部著,有泛化。根据临床表现及辅助检查,考虑诊断为临床孤立综合征,局灶性癫痫发作。予以奥卡西平等对症支持治疗,发作次数较前减少,约10~20次/d。于2019年8月8日复查头部MRI平扫+弥散+增强(见图1B):中脑近中线两侧异常信号与之前比较无明显变化,后加用激素冲击治疗,应用激素第2天时发作即明显减少,第12天(2019-8-20)时患者已无发作出院。2.5 m(2019年 11月3日)随访时,患者诉出院后未再发作。复查头部MRI平扫+弥散(见图1C):中脑中线旁对称性异常信号,与前片比较未见明显变化。24 h EEG(见图2B):醒睡各期双侧额区大量尖波、尖慢波、棘慢波,可泛化至全导。7 m(2020年3月10日)随访时,患者无发作,复查头部MRI平扫+弥散(见图1D):左侧海马体积较对侧小,颞角扩大,中脑异常信号消失。16 h EEG(见图2C):醒睡各期右侧额-颞区少量中波幅尖化慢波,散在发放。逐渐减停抗癫痫药物及激素,9 m随访时停用所有药物。
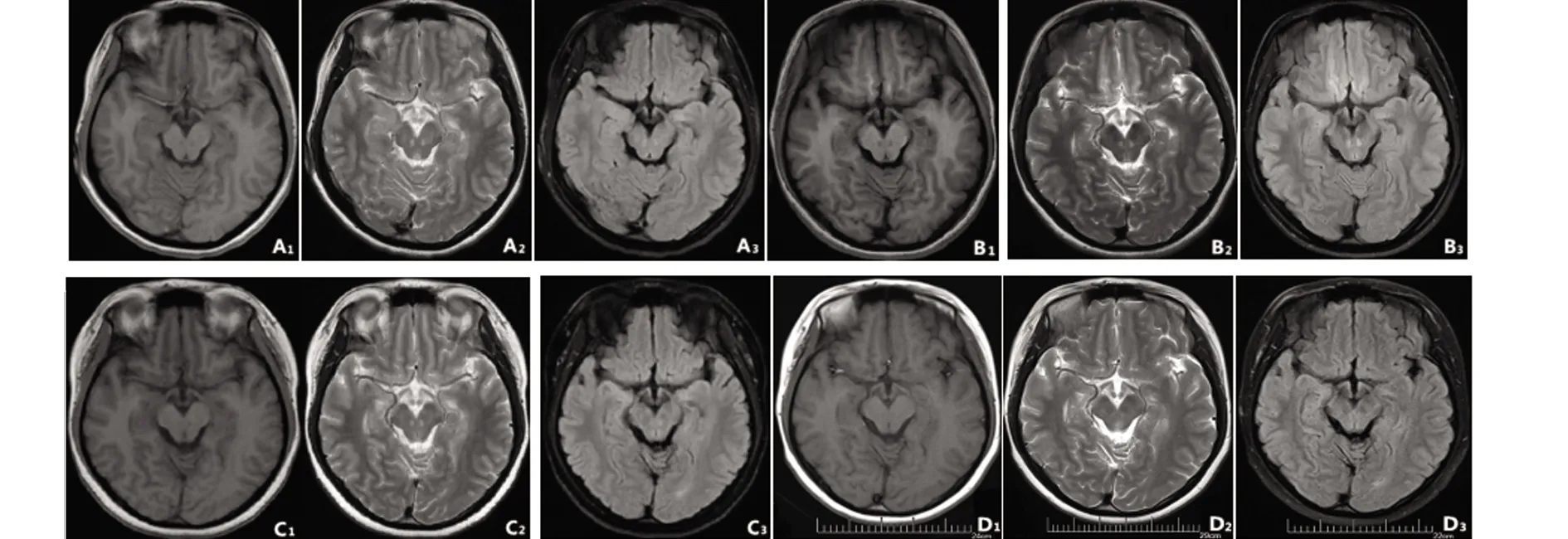
图A~D:分别为2019-7-18、2019-8-8、2019-11-3、2020-3-10头部MRI;1~3分别为T1WI、T2WI、FLAIR;A1~C3:可见中脑中线旁对称性斑片状稍长T1、稍长T2信号,FLAIR呈稍高信号;D1~D3:中脑异常信号消失

图A、B:分别为2019-7-22、2019-11-3的EEG,可见额区大量尖波、尖慢波、棘慢波,可泛化至全导;C:2020-3-10的EEG,可见右侧额-颞区少量中波幅尖化慢波
2 讨 论
该病例为年轻女性,以局灶性癫痫发作为首发症状,EEG提示局灶性异常放电,有泛化,早期头部MRI示中脑近中线两侧异常信号,CSF中发现OB。根据临床表现及辅助检查,患者符合CIS诊断,应用免疫治疗,在7 m随访复查头部MRI时中脑异常信号消失,同期EEG上异常放电也较前明显减少。由此推测该患者的癫痫发作可能源于中脑病变。
CIS是指首次发作的中枢神经系统炎性脱髓鞘病变所导致的神经系统症状,女性患病率是男性的2.5倍,70%的患者年龄介于20~40岁[4]。国外在对大型CIS患者数据库进行的审查中发现:21%的患者是视神经损害症状;46%为脊髓损害表现;10%为单一脑干症状;23%为“多灶性”异常[2]。其中,脑干受累时典型表现为:双侧核间性眼肌麻痹、共济失调和凝视诱发的震颤、外展神经麻痹、发作性症状(持续至少24 h)、多灶性异常(如面部感觉丧失和眩晕)等[4]。癫痫发作属于CIS的发作性症状之一,被普遍认为是皮质病变的表现。但Papathanasiou等人于2010年对多发性硬化症(MS)患者进行的关于诱发电位的研究显示:脑干病变可能是MS患者癫痫发作的原因;而且他们对与脑干相关的MRI数据的初步研究表明,有癫痫发作的MS患者中有脑干病变者占50%[5]。CIS和MS均属于中枢神经系统脱髓鞘疾病,因此,我们推测脑干损伤也可能导致CIS患者的癫痫发作。王学峰等人[6]总结了癫痫的脑干机制并得出:脑干中与癫痫的起始和驱动有关的系统包括脑桥、MRF、黑质、黑质输出及其靶区。既往国外虽然有几例因中脑损伤导致癫痫发作的病例报道,但局限在脑血管病方面(见表1)[3,7~12],而关于中脑损伤导致癫痫发作的CIS未见报道。
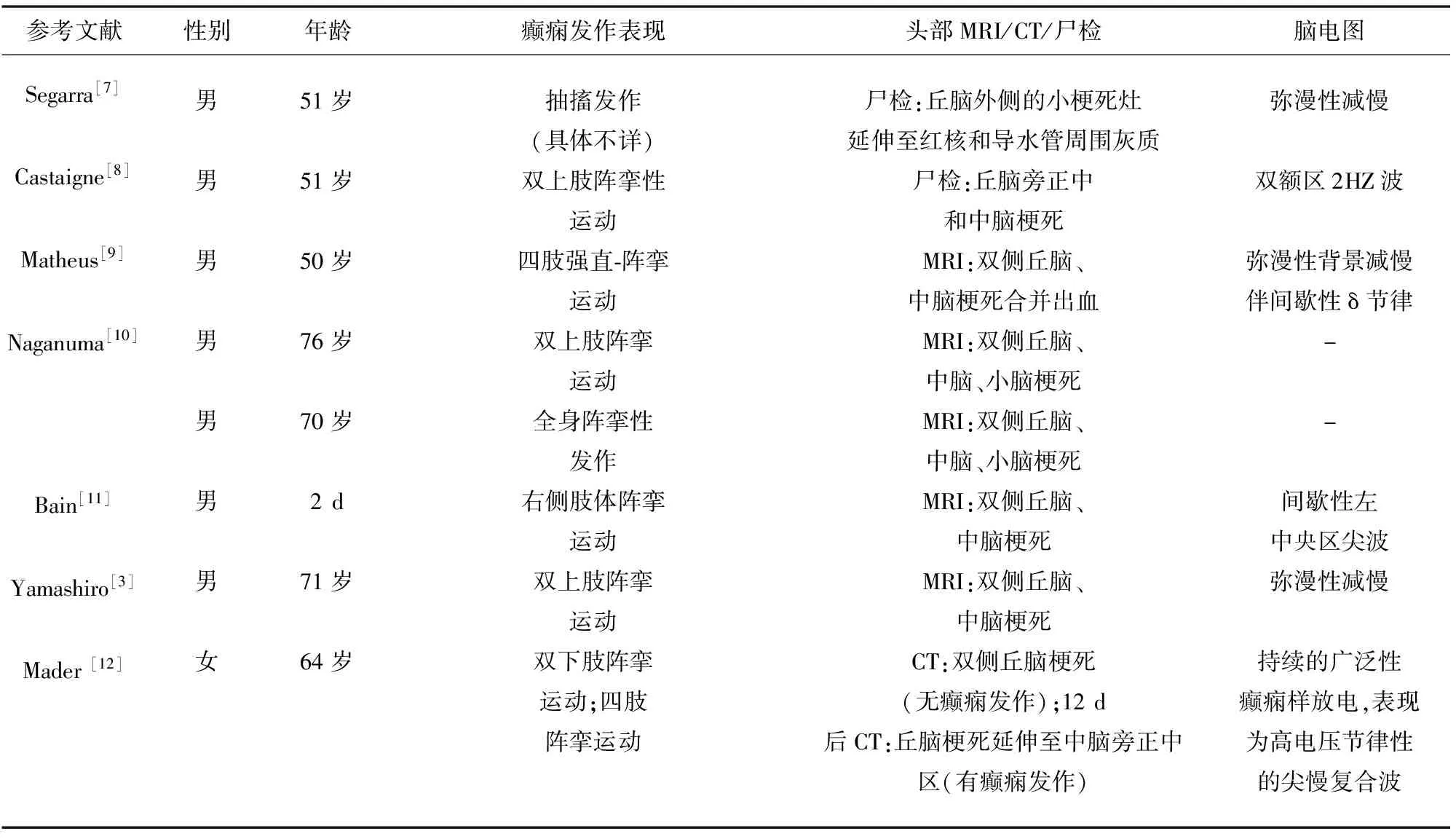
表1 双侧丘脑、中脑梗死或出血患者的癫痫发作
虽然普遍认为大脑皮质对癫痫发作很重要,但是以前的实验研究表明脑干网状结构(RF),特别是MRF,也参与了原发性癫痫的发生。脑干RF在癫痫中的作用:(1)中继作用:起源于皮质和边缘叶的痫性放电可通过多种路径进行扩布,但均在脑干会聚。因为丘脑损伤没有抑制诱导惊厥的作用,而脑干损伤则可完全抑制痫性放电的传播,所以推测MRF可能是会聚点。MRF的重要功能就是逐步将痫性放电下传[6]。(2)痫电发放:在大鼠、兔子和猫中对MRF施加电刺激会触发全身性强直性癫痫发作(GTS);向大鼠单侧MRF注射选择性γ-氨基丁酸(GABA)受体拮抗剂-荷包牡丹碱或N-甲基-D-天门冬氨酸(NMDA)也可诱发致命的GTS或全身性强直-阵挛发作(GTCS)。一项使用脑嵌合体技术对患有遗传性反射性癫痫的鸡胚的研究也表明中脑可能是癫痫发作的重要起源部位之一[13]。该病例中患者以癫痫发作为首发症状,头部MRI仅在中脑发现病灶,因此,我们推测其癫痫发作源自中脑病变。
既往癫痫研究人员几乎只专注于神经元改变。然而,近年来发现癫痫可能与非神经元改变有关,胶质细胞、细胞因子、血管改变和白细胞运输可能在癫痫活动的起始和维持中起关键作用[14]。CIS是一种中枢神经系统自身免疫性脱髓鞘性疾病,炎症机制可能是其癫痫发作的原因,有必要对可降低致痫阈值的过程(如小胶质细胞的激活和炎症)进行控制。我们的病例间接证实了上述机制,该患者在加用激素治疗后其发作明显缓解,且在后续激素维持治疗及缓慢减停中再无发作,可见控制非特异性炎症对治疗CIS的癫痫发作至关重要。此外,脱髓鞘纤维导致的异常传导(异位冲动的起源、对机械刺激敏感性增加、冲动传导过程的短路及冲动的回返传递)、脑水肿、神经细胞和胶质细胞的损伤也是导致CIS患者癫痫发作的可能机制[15]。
癫痫发作可能会诱发炎症变化,从而加剧CIS的恶化,因此必须进行及时有效的干预。原则上,CIS的治疗同MS的急性发作,但是至今尚无癫痫发作与CIS或MS的治疗指南,已经报道了抗癫痫药及静脉激素疗法的积极作用[14],我们的病例也证实了激素联合抗癫痫药物对于CIS癫痫发作的控制有效。一些临床医生建议对存在预后较差因素的CIS患者可予以β-干扰素或醋酸格拉替雷抑制炎症反应。除了抑制炎症,神经保护对于预防CIS长期残疾也很重要,神经保护治疗包括钠离子通道阻滞剂、他汀类药物、谷氨酸拮抗剂、大麻素等[4]。总之,CIS的治疗应根据患者的临床预后因素进行个体化治疗。
我们首次报道了因中脑损伤导致癫痫发作的CIS病例,旨在提高临床医生对中脑病变在癫痫发作中的认识,同时为以癫痫发作为表现的CIS或MS的诊治提供临床经验。
