大动脉粥样硬化性和心源性急性后循环大血管闭塞患者血管内治疗的疗效对比研究
2021-01-07陈富雷代林志朱立仓胡瑞月钱国栋
陈富雷,代林志,朱立仓,胡瑞月,钱国栋,许 晖,刘 祺,赵 冬
目前,脑卒中已经成为中国国民死亡的首位原因,其发病率以每年8.7%的速度增长[1]。急性缺血性脑卒中(acute ischemic stroke,AIS)约占所有脑卒中的70%,中国每年新发AIS患者超过200万[2]。2015年MR CLEAN、EXTEND-IA、ESCAPE、REVASCAT、SWIFT PRIME、DAWN、DEFUSE-3等7项[3~9]发表在NEJM上的RCT,均一致表明,机械取栓可以显著改善急性脑梗死患者的预后。但这些取栓有效证据,都来自于前循环,后循环是否有效仍未得到证实。2019年12月9日,中国学者刘新峰教授在Lancet Neurology上发表了全世界第一项关于后循环取栓的RCT研究—BEST研究[10],然而没有证据表明,血管内治疗和标准药物治疗良好预后比例有差异;2020年5月13日,荷兰进行的BASICS研究提示虽然后循环机械取栓是安全的,但是并未证实6 h内后循环取栓的有效性。虽然缺乏大型前瞻性研究证实急性后循环卒中血管内治疗的有效性,但 《2019 SNIS共识报告:后循环大血管闭塞性卒中的血管内治疗策略》[11],推荐急诊机械血栓切除术治疗后循环大血管闭塞是合理的(AHA类IIA,证据水平B-NR)。有研究表明不同病因分型预后不同[12],后循环预后仍是目前研究热点。新疆是中国脑卒中患病率较高的地区,本研究主要对在石河子大学医学院第一附属医院国家高级卒中中心治疗的LAA及CE后循环AIS患者行血管内治疗的预后进行分析。
1 资料与方法
1.1 研究对象 2017年1月1日-2019年12月31日于我院急诊行血管内治疗的LAA及CE后循环AIS患者。纳入标准:(1)影像学(DSA)证实为后循环急性卒中;(2)年龄大于、等于18岁;(3)入院时基线美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分[13]≥6分;(4)症状发生后6 h~24 h之间;(5)急诊行血管内治疗,以支架取栓、抽吸取栓为主要治疗手段;(6)TOAST分型为LAA或CE。排除标准:(1)影像学检查显示闭塞血管累及颅内多支血管;(2)既往改良Rankin量表(modified Rankin scale,mRS)评分[14]>2 分;(3)有出血性脑血管病史或出血倾向;(4)存在重要脏器功能障碍或衰竭或恶性肿瘤,预计寿命<2 y;(5)拒绝行相关影像学检查或拒绝行血管内治疗。为保证纳入患者的同质性,治疗过程中患者家属放弃治疗、伴有动脉瘤、动静脉畸形及动脉夹层的病例未纳入本研究。
1.2 治疗方法 按照急性缺血性卒中血管内治疗指南[15],对98例患者进行个体化血管内治疗。血管内治疗根据术中情况选择使用抽吸取栓、支架取栓。取栓后如果发生再闭塞,会采取补救治疗措施,主要包括球囊扩张成形、支架置入等。动脉粥样硬化性脑梗死取栓流程(见图1);心源性栓塞取栓流程(见图2)。
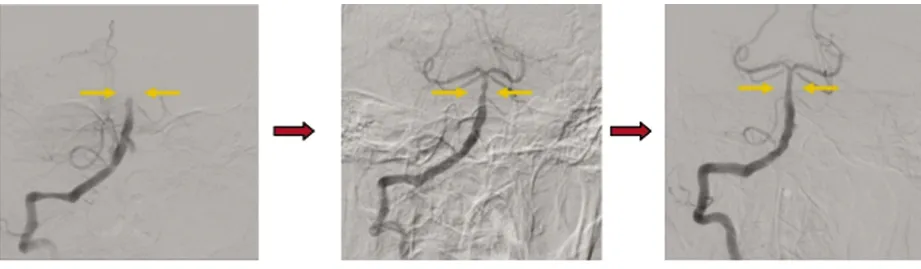
图1 动脉粥样硬化性脑梗死取栓流程
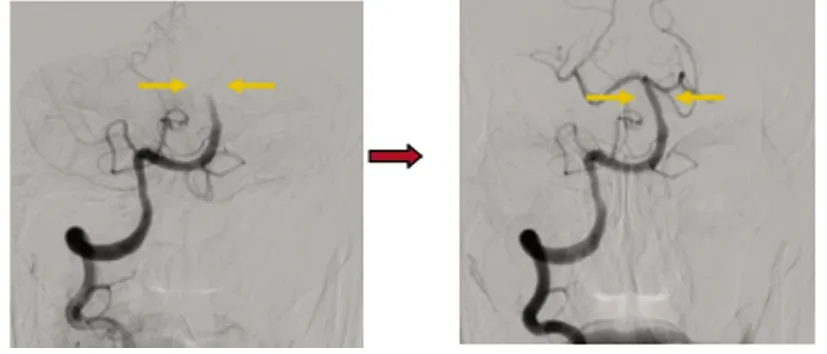
图2 心源性栓塞取栓流程
1.3 研究方法 收集患者的一般资料:年龄、性别、血压、血糖、血脂、白细胞计数、中性粒细胞百分比、白蛋白、吸烟史、饮酒史、心脑血管病史;辅助检查:头部CT、数字减影血管造影,记录侧支循环、责任血管及血管再通情况;治疗及预后:入院时NIHSS评分、症状出现至血管再通时间、血管成功再通率、术后72 h颅内出血转化发生率、90 d mRS 评分、90 d 卒中相关病死率。本研究为回顾性病例研究,经石河子大学医学院第一附属医院伦理委员会审批,所有患者签署手术同意书和知情同意书。应用DSA影像的美国介入与治疗神经放射学学会价入放射学学会(ASITN/SIR)分级系统[16]评估侧支循环情况,SIR 2-4级定义为有侧支循环。采用改良脑梗死溶栓(modified thrombolysis in cerebral infarction,mTICI)血管再通等级[16]评价血管再通程度,mTICI 2b级和3级定义为成功再通。术后 90 d mRS 评分≤ 2分为预后良好。

2 结 果
2.1 LAA组和CE组病例基线特征 本研究共纳入98名患者,79人为LAA,19人为CE,基本临床资料(见表1)。与CE患者相比,LAA 型患者的年龄较小(60.08±12.64 vs 71.05±10.42,P=0.001),高血脂患病率较高(55.7% vs 22.1%,P=0.014),术前收缩压更高(149.25±21.24 vs 134.79±22.83,P=0.010),但基线NIHSS评分(17.3 vs 22.2,P=0.025)以及与心脏相关基础疾病(冠心病、房颤、心脏瓣膜病)的患病率较低。性别、吸烟等其他基线特征在两组患者之间无统计学意义。
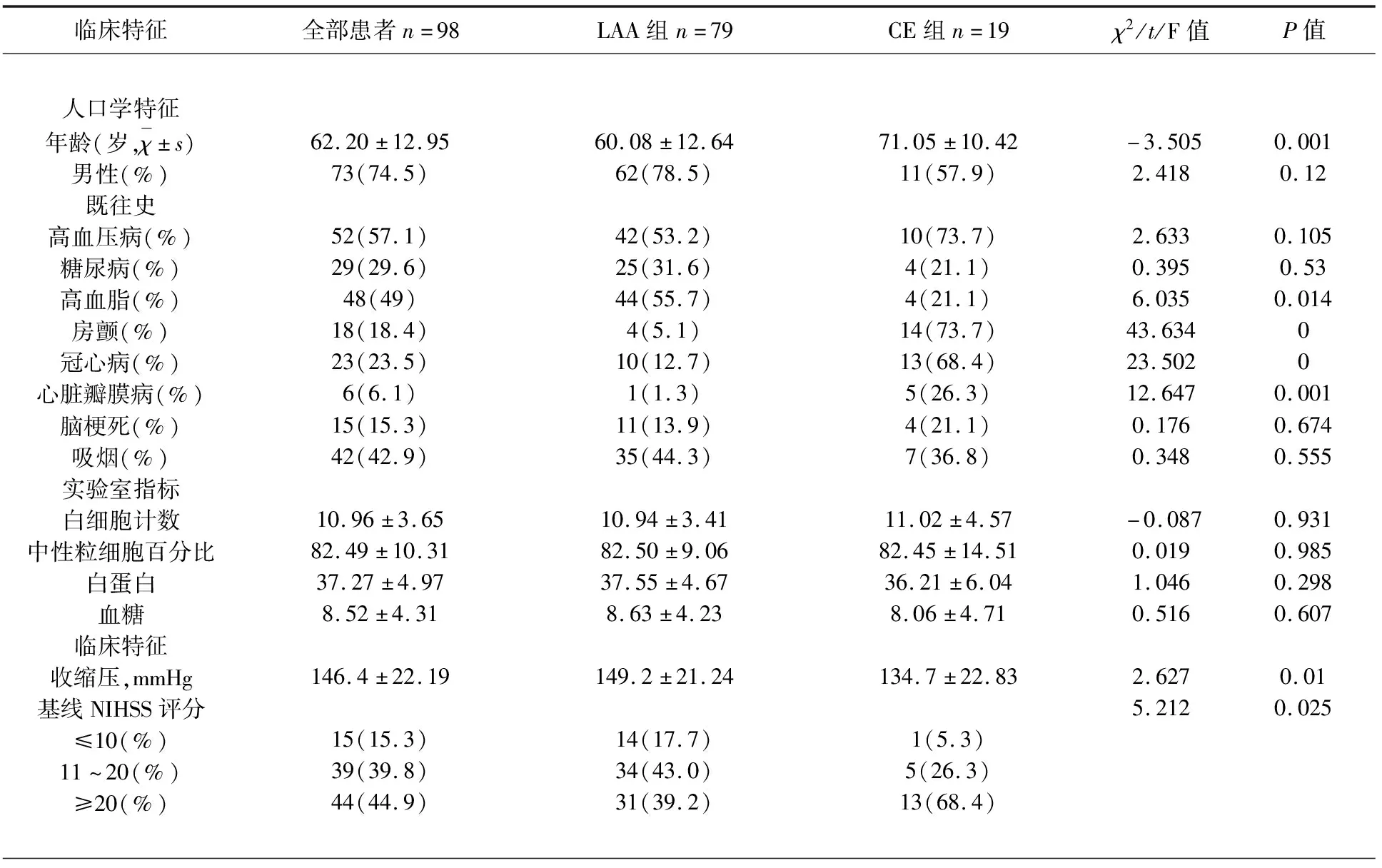
表1 基线特征
2.2 患者EVT基本特征 纳入患者接受EVT相关资料(见表2)。显示闭塞部位(责任血管)在两组患者之间没有统计学差异(P=0.075),术后血管再通(mTICI分级2b-3)比率均较高,但同样没有统计学差异(87.3% vs 84.2%,P=1.000)。与CE组患者相比,术中评价侧支循环良好(ASITN/SIR 评分:2-4)的患者比例在LAA组更多(63.3% vs 21.1%,P=0.002);LAA组患者术中血管成形(支架植入、球囊扩张)的比例更高(31.6% vs 5.3%,P=0.04)。
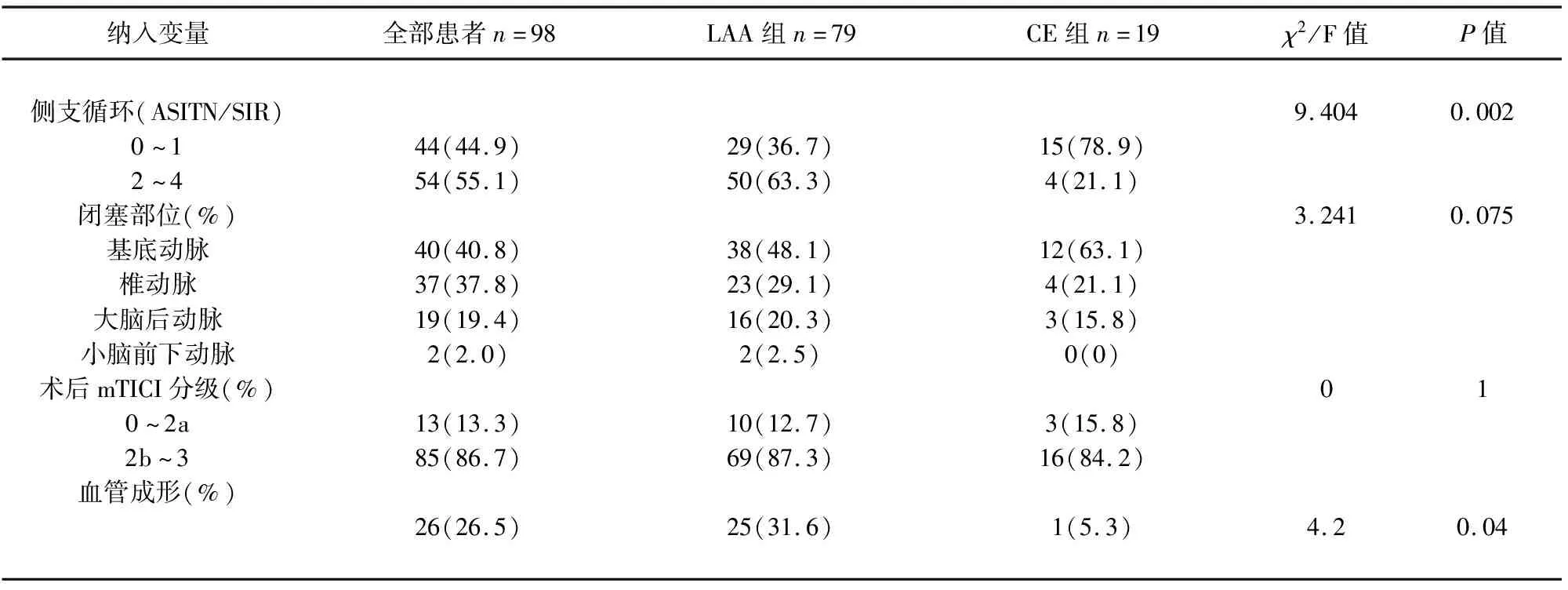
表2 血管内治疗相关特征
2.3 临床效果结局 90 d mRS神经功能预后情况(见表3、图3)。显示LAA组与CE 组患者无统计学差异(58.2% vs 36.8%,P=0.093)。
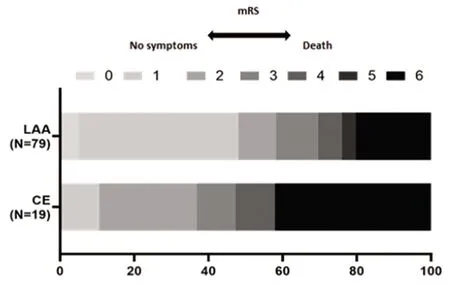
图3 90 d mRS分布
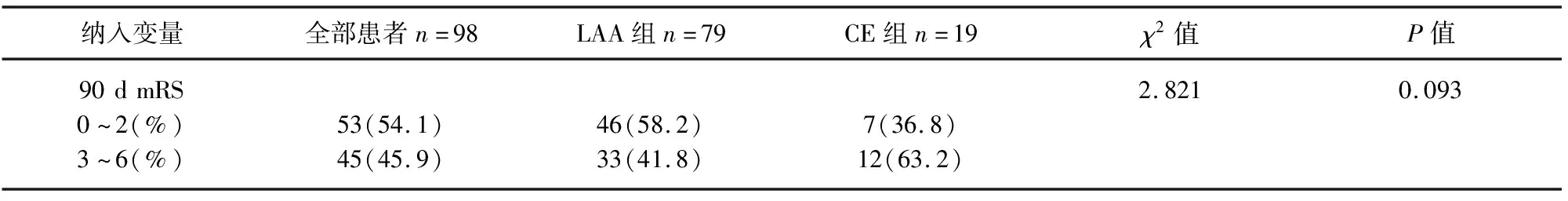
表3 临床效果结局
2.4 安全性结局 LAA组患者的90 d卒中相关死亡率与CE组无明显统计学差异(20.3% vs 42.1%,P=0.091)。两组患者EVT后再发梗死率(5.1% vs 5.3%,P=1.000)及颅内出血转化率无统计学差异(1.3% vs 0%,P=1.000)。具体情况(见表4)。

表4 安全性结局
3 讨 论
在西方,大动脉闭塞通常是由于近端栓塞所致。在亚洲,颅内动脉粥样硬化性疾病(IAD)很常见[17]。大量的临床实践指示,心源性栓塞患者多为栓子阻塞远端血管而血管本身常常不存在动脉硬化或狭窄,取栓的重点在于栓子而非责任血管;相反大动脉硬化型患者多在血管狭窄基础上导致闭塞,取栓的重点在于狭窄的血管,而非栓子。本研究通过收集后循环机械取栓的相关资料,比较大动脉粥样硬化性及心源性急性脑梗死患者EVT的疗效差异。本研究发现,后循环AIS中LAA和CE两组患者在基线临床特征和EVT相关特征存在差异,但EVT后临床疗效和安全性指标没有差异。
我们的研究发现,LAA和CE两组临床基线特征中年龄、血脂、基线NIHSS评分等指标存在显著差异。有研究[18]发现饮酒、吸烟等外界刺激因素导致血管内皮细胞代谢紊乱,导致脂质成分大量沉积,最终导致动脉粥样硬化及痉挛甚至血流中断,此外脑血管病遗传史、高脂血症、2型糖尿病、高血压等均为其发病的危险因素。心源性栓塞是无动脉硬化相关危险因素(经TCD及DSA检查无阳性结果),有明确存在心源性栓子产生的可能如陈旧性心肌梗死、风湿性心脏病、扩张性心肌病等心脏瓣膜病,尤其是合并阵发性心房纤颤等明确产生心源性栓子的疾病[19]。本研究临床基线特征与以上报道相似,即LAA组在高脂血症、术前收缩压增高所占比例较高,而CE组心房纤颤及瓣膜疾病所占比例较高,此外患者年龄、基线NIHSS评分也更高。CE组年龄更高可能是因为老年人心房颤动的患病率增加,由于起病急,突然的栓塞使机体未能及时建立侧支循环,脑血管易发生痉挛,引起脑部缺血症状更加激烈切明显,所以NIHSS评分更高。这些基线上的差异指导我们动脉粥样硬化型(LAA)脑卒中防治注重在于强化抗血小板、调脂、检测血压变化;而对于CE型的防治主要在于应用有效抗凝措施,检测INR变化,注重对心脏原发病治疗,临床上应依据病因的不同采取相应的二级预防措施。
本研究还发现虽然LAA组侧支循环更好,但由于其梗死部位有原位狭窄从而影响了再通效果术中需进一步行血管成形术的比率更高。首先,动脉粥样硬化性栓塞较心源性栓塞对局部血管壁的黏附性更强,经过支架取栓后常仅能达到部分再通(mTICI 2级)。通常情况下,残余狭窄>70% 被视为缺血性卒中复发的重要危险因素,如果残余狭窄<70%,但局部前向血流不充分仍然导致再闭塞风险增加[20];其次,取栓支架的外向径向支撑力不足,临时释放难以克服重度动脉硬化造成的局部狭窄,狭窄远、近端支架网格不能紧密嵌入血栓;再者多次取栓操作易造成病变部位斑块崩解、血管内膜损伤,局部血小板易激活状态而诱发二次血栓形成[21];最后,相关研究指出在栓子的病理构成上动脉粥样硬化栓子与心源性栓子不同:动脉粥样硬化栓子由纤维蛋白和血小板交织而成,而心源性栓子主要由红细胞包裹而成[19,22]。与此同时,本研究中LAA组与CE组血管再通率(mTICI 2b级和3级)的差异并无统计学意义,这可能是因为手术操作人员临床技术娴熟和采用血管成形术(球囊或支架)以及术中、术后使用糖蛋白Ⅱb/Ⅲa 抑制剂等,获得了较高的血管再通率。
与前循环临床疗效相比,本研究后循环LAA组和CE组接受EVT预后没有差异(58.2% vs 36.8%,P=0.093)。Kim等[23]在急性椎基底动脉闭塞患者血管内治疗的影响研究中指出后循环颅内动脉粥样硬化(IAD)发病率高,预后差。与我们的研究存在差异,可能因为地域差异使他们入组的患者中栓塞组数量更多(32 vs 19),mRS评分(0~3分)视为预后良好,以及动脉粥样硬化组行血栓切除术后血管成形未纳入疗效分析等因素有关。对于前循环AIS,有研究表明,西方国家CE脑卒中患者接受EVT治疗在出现并发症、血管再通率、远期预后等方面均优于LAA脑卒中患者[24]。在亚洲,相关研究数据表明LAA脑卒中患者EVT后效果较CE患者更好[25,26]。亚洲LAA型卒中更多,原因可能为LAA组主要病变在颈内动脉大血管,疾病进展有一定过程,远端缺血组织有较为充足的时间进行自我修复及血液循环代偿,相反,CE组栓子脱落导致大血管分支急性闭塞,代偿期循环未迅速建立,可能导致大面积脑梗死及神经功能迅速恶化。本研究后循环LAA组相对CE组术前建立的侧支循环更好,NIHSS评分更低,但未呈现出类似前循环一样的结果,其原因可能为:(1)后循环EVT更费劲,术后出现更多的并发症,且无效再通的可能性更高[27];(2)后颅窝较前颅窝体积更小,一旦发生大血管闭塞,脑水肿程度更重,患者预后更差;(3)即使LAA组显示出更好的侧支循环,但由于后循环闭塞不仅影响远端皮质血管分布区的血液灌注,同时由于脑桥、丘脑穿支受累,影响网状上行激活系统,因此LAA组再通后脑干穿支血流如果恢复不佳,症状仍可较重,且影响预后。本研究显示,虽然LAA组mRS评分为6分的比例较CE组少(20.3% vs 42.1%),但两组最终预后无差异,提示取栓后LAA组出现更多的神经功能缺损,无效再通率更高。同时,本研究两组患者的安全性结局均未发现有显著差别,LAA组和CE组患者EVT后再发梗死率(5.1% vs 5.3%,P=1.000)及颅内出血转化发生率无明显统计学差异(1.3% vs 0%,P=1.000)。在实际操作中导致血管穿孔导致的蛛网膜下腔出血或脑实质的出血在EVT中发生率不高,Berkhemer等[5]研究中出现2例(0.9%)出血,Campbell等[3]研究中出现1例(2.8%)出血。本研究中LAA组和CE组术后出血转化发生例数均较少(1.3% vs 0%),与以上研究结论相符;同时由于手术技术的成熟和术后规范药物治疗,再发梗死率也较低(5.1% vs 5.3%)。
值得一提的是本研究虽然基线NIHSS评分在两组之间有统计学差异,但最终预后没有显示出不同。究其原因,NIHSS评分的局限性包括关注肢体和语言障碍,而较少关注颅神经损伤[28]。因此多用于前循环急性闭塞的评价,对后循环评价目前虽然也普遍应用但仍有争议。在310名未经溶栓治疗的卒中患者的前瞻性队列中,NIHSS基线评分对良好的3个月预后的影响研究显示后循环卒中患者的NIHSS评分明显低于前循环。后循环神经损伤较多,症状可能仅为头痛、眩晕、恶心也或是直接昏迷,因此可见NIHSS评分对后循环有一定的局限性。
