补肾活血方对慢性特发性血小板减少性紫癜小鼠血小板功能的影响
2021-01-03刘晓秦兰李巍费飞吴雪琴
刘晓 秦兰 李巍 费飞 吴雪琴




摘要 目的:观察补肾活血方对血小板活化和聚集相关糖蛋白表达的影响,探讨该方是否能够通过改善血小板功能进而治疗慢性特发性血小板减少性紫癜(CITP)。方法:将60只小鼠随机分为正常对照组、CITP模型组、醋酸泼尼松组和补肾活血方组。通过被动免疫造模法成功建立CITP小鼠模型,然后分别用0.9%生理盐水、醋酸泼尼松和补肾活血方干预14 d,采用全自动动物血液分析仪检测小鼠外周血血小板数量和凝血时间;采用流式细胞仪检测各组小鼠血小板活化和聚集相关糖蛋白(CD41、CD61、CD62p、PAC-1)的表达。结果:与正常对照组比较,CITP模型组血小板显著下降、凝血时间显著延长。醋酸泼尼松、补肾活血方干预14 d后,与CITP模型组比较,其血小板显著增加,凝血时间显著下降;其糖蛋白CD41、CD61、CD62p和PAC-1的荧光强度和阳性率显著下降。结论:补肾活血方能在一定程度上有效增加血小板数量和降低凝血时间,并且能够通过改变血小板糖蛋白的表达进而改善血小板的功能,减轻患者的出血。
关键词 补肾活血方;慢性免疫性血小板减少症;血小板糖蛋白;血小板功能;血小板聚集;血小板活化;模型小鼠;凝血时间
Abstract Objective:To observe the effects of Bushen Huoxue Formula on platelet activation and aggregation-related glycoproteins expression,and to explore whether the the Formula can treat CITP by improving platelet function.Methods:A total of 60 mice were randomly divided into a normal control group,a CITP model group,a Prednisone acetate group,and a Bushen Huoxue Formula group.The mouse model of CITP was successfully established by passive immune modeling,and then treated with 0.9% saline,Prednisone acetate and Bushen Huoxue Decoction for 14 days,respectively.The peripheral blood platelet count and clotting time of mice were measured by a full-automatic animal blood analyzer.The platelet activation and aggregation-related glycoproteins (CD41,CD61,CD62p and PAC-1) of mice in each group were measured by flow cytometry.Results:Compared with the normal control group,the platelets in the CITP model group were significantly decreased and the clotting time was significantly extended.After 14 days of intervention of Prednisone acetate and Bushen Huoxue Decoction,compared with the CITP model group,its platelets increased significantly,and the clotting time decreased significantly.The fluorescence intensity and positive rate of its glycoproteins CD41,CD61,CD62p and PAC-1 decreased significantly.Conclusion:Bushen Huoxue Decoction can effectively increase platelet count and reduce the coagulation time to a certain extent,and can improve the function of platelets by reducing the expression of platelet glycoprotein and reduce bleeding in patients.
Keywords Bushen Huoxue Formula; Chronic immune thrombocytopenia; Platelet glycoprotein; Platelet function; Platelet aggregation; Platelet activation; Model mice; Clotting time
中圖分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.22.013
特发性血小板减少性紫癜(Idiopathic Thrombocytopenic Purpura,ITP)是一种由免疫介导的血小板破坏增多和巨核细胞产生血小板不足导致的临床出血性疾病。儿童以急性ITP较为常见,而成人则以慢性ITP(CITP)较为常见。ITP患者常因血小板减少而导致出血风险增加,但临床部分患者仅有血小板减少而没有出血症状[1-3]。目前,CITP并无有效的治疗方法,但越来越多的研究显示采用“健脾补肾”治疗原则具有一定的治疗效果[4]。我们课题组根据该原则自创的补肾活血方在治疗CITP方面效果明显[5-6]。前期我们研究发现,大部分患者使用补肾活血方后能使其血小板增加;有部分患者在使用补肾活血方后血小板增加并不十分明显,但临床出血症状却得到了有效的改善,这提示我们补肾活血方可能是通过其他途径来减少出血。本研究通过观察补肾活血方对小鼠凝血时间和血小板糖蛋白(CD41、CD61、CD62p和APC-1)的影响,探讨补肾活血方是否能够通过改善血小板功能治疗CITP,为补肾活血方治疗CITP提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 选取4~5周龄豚鼠10只,雌雄各半,体质量200~250 g;8周龄的SPF级健康BALB/c小鼠60只,雌雄各半,体质量18~22 g。以上实验动物均购自维世尔生物科技有限公司,动物许可证号:SYXK(湘)2018-001,室温饲养,避强光、噪声,自由进食和饮水。此项研究已通过新疆医科大学动物实验伦理委员会批准(伦理审批号:2018D01C288)。
1.1.2 药物 补肾活血方:由淫羊藿、巴戟天、锁阳、山药、山萸肉、炙黄芪、补骨脂、丹参、川芎、牛膝、菟丝子、当归、白术、茯苓、香附、鸡血藤、花蕊石、紫草、仙鹤草、连翘、炙甘草组成。由新疆维吾尔自治区中医医院煎煮并制成浸膏,含生药2 mg/mL。醋酸泼尼松溶液:用蒸馏水将醋酸泼尼松片(天津力生药业股份有限公司,国药准字H12018809)配制浓度为1 mg/mL的溶液。将制备好的各种药液储存至4 ℃冰箱备用。
1.1.3 试剂与仪器 完全弗氏佐剂和不完全弗氏佐剂(Sigma公司,美国,批号:556879)、FITC-CD41(SandCruz公司,美国,批号:338954)和PE-CD61(SandCruz公司,美国,批号:379845)荧光素标记的单克隆抗体及阴性对照试剂IgG1-FITC(SandCruz公司,美国,批号:546872)和IgG-PE(SandCruz公司,美国,批号:568497)、FITC-CD62p(SandCruz公司,美国,批号:395746)和PE-PAC-1(SandCruz公司,美国,批号:385694)荧光素标记的单克隆抗体及阴性对照试剂IgG1-FITC(SandCruz公司,美国,批号:546872)和IgG-PE(SandCruz公司,美国,批号:568497)。高速冷冻离心机(赛特湘仪,型号:H1650R);全自动动物血液分析仪(HORIBA ABX公司,法国,型号:MSLMS9-5 Vet);流式细胞仪(COUL TER公司,美国,型号:EPCICS ELITE)。
1.2 方法
1.2.1 分组与模型制备 将60只BALB/c小鼠随机分为4组:正常对照组,CITP模型组,醋酸泼尼松组,补肾活血方组,每组15只。正常对照组常规饲养,不造模。其余各组均按100 μL/(20 g·d)的剂量向小鼠腹腔内注射1∶4稀释的APS,连续8 d。制备豚鼠抗血小板血清:通过心脏取血获得BALB/c小鼠血小板,洗涤后与佐剂混合。在豚鼠足掌、背及皮下多点注射,心脏取血分离血小板,即得豚鼠抗小鼠血小板血清(APS)。将制备的APS保存在-20 ℃冰箱。实验前水浴解冻,洗涤后的BALB/c小鼠红细胞(1∶1)吸附APS 2次,0.9%生理盐水1∶4稀释APS备用。
1.2.2 给药方法 造模成功后各组每天均按0.1 mL/10 g体积药物(正常对照组和CITP模型组灌注0.9%生理盐水,醋酸泼尼松组和补肾活血方组分别灌注醋酸泼尼松溶液和补肾活血浸膏)灌胃干预,连续14 d。
1.2.3 检测指标与方法
分别在注射APS后8 h,分别从正常对照组小鼠和造模小鼠尾静脉取血,EDTA-Na2抗凝并充分混合后,用全自动动物血液分析仪检测小鼠血小板数目。实验结束后,从4组中随机各选择10只小鼠进行尾静脉取血,EDTA-Na2抗凝和枸橼酸钠并充分混合后,用全自动動物血液分析仪检测小鼠血小板数目和凝血时间。
1.2.3.1 流式检测小鼠血小板聚集功能 实验结束后,将各组小鼠眼球取血;以2% EDTA-Na2 100 μL抗凝;加100 μL PBS;800 r/min(离心半径10 cm)离心10 min,去上清液。3 000 r/min(离心半径10 cm),离心10 min;加入PBS 100 μL;分别于各管加入CD41、CD61抗体及阴性对照IgG1-FITC、IgG-PE各10 μL,放置10 min;加入1%草酸胺溶液2 mL,以溶解红细胞。放置10 min。3 000 r/min(离心半径10 cm)离心10 min,去上清液。加入PBS后,上流式细胞仪检测。
1.2.3.2 流式检测小鼠血小板活化功能 实验结束后,将各组小鼠眼球取血。以2%EDTA-Na2 100 μL抗凝;加100 μL PBS;800 r/min(离心半径10 cm)离心10 min,去上清液。3 000 r/min(离心半径10 cm)离心10 min;加入PBS 100 μL;分别于各管加入CD62p、PAC-1抗体及阴性对照IgG1-FITC、IgG-PE各10 μL,放置10 min;加入1%草酸胺溶液2 mL,以溶解红细胞。放置10 min。3 000 r/min(离心半径10 cm)离心10 min,去上清液。加入PBS后,上流式细胞仪检测。
1.3 统计学方法 采用SPSS 22.0统计软件分析试验数据,用均数±标准差(±s)表示计量资料,采用t检验比较2组之间的均数,采用方差比较多组之间的均数。以P<0.05为差异有统计学意义。
2 结果
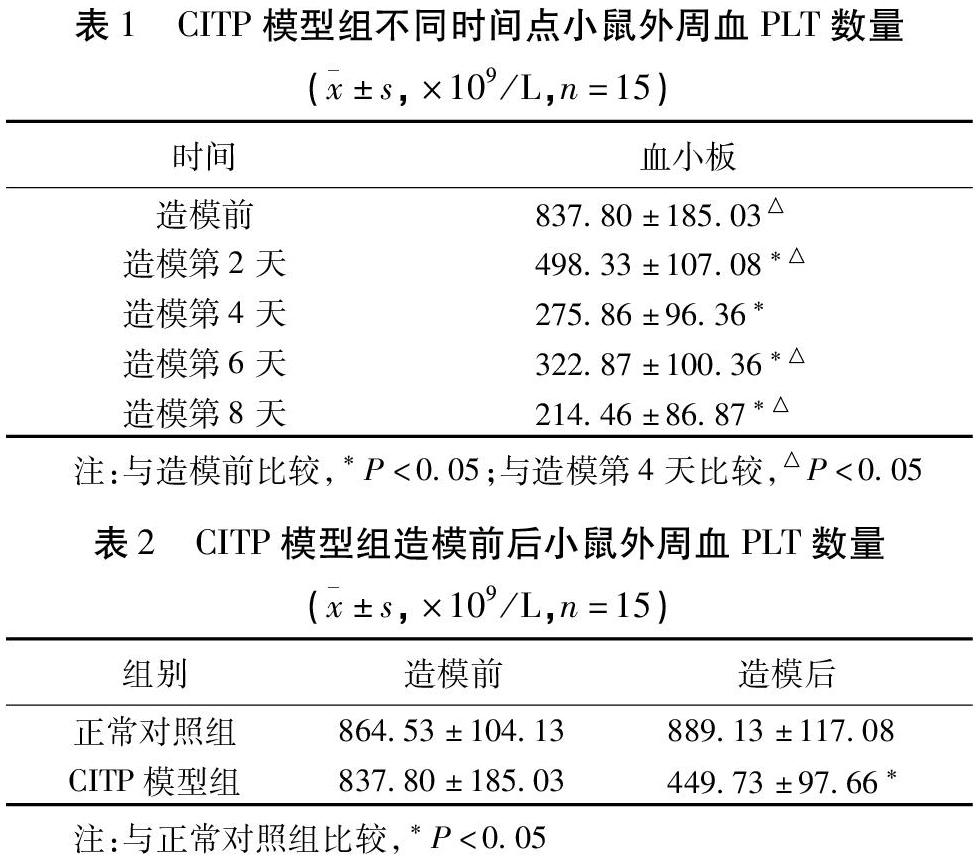
2.1 ITP模型的验证 通过采集正常对照组小鼠和CITP模型组小鼠尾静脉血液检测其血小板数量,结果显示注射APS后,与造模前比较,模型组各时间段小鼠外周血血小板数量显著下降(P<0.05),在4 d后降至最低(P<0.05),随后血小板有所回升,但仍处于较低水平;符合慢性ITP模型小鼠的特征,表明建模成功。见表1。此外,造模后,与正常对照组比较,CITP模型组小鼠外周血血小板数量显著下降(P<0.05)。见表2。
2.2 补肾活血方对ITP模型小鼠血小板和凝血时间的影响 实验结束后,通过检测各组小鼠血小板后发现,与正常对照组比较,CITP模型组、醋酸泼尼松组和补肾活血方组外周血血小板数量显著下降(P<0.05),与CITP模型组比较,用药各组外周血血小板数量显著升高(P<0.05);且补肾活血方组提升血小板数量的效果更佳(P<0.05)。此外,通过检测其凝血时间发现,CITP模型组凝血时间较正常对照组明显延长(P<0.05)。用药各组凝血时间均有不同程度缩短,其中补肾活血方的作用更为明显,与CITP模型组比较,差异有统计学意义(P<0.05)。见表3。
2.3 补肾活血方对CITP小鼠模型血小板聚集功能的影响 实验结束后,采用流式细胞术检测血小板聚集相关糖蛋白CD41和CD61,结果显示,与正常对照组比较,CITP模型组小鼠血小板糖蛋白CD41和CD61荧光强度和阳性率显著下降(P<0.05)。用药后,与CITP模型组比较,醋酸泼尼松组和补肾活血方组小鼠血小板糖蛋白CD41和CD61荧光强度和阳性率显著增加,尤其是补肾活血方组的效果尤为明显(P<0.05),但仍低于正常对照组。见表4~5。
2.4 补肾活血方对CITP小鼠模型血小板活化功能的影响 实验结束后,采用流式细胞术检测血小板活化相关糖蛋白CD62p和PAC-1,结果显示,与正常对照組比较,CITP模型组小鼠血小板糖蛋白CD62p和PAC-1荧光强度和阳性率显著下降(P<0.05)。用药后,与CITP模型组比较,醋酸泼尼松组和补肾活血方组小鼠血小板糖蛋白CD62p、PAC-1荧光强度和阳性率显著增加,尤其是补肾活血方组的效果尤为明显(P<0.05),但仍低于正常对照组。见表6~7。
3 讨论
ITP是一种以血小板破坏过多、外周血小板显著减少,并伴有骨髓巨核细胞发育成熟障碍的自身免疫性疾病[7]。ITP在成人中常以慢性为主,约占80%,这些患者在临床上常存在皮肤黏膜出血,严重情况可导致内脏或颅内出血,且其出血风险会随年龄增长而增加,这是导致CITP患者死亡的主要原因[8-9]。因此,及时控制出血、提升血小板是治疗CITP患者的主要目的。目前我国治疗ITP的指南推荐一线治疗为糖皮质激素,但长期使用糖皮质激素会导致感染,血压、血糖升高,骨质疏松,股骨头坏死等不良反应,同时使患者生命质量下降[10]。因此,寻找其他能有效改善CITP患者出血症状且减少不良反应是目前治疗CITP患者的重中之重。中医中药在治出血性疾病方面有着悠久的历史,积累了大量的经验,因此,以中医中药理论为指导,开展ITP的治疗实践和机制研究,在ITP的治疗中具有重要意义。
当代中医学界对ITP病因比较一致的看法是:虚损为本、邪实为标、虚实错杂。目前许多中医界的学者都认为脾肾亏损是导致ITP(包括急性、慢性和难治性ITP)发病的根本原因[11-12]。近年来中医多采用辨证分型论治、固定治法(肝、脾、肾论治)[13-15]、固定方药以及自制中成药治疗等方法治疗ITP。通过之前的临床研究,我们发现使用补肾活血方能改善CITP患者的临床出血症状,在治疗CITP患者中取得了较好的疗效[16]。而此次通过动物实验,我们发现大部分CITP小鼠通过使用补肾补血方后能有效地提升血小板数量;有一小部分小鼠提升血小板的效果虽然不理想,却仍能明显改善出血症状,但其相关机制目前却未完全阐述清楚。
除血小板数量外,血小板功能也是血小板发挥止血作用的重要参数。目前,有关补肾活血法治疗CITP的机制研究只要集中在免疫方面[17-18],而补肾活血法对血小板功能影响的研究是比较少的。本研究主要从血小板活化和聚集功能方面探讨补肾活血法治疗CITP的机制。血小板聚集和活化是血小板发挥止血的2个重要环节。正常情况下,血小板一般都是出于静息状态(静息血小板),当血管受损后受到其他刺激后,血小板会被激活,黏附至受损区域,并释放多种颗粒内容物,从而促进快速止血。在血小板活化和聚集过程中,会释放出多种具有特异性的标志物,其中最有特征性的是CD41、CD61、CD62p和PAC-1[19-20]。
GPⅡb(CD41)和GPⅢa(CD61)是血小板膜表面表达最丰富的中的2种糖蛋白[21],在血小板受诱聚剂作用下2种蛋白相互作用成能与纤维蛋白原结合的GPⅡb/Ⅲa复合物。止血过程中该复合物在血小板的黏附、聚集、血块收缩、血小板活化过程中的信号转导中发挥重要的作用。本研究通过流式检测CD41和CD61来反应血小板的聚集功能,通过研究发现,CITP小鼠CD41和CD61荧光强度和阳性率显著下降,而在使用补肾活血方后,CD41和CD61荧光强度和阳性率显著增加,这表明补肾活血方能明显增加血小板的聚集功能。
CD62p和PAC-1是血小板活化的重要和早期标志物,可直接反映血小板的活化状态[22]。在正常情况下,CD62p少量表达在血小板表面,而PAC-1已单体形式存在,无法与配体结合。当血小板发生活化后,CD62p会迅速、大量表达在血小板表面,而PAC-1则会与多种黏附蛋白特异性结合,进一步促进止血。本研究通过流式检测CD62p和PAC-1来反映血小板的聚集功能,研究发现,CITP小鼠CD62p和PAC-1荧光强度和阳性率显著下降,而在使用补肾活血方后,CD62p和PAC-1荧光强度和阳性率显著增加,这表明补肾活血方能明显增加血小板的活化功能。上述结果表明血小板糖蛋白的异常可能会直接影响血小板的发挥其止血功能,这也可以解释为什么临床上有些CITP患者血小板数量较少但出血风险较低,这也是本研究CITP小鼠使用补肾活血方后,血小板数量提升不明显,但能有效改善出血症状的重要原因。
本研究首次探讨了补肾活血方对ITP小鼠血小板活化和聚集功能的影响。但同时还存在一定局限性,本研究未研究补肾活血方对ITP小鼠血小板数量、功能及凝血时间的动态变化,因为这些变化有助于判读补肾活血方在临床上的治疗效果,值得更深入地研究。
综上所述,补肾活血方通过影响CITP模型小鼠血小板糖蛋白CD41、CD61、CD62p和PAC-1的表达水平;从而影响外周血小板的聚集和活化功能,加强止血效应。此外,本研究也为补肾活血方治疗CITP患者提供了理论支撑和实验依据。
参考文献
[1]中华医学会血液学分会止血与血栓学组.成人原发免疫性血小板减少症诊断与治疗中国专家共识(2016年版)[J].中华血液学杂志,2016,37(2):89-93.
[2]Provan D,Stasi R,Newland AC,et al.International consensus report on the investigation and management of primary immune thrombocytopenia[J].Blood,2010,115(2):168-186.
[3]Neunert CE,Cooper N.Evidence-based management of immune thrombocytopeni-ia:ASH guideline update[J].Hematology Am Soc Hematol Educ Program,2018,30(1):568-575.
[4]杨阳,傅丽娟,陈滨海,等.周郁鸿教授从脾肾论治免疫性血小板减少症的经验总结[J].浙江中医药大学学报,2020,44(1):68-71.
[5]秦兰,刘晓,李巍,等.泼尼松加用益气补肾活血中药治疗慢性免疫性血小板减少症的临床疗效[J].新疆医科大学学报,2015,38(3):329-331.
[6]靳贺超,于文涛,刘晓,等.补肾活血方对血管性痴呆大鼠脑海马细胞凋亡及ERK2,CREB表达的影响[J].中国实验方剂学杂志,2018,24(12):129-135.
[7]Ghanima W,Godeau B,Cines DB,et al.How I treat immune thrombocytopenia:the choice between splenectomy or a medical therapy as a second-line treatment[J].Blood,2012,120(5):960-969.
[8]Mahévas M,Michel M,Godeau B.How we manage immune thrombocytopenia in the elderly[J].Br J Haematol,2016,173(6):844-856.
[9]Moulis G,Palmaro A,Montastruc JL,et al.Epidemiology of incident immune thrombocytopenia:a nationwide population-based study in France[J].Blood,2014,124(22):3308-3315.
[10]Marini I,Bakchoul T.Pathophysiology of Autoimmune Thrombocytopenia:Current Insight with a Focus on Thrombopoiesis[J].Hamostaseologie,2019,39(3):227-237.
[11]郭锦荣.周永明治疗免疫性血小板减少症经验[J].辽宁中医药大学学报,2013,15(10):123-125.
[12]李柳.麻柔治疗免疫性血小板减少症经验[J].中医杂志,2011,52(16):1363-1365.
[13]倪静,王缨.和肝化瘀法治疗慢性特发性血小板减少性紫癜概述[J].江苏中医药,2012,44(6):75-77.
[14]杜忠海,孙长岗,牛术仙.凉血止血理肝扶脾法治疗特发性血小板减少性紫癜的临床研究[J].四川中医,2013,31(11):60-63.
[15]郑其进,于天启.祛风凉血补肾法治疗难治性ITP15例疗效观察[J].河南中医,2010,30(6):580-582.
[16]禹霞,白玉盛.益气活血法治疗特发性血小板减少性紫癜30例[J].实用中医内科杂志,2010,24(4):93-94.
[17]张瑞峰,鲍计章,周永明.从脾肾论治原发免疫性血小板减少症研究进展[J].中医学报,2020,35(2):285-290.
[18]巩路,张广社,周永明.从肾论治原发免疫性血小板减少症研究进展[J].吉林中医药,2014,34(6):640-642.
[19]Asare R,Opoku-Okrah C,Danquah KO,et al.Assessment of platelet indices and platelet activation markers in children with Plasmodium falciparum malaria[J].Malar J,2020,19(1):143.
[20]黄喆,刘文君,曹汴川,等.儿童急性淋巴细胞白血病血小板参数及血小板膜糖蛋白臨床意义研究[J].中国实用儿科杂志,2017,32(5):366-370.
[21]吴涛,姜瑞民,苏颖.血小板膜糖蛋白研究进展[J].北京医学,2011,33(8):701-703.
[22]Huang Z,Liu W.Progress in research on platelet glycoproteins of Thrombocytopenia in children[J].Appl Clin Pediatr,2014,29(8):227-230.
(2020-03-18收稿 责任编辑:王明)
