基于网络药理学预测金匮肾气丸治疗骨质疏松症的作用机制
2021-01-03李伟李春根穆晓红陈黎明陈琛赵子义
李伟 李春根 穆晓红 陈黎明 陈琛 赵子义





摘要 目的:基于網络药理学预测金匮肾气丸治疗骨质疏松症的作用机制。方法:通过中药系统药理学数据库与分析平台(TCMSP)、中药分子机制综合数据库(TCMID)、中药分子机制生物信息学分析工具(BATMAN-TCM)等数据库检索金匮肾气丸药物成分及成分相关靶点;以“Osteoporosis”为关键词在人类基因数据库(GeneCards)、在线人类孟德尔遗传数据库(OMIM)、DrugBank等数据库检索骨质疏松症疾病相关靶点;制作韦恩图,获取药物-疾病交集靶点;利用String数据库、Cytoscape 3.6.1软件构建药物-疾病交集靶点蛋白互作网络及药物-成分-疾病-靶点网络;通过DAVID数据库对药物-疾病交集靶点进行基因本体(GO)、京都基因和基因组百科全书(KEGG)富集分析,并将富集结果可视化。结果:共获得金匮肾气丸药物成分118个,包括槲皮素、山柰酚、大黄素等;有效成分相关靶点202个,疾病相关靶点1 856个,药物-疾病交集靶点87个,包括前列腺素内过氧化物合酶2(PTGS2)、转录因子(JUN)、胞间黏附分子1(ICAM1)等;GO富集分析功能条目376条,其中生物过程(BP)290条,细胞组分(CC)28条,分子功能(MF)58条,包括RNA聚合酶Ⅱ启动子的转录正调控、类固醇激素受体活性等;KEGG信号通路共90条,包括类风湿性关节炎信号通路、破骨细胞分化信号通路、催乳激素信号通路等。结论:金匮肾气丸通过槲皮素、山柰酚、大黄素、薯蓣皂苷元、β-谷甾醇等有效成分作用于PTGS2、JUN、ICAM1、白细胞介素-1β(IL-1β)、基质金属蛋白酶9(MMP9)等关键靶点通过抗氧化、抑制炎症反应、促进成骨细胞增殖分化、抑制破骨细胞骨吸收等作用机制达到治疗OP的作用。
关键词 金匮肾气丸;骨质疏松症;网络药理学;药物成分;作用靶点;信号通路;作用机制
Abstract To predict the mechanism of Jinkui Shenqi Pill in the treatment of osteoporosis based on network pharmacology.Methods TCMSP,TCMID,BATMAN-TCM databases were used to retrieve the drug components and related targets of Jinkui Shenqi pill; the related targets of osteoporosis were searched in GeneCards,OMIM,DrugBank databases with the key word of “osteoporosis”; the common target of the drug-disease were obtained by generating Venny diagrams; string database and Cytoscape 3.6.1 software were used to construct the drug-disease common target protein interaction network and drug-component-disease-target network; finally,GO and KEGG enrichment analysis of common target were carried out through David database,and the enrichment results were visualized.Result A total of 118 chemical components from Jinkui Shenqi pill were obtained,including quercetin,kaempferol,emodin,etc.; there were 202 active component related targets,1856 disease-related targets and 87 drug-disease common targets,including PTGS2,JUN,ICAM1,etc.; there were 376 functional items analyzed by GO enrichment analysis,namely 290 biological processes (BP),28 cellular components (CC) and 58 molecular functions (MF),including the positive regulation of transcription from RNA polymerase Ⅱ promoter and steroid hormone receptor activity; there were 90 KEGG signaling pathways,mainly including rheumatoid arthritis signaling pathway,osteoclast differentiation signaling pathway,prolactin signaling pathway,etc.Conclusion Jinkui Shenqi Pill functions mainly through quercetin,kaempferol,emodin,diosgenin and beta-sitosterol on key target genes of PTGS2,JUN,ICAM1,IL1B and MMP9 through the mechanism of anti-oxidation,inhibition of inflammatory reaction,promotion of osteoblast proliferation and differentiation,inhibition of osteoclast bone absorption,and finally achieve the therapeutic effect of treat OP.
Keywords Jinkui Shenqi Pill; Osteoporosis; Network pharmacology; Drug components; Target of action; Signaling pathway; Mechanism of action
中图分类号:R285;R274.9文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.22.004
骨质疏松症(Osteoporosis,OP)是一种复杂的全身性的骨代谢性疾病,其基本机制是骨吸收与骨形成的失衡,主要表现为骨密度、骨量的降低及其骨骼细微结构的改变[1]。随着我国社会老龄化的加深,OP的发病率逐年升高,据最新数据统计,OP在我国的发病率为13%[2],随之而来的骨质疏松性骨折的发病率也逐年攀升,给社会及家庭带来了严重的经济负担。研究发现OP的发病原因与机体代谢异常、基因多态性、微循环障碍等因素密切相关[3-4]。治疗主要以抑制骨吸收、促进骨形成为原则,目前常用的治疗药物主要有双磷酸盐类、降钙素类、雌激素替代治疗、维生素D及钙类等,但是长期使用以上药物存在胃肠道不良反应、肝肾功能损害、心血管疾病及子宫内膜癌风险增加、肾结石等不良反应[5-6]。因此急需寻求一种疗效显著、不良反应少、可以长期使用的预防与治疗OP的药物,中医药具有独特的优势。
中医并没有OP的病名,多将其归属于“骨痹”“骨萎”等范畴。中医理论认为肾主骨生髓,肾虚,肾精不足,骨髓失养,终成萎痹,治疗当以“填精益髓,补肾壮骨”为原则[7]。金匮肾气丸出自《金匮要略》,是温补肾精的经典方剂,在治疗OP等疾病方面具有显著的临床疗效。研究发现,金匮肾气丸能提高血清雌激素水平,改善骨密度与成骨细胞功能,促进成骨细胞的增殖、分化,减轻OP患者疼痛症状等[8]。目前,金匮肾气丸治疗OP的主要活性成分及具体作用机制未见系统的描述。网络药理学是一门新兴学科,是基于分子层面,通过数据可视化分析,构建药物-有效成分-疾病-靶点网络来预测药物治疗疾病的作用机制,弥补了“单成分、单靶点、单药物、单疾病”研究模式的不足。因此,本研究采用网络药理学的方法预测金匮肾气丸治疗骨质疏松的有效成分、作用靶点、关键通路,并解释其作用机制。
1 资料与方法
1.1 “金匮肾气丸”药物化学成分及其相关靶点的搜集 采用中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)、中药分子机制综合数据库(Traditional Chinese Medicine Integrated Database,TCMID)、中药分子机制生物信息学分析工具(A Bioinformatics Analysis Tool for Molecular Mechanism of Traditional Chinese Medicine,BATMAN-TCM)检索金匮肾气丸组成药物活性化学成分,以口服生物利用度(Oral Bioavailability,OB)≥30%、类药性(Drug Like,DL)≥0.18为标准对所有活性成分进行筛选,并搜集有效化学成分相关靶点。
1.2 “骨质疏松症”疾病靶点的搜集 通过人类基因数据库(GeneCards)、在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM)、DrugBank数据库,以“Osteoporosis”为关键词搜集骨质疏松症的疾病靶点。删除重复的靶点,导入UniProt数据库进行标准化处理。
1.3 药物-疾病交集靶点、韦恩图及活性成分-作用靶点的构建 将“金匮肾气丸”有效成分相关靶点及“骨质疏松症”疾病靶点导入Venny 2.1.0在线作图工具获得药物-疾病交集靶点及其韦恩图并将其交集靶点、有效成分导入Cytoscape 3.6.1软件,对药物有效成分相关靶点-疾病相关靶点进行映射,构建活性成分-作用靶點网络图。活性成分、作用靶点用“节点”表示,节点之间的相互关系用“边”表示。
1.4 蛋白质-蛋白质相互作用网络的构建 将药物-疾病的交集靶点导入STRING软件中(https://string-db.org),选择置信度score≥0.700,隐藏游离的节点。下载TSV数据文件,导入Cytoscape 3.6.1软件进行数据可视化分析,使用CytoHubba插件的MCC算法找出蛋白质-蛋白质相互作用(Protein Protein Interaction,PPI)网络的核心基因。
1.5 富集分析
采用DAVID(https://david.ncifcrf.gov/)数据库对药物、疾病的交集靶点进行基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,设定标准为P值小于0.05,使用imageGP作图软件对P-value值最小的GO生物功能前20条及KEGG信号通路前30条结果制作气泡图进行可视化分析。
2 结果
2.1 “金匮肾气丸”药物化学成分及其相关靶点 通过TCMSP、TCMID、BATMAN-TCM共3个数据库结合相关文献检索,共获得金匮肾气丸药物化学成分118个,其中茯苓15个,附子21个,桂枝7个,牡丹皮11个,山药16个,山茱萸20个,熟地黄2个,泽泻26个;共获取相关靶点569个,删除重复的靶点,最终获得金匮肾气丸组成药物化学成分相关靶点202个。
2.2 “骨质疏松症”疾病靶点搜索结果 通过GeneCards、OMIM、DrugBank等数据库并结合相关文献,获得疾病靶点4 305个,其中GeneCards数据库4 273个,OMIM、DrugBank数据库共32个,取GeneCards数据库Relevance score分数≥中位数1.87的靶点共2 751个,删除3个数据库重复的靶点,最终获得骨质疏松症疾病靶点1 856个。
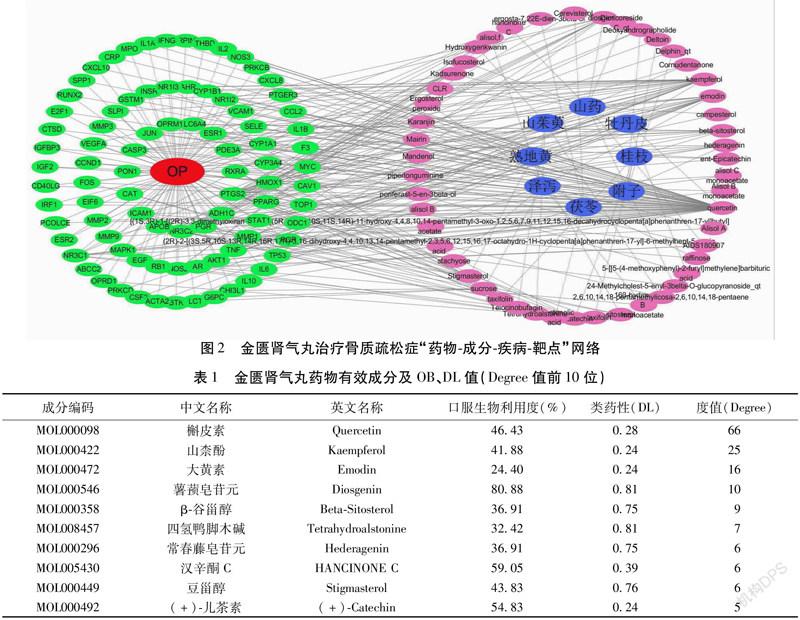
2.3 药物-疾病交集靶点、韦恩图及药物-成分-疾病-靶点网络 将金匮肾气丸药物成分相关靶点、骨质疏松症疾病相关靶点导入Venny 2.1.0在线作图工具,共获得盐皮质激素受体(Mineralocorticoid Receptor,NR3C2)、黄体酮受体(Progesterone Receptor,PGR)、前列腺素内过氧化物合酶2(Prostaglandin-Endoperoxide Synthase 2,PTGS2)、视黄酸受体(Reti-noic Acid Receptor RXR-Alpha,RXRA)等87个交集靶点及韦恩图。见图1。将药物-疾病交集靶点与药物有效成分相互作用关系及属性文件导入Cytoscape 3.6.1软件并进行映射,构建药物-成分-疾病-靶点网络图。根据Cytoscape软件NetworkAnalyzer分析工具算出有效成分Degree值,Degree值越大表示节点的重要性越大。见图2。药物有效成分Degree值位于前5位的分别为槲皮素(Quercetin)为66,山柰酚(Kaempferol)为25,大黄素(Emodin)为16,薯蓣皂苷元(Diosgenin)为10,Β-谷甾醇(Beta-Sitosterol)为9。见表1。
2.4 PPI网络结果
将药物-疾病的87个交集靶点导入STRING软件中,择置信度Score≥0.700,下载TSV数据文件,导入Cytoscape 3.6.1软件,共得到87个节点,634条边,平均节点度值为14.6,使用cytoHubba插件的MCC算法找出PPI网络的核心基因,PTGS2、JUN、ICAM1、IL1B、MMP9等基因为PPI网络核心基因。见图3、图4。
2.5 金匮肾气丸治疗骨质疏松症作用靶点GO生物功能富集分析结果 采用DAVID数据库对金匮肾气丸治疗骨质疏松症作用靶点进行GO生物功能富集分析,共获得P值小于0.05的GO功能条目376条,其中生物过程(Biological Process,BP)290条,细胞组分(Cellular Component,CC)28条,分子功能(Molecular Function,MF)58条。生物过程主要富集在转录的正调控,DNA模板化、对药物的反应、RNA聚合酶Ⅱ啟动子的转录正调控、基因表达的正调控、一氧化氮生物合成过程的正向调控等;细胞组分主要富集在细胞外间隙、胞外区、膜筏、质膜小凹、核染色质等;分子功能主要富集在酶结合、类固醇激素受体活性、类固醇结合、RNA聚合酶Ⅱ转录因子活性,配体激活序列特异性DNA结合、细胞因子活性等。见图5~7。
2.6 金匮肾气丸治疗骨质疏松症作用靶点KEGG信号通路富集分析结果 通过DAVID数据库对金匮肾气丸治疗骨质疏松症作用靶点进行KEGG信号通路富集分析,共获得P值小于0.05的KEGG信号通路90条,删除“Cancer”相关通路,根据P值对前30条信号通路绘制气泡图。结合相关文献发现类风湿性关节炎信号通路、破骨细胞分化信号通路、催乳激素信号通路、甲状腺激素信号通路、MAPK信号通路等信号通路是金匮肾气丸治疗骨质疏松症的关键通路。见图8。前10位信号通路富集细节。见表2。
3 讨论
骨质疏松症的病机为肾虚,肾精不足,骨髓失养。治疗当以“填精益髓,补肾壮骨”为原则。金匮肾气丸源自《金匮要略》,在治疗OP等疾病取得了较好的临床疗效。方中熟地黄滋阴补肾、填精益髓,桂枝、附子温补阳气,温阳化气共为君药;山茱萸补肾壮骨、固肾涩精,山药健脾益气,滋阴助阳共为臣药;茯苓、泽泻、牡丹皮清热养阴、健脾化湿、补而不壅。诸药配伍,共奏填精益髓、强筋健骨、阴阳双补之功效。本研究通过网络药理学的研究方法,共获得金匮肾气丸药物活性成分118个,通过数据可视化分析获悉槲皮素、山柰酚、大黄素、薯蓣皂苷元、β-谷甾醇等成分可能是金匮肾气丸治疗OP的关键药物成分。
研究发现,槲皮素可以抑制破骨细胞增殖、提高成骨细胞分化活性、增加血清骨矿含量、改善骨代谢、维持机体骨吸收和骨形成的动态平衡[9]。槲皮素作为一种抗氧化的药物化学成分,可以延缓细胞衰老导致的骨丢失,能够有效清除衰老的人骨髓间充质干细胞(Human Bone Marrow Mesenchymal Stem Cells,hMSCs),并能调控雌激素受体介导的信号通路,促进hMSCs的增殖、成骨分化,改善骨组织结构及功能[10-12];此外槲皮素还具有免疫调节及促进机体对钙的吸收等作用,通过降低骨组织氧化应激参数,提高骨组织抗感染能力,增强维生素D受体活性,促进小肠对钙的吸收,调节钙稳态基因的表达[13]。Sharma等[14]证实山柰酚具有提高成骨参数,促进成骨分化的作用,其机制是通过雌激素信号通路和对SaOS-2细胞的刺激反应激活WNT信号通路,提高WNT靶向成骨基因表达,提高碱性磷酸酶(Alkaline Phosphatase,ALP)、成骨蛋白、骨涎蛋白、骨桥蛋白等蛋白的mRNA的表达水平,促进其增值,提高成骨参数,促进成骨分化。Wong等[15]研究表明,山柰酚能有效地调节成骨细胞与破骨细胞的自噬作用,可以明显地减轻氧化应激所致的骨损伤及骨流失,维持了骨吸收与骨代谢之间的动态平衡,并通过抑制促凋亡基因相关蛋白的表达,上调抗凋亡基因的表达水平,具有促进成骨的作用。炎症是骨质流失的重要原因,肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、白细胞介素-1(Interleukin-1,IL-1)等炎症介质不仅会直接促进破骨细胞的增殖和骨吸收作用的增强,而且通过正反馈作用促进骨吸收细胞因子(例如IL-6、MCP-1)的产生,进一步加剧了骨流失[16]。山柰酚通过调控核因子κB信号通路的激活,降低TNF-α、IL-1等炎症介质的产生,增强了抗炎细胞因子(例如IL-10)的表达,并且通过对MAPK机制的抑制,可以逆转白细胞介素-1β(Interleukin-1 Beta,IL-1β)介导的骨损伤[17]。Zhao等[18]通过动物实验发现薯蓣皂苷元通过提高机体雌二醇水平,抑制骨高周转率,可以减少骨量丢失,减缓OP的发生、发展,对OP具有预防作用。骨保护素(Osteoprotegerin,OPG)和核因子κB配体的受体激动剂(例如RANKL)在破骨细胞形成过程中起重要作用,二者之间的比值是评估破骨细胞刺激度的重要指标[19]。Zhang等[20]发现,通过薯蓣皂苷元治疗的大鼠胫骨中RANKL的水平较治疗前降低,而OPG的水平明显升高,二者之间的比值显著下降,从而降低了对破骨细胞的刺激度,减少了骨吸收,对骨组织具有明显的保护作用。雌激素对全身骨代谢具有重要的调节作用,是维持骨代谢动态平衡的重要物质,是临床上治疗OP的重要药物,β-谷甾醇是具有雌激素活性的植物雌激素类物质。研究表明,卵巢颗粒细胞是成骨细胞的重要作用靶点,β-谷甾醇可以诱导卵巢颗粒细胞分泌雌二醇E2,使其与成骨细胞膜上雌激素受体ER结合,促进成骨,改善骨代谢[21]。此外,β-谷甾醇还可以抑制过氧化物酶、TNF-ɑ、IL-1β等炎症介质的活性,通过其抗炎作用,减轻炎症介质导致的骨损伤[22]。TNF-α与RANKL具有协同作用刺激破骨细胞的形成,研究发现,大黄素可以抑制TNF-α的表达,通过其抗炎作用减少破骨细胞的形成,减少骨质流失[23]。动物实验表明,大黄素能够显著提高大鼠成骨细胞成活率,改善骨小梁微结构和骨骼力学性能,抑制血清骨钙素的升高,增强MC3T3-E1细胞的分化和矿化,具有促进成骨及骨保护作用[24]。
通过药物-疾病作用靶点富集分析结合相关文献发现金匮肾气丸治疗OP的关键靶点基因为PTGS2、JUN、ICAM1、IL1B、MMP9等。前列腺素内环氧化合物合成酶2(Prostaglandin-Endoperoxide Synthase 2,PTGS2)是前列腺素合成的限速酶,对机体的骨代谢具有双向调节作用,一方面介导了骨髓间充质干细胞分化为成骨细胞及破骨细胞成熟过程,通过抑制PTGS2的表达可以减少OP患者的骨破坏及炎症反应;另一方面通过抑制前列腺素的产生,减少了前列腺素诱导的巨噬细胞集落刺激因子(Macrophage Colony Stimulating Factor,M-CSF)及破骨细胞分化因子(Receptor Activator Ofnuclear Factor Kappa-B Ligand,RANKL)的产生,减缓破骨细胞分化及骨吸收作用[25-26]。JUN属于AP-1转录因子家族,是JAK-STAT信号通路上的快速反应基因,具有促进成骨细胞增殖、分化的作用[27];此外,Lerbs等[28]通过动物模型发现,JUN通过上调骨祖细胞相关基因(例如Shh、Sufu)的表达,诱导骨祖细胞增殖、分化,可以补偿骨缺损部位的骨量减少并促进其骨钙化组织形成,加速骨折愈合。细胞间黏附分子1(Intercellular Adhesion Molecule 1,ICAM1)基因具有多态性,是绝经后妇女患OP的易感基因[29]。研究发现,ICAM1是破骨细胞分化的重要调控蛋白,对破骨细胞的分化成熟及功能具有重要的调节作用,其介导的黏附作用是破骨细胞分化成熟的关键条件[30];此外,ICAM1也介导了炎症细胞因子向局部病灶位置的黏附和运动[31]。IL-1β对破骨细胞及成骨细胞的活性具有重要的影响,通过对IL-1β的抑制,可以降低机体的骨转换;此外IL-1β对骨微血管的数量及其长度也具有深刻的影响,当IL-1β被抑制时骨组织中微血管的数量及长度均降低[32]。基质金属蛋白酶9(Matrix Metallopeptidase 9,MMP9)主要由破骨细胞在体内选择性表達,通过转运到切割组蛋白HSK18-Q19核室,促进破骨细胞基因的活化,介导了破骨细胞的骨吸收及Ⅰ型胶原的溶解作用,因此,使用siRNA靶向抑制MMP9可以减少骨吸收,具有骨保护作用[33]。
通过对金匮肾气丸治疗OP的作用靶点,进行KEGG富集分析并结合相关文献发现类风湿性关节炎信号通路、破骨细胞分化信号通路、催乳激素信号通路、甲状腺激素信号通路、MAPK信号通路等信号通路是金匮肾气丸治疗骨质疏松症的关键通路。类风湿性关节炎(Rheumatoid Arthritis,RA)在OP的发生、发展过程中具有重要的影响,是RA患者主要的关节外并发症之一,其机制是活动性RA导致机体炎性破骨细胞骨吸收增强导致RA患者局部骨破坏(骨侵蚀)及全身性骨丢失,因此通过控制RA患者炎症反应,可以减少骨质流失并降低骨折风险[34]。铁调素是机体铁代谢和体内稳态的主要调节剂,受炎症介质(例如IL-1、IL-6、TNF)的调节。在最新的RA患者血清铁调素水平与骨质疏松程度相关性的研究中发现,RA处于活动期时由于炎症介质的表达,铁调素产生增加,铁蛋白水平升高,是绝经期妇女和中年男性进行性骨丢失的危险因素,因此,铁调素有望成分OP治疗的新靶点[35]。催乳激素(Prolactin,PRL)信号通路对全身骨代谢具有重要的调控作用。研究发现,PRL通过经典的STAT3信号通路可以减缓关节炎性症状,抑制关节血管翳形成及骨破坏,增加小梁面积,降低破骨细胞相关基因mRNA水平,下调Cyt诱导的破骨细胞分化,具有骨保护作用[36]。甲状腺激素是人体生长发育的重要激素,在骨骼的代谢过程中有着十分重要的作用。甲亢患者甲状腺功能代谢的紊乱,会引起骨代谢障碍及骨量的减少,最终导致OP[37]。研究发现,T3激活甲状腺激素受体ɑ(Thyroid Hormone Receptor ɑ,TRɑ),后者在骨骼中呈高表达,在骨骼及软骨中介导T3通过破骨细胞活性激活剂白细胞介素-6(Interleukin-6,IL-6)直接参与了破骨细胞的骨吸收[38]。丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)信号通路是细胞内重要的信号转导通路,介导了细胞的增殖、分化等过程,对成骨细胞及破骨细胞增殖、分化具有调控作用。研究发现,MAPK信号通路参与了MSCs的成骨分化和迁移,并介导了成骨细胞增殖与抗凋亡,激活p38/MAPK可以提高成骨细胞的增殖、分化,促进成骨,增加骨量[39-40]。
综上所述,金匮肾气丸治疗OP主要是通过槲皮素、山柰酚、大黄素、薯蓣皂苷元、β-谷甾醇等活性成分作用于PTGS2、JUN、ICAM1、IL1B、MMP9等关键靶点基因通过抗氧化、抑制炎症反应、促进成骨细胞增殖分化、抑制破骨细胞骨吸收等作用机制最终达到治疗OP的作用。但是,此次研究尚存在不足之处,需要后期进一步实验验证。
参考文献
[1]Wang C,Meng H,Wang X,et al.Differentiation of Bone Marrow Mesenchymal Stem Cells in Osteoblasts and Adipocytes and its Role in Treatment of Osteoporosis[J].Med Sci Monit,2016,21(22):226-233.
[2]李冲,吕伟华,王亭亭,等.1088例医务人员骨质疏松的流行病学研究[J].中国骨质疏松杂志,2015,21(10):1217-1220.
[3]Yin X,Zhou C,Li J,et al.Autophagy in bone homeostasis and the onset of osteoporosis[J].Bone Res,2019,3(7):28-43.
[4]Shah SK,Taufiq I,Najjad MK,et al.Vitamin D deficiency and possible link with Bony pain and onset of Osteoporosis[J].J Pak Med Assoc,2014,64(12 Suppl 2):S100-103.
[5]中華医学会,中华医学会杂志社,中华医学会全科医学分会,等.原发性骨质疏松症基层诊疗指南(2019年)[J].中华全科医师杂志,2020,19(4):304-315.
[6]元唯安.中药新药研发关键问题思考——以骨质疏松症为例[J].中国新药杂志,2020,29(16):1836-1840.
[7]中华中医药学会.绝经后骨质疏松症(骨痿)中医药诊疗指南(2019年版)[J].中医正骨,2020,32(2):1-13.
[8]安玉兰,曹昌霞,田玉梅,等.金匮肾气丸合补中益气汤加减治疗绝经后骨质疏松症的疗效及对免疫炎症因子的调节作用[J].中国实验方剂学杂志,2021,27(6):69-75.
[9]Hayashi T,Ina K,Maeda M,et al.The effects of selective estrogen receptor modulator treatment following hormone replacement therapy on elderly postmenopausal women with osteoporosis[J].Nitric Oxide,2011,24(4):199-203.
[10]Farr JN,Xu M,Weivoda MM,et al.Targeting cellular senescence prevents age-related bone loss in mice[J].Nat Med,2017,23(9):1072-1079.
[11]Yuan Z,Min J,Zhao Y,et al.Quercetin rescued TNF-alpha-induced impairments in bone marrow-derived mesenchymal stem cell osteogenesis and improved osteoporosis in rats[J].Am J Transl Res,2018,10(12):4313-4321.
[12]Pang XG,Cong Y,Bao NR,et al.Quercetin Stimulates Bone Marrow Mesenchymal Stem Cell Differentiation through an Estrogen Receptor-Mediated Pathway[J].Biomed Res Int,2018,2018:4178021.
[13]Nada Orsolic,Zeljko Jelec,Johann Nemrava,et al.Effect of Quercetin on Bone Mineral Status and Markers of Bone Turnover in Retinoic Acid-Induced Osteoporosis[J].Polish Journal of Food and Nutrition Sciences,2018,68(2):149-162.
[14]Sharma AR,Nam JS.Kaempferol stimulates WNT/β-catenin signaling pathway to induce differentiation of osteoblasts[J].J Nutr Biochem,2019,74:108228.
[15]Wong SK,Chin KY,Ima-Nirwana S.The Osteoprotective Effects Of Kaempferol:The Evidence From In Vivo And In Vitro Studies[J].Drug Des Devel Ther,2019,13:3497-3514.
[16]Seong S,Kim JH,Kim N.Pro-inflammatory cytokines modulating osteoclast differentiation and function[J].J Rheum Dis,2016,23:148-153.
[17]Pang JL,Ricupero DA,Huang S,et al.Differential activity of kaempferol and quercetin in attenuating tumor necrosis factor receptor family signaling in bone cells[J].Biochem Pharmacol,2006,71(6):818-26.
[18]Zhao S,Niu F,Xu CY,et al.Diosgenin prevents bone loss on retinoic acid-induced osteoporosis in rats[J].Ir J Med Sci,2016,185(3):581-587.
[19]Tanaka H,Mine T,Ogasa H,et al.Expression of RANKL/OPG during bone remodeling in vivo[J].Biochem Biophys Res Commun,2011,411(4):690-4.
[20]Zhang Z,Song C,Fu X,et al.High-dose diosgenin reduces bone loss in ovariectomized rats via attenuation of the RANKL/OPG ratio[J].Int J Mol Sci,2014,15(9):17130-47.
[21]曾莉萍,徐贤柱,饶华,等.杜仲叶β-谷甾醇对成骨细胞和卵巢颗粒细胞的影响[J].时珍国医国药,2012,23(5):1051-1053.
[22]Liz R,Zanatta L,dos Reis GO,et al.Acute effect of β-sitosterol on calcium uptake mediates anti-inflammatory effect in murine activated neutrophils[J].J Pharm Pharmacol,2013,65(1):115-22.
[23]Luo JS,Zhao X,Yang Y.Effects of emodin on inflammatory bowel disease-related osteoporosis[J].Biosci Rep,2020,40(1):BSR20192317.
[24]Chen X,Zhang S,Chen X,et al.Emodin promotes the osteogenesis of MC3T3-E1 cells via BMP-9/Smad pathway and exerts a preventive effect in ovariectomized rats[J].Acta Biochim Biophys Sin(Shanghai),2017,49(10):867-878.
[25]Liu WJ,Jiang ZM,Chen Y,et al.Network pharmacology approach to elucidate possible action mechanisms of Sinomenii Caulis for treating osteoporosis[J].J Ethnopharmacol,2020,257:112871.
[26]Wong RW,Rabie AB.Effect of quercetin on bone formation[J].J Orthop Res,2008,26(8):1061-6.
[27]謝丽华,陈娟,李生强,等.六味地黄丸对绝经后骨质疏松症肾阴虚证JAK/STAT信号通路基因的影响[J].中国骨质疏松杂志,2014,20(7):741-746.
[28]Lerbs T,Cui L,Muscat C,et al.Expansion of Bone Precursors through Jun as a Novel Treatment for Osteoporosis-Associated Fractures[J].Stem Cell Reports,2020,14(4):603-613.
[29]Yamada Y,Ando F,Shimokata H.Association of candidate gene polymorphisms with bone mineral density in community-dwelling Japanese women and men[J].Int J Mol Med,2007,19(5):791-801.
[30]王军,赵志河,罗颂椒,等.骨髓间充质干细胞骨向诱导分化过程中破骨细胞分化因子和细胞间粘附分子-1的表达变化[J].华西口腔医学杂志,2005,23(3):240-243.
[31]Wang L,Li XH,Ning WC.Evaluation of ICAM-1 and VCAM-1 Gene Polymorphisms in Patients with Periodontal Disease[J].Med Sci Monit,2016,22:2386-91.
[32]Tulotta C,Lefley DV,Freeman K,et al.Endogenous Production of IL1B by Breast Cancer Cells Drives Metastasis and Colonization of the Bone Microenvironment[J].Clin Cancer Res,2019,25(9):2769-2782.
[33]Zhu L,Tang Y,Li XY,et al.Osteoclast-mediated bone resorption is controlled by a compensatory network of secreted and membrane-tethered metalloproteinases[J].Sci Transl Med,2020,12(529).
[34]Raterman HG,Bultink IE,Lems WF.Osteoporosis in patients with rheumatoid arthritis:an update in epidemiology,pathogenesis,and fracture prevention[J].Expert Opin Pharmacother,2020,21(14):1725-1737.
[35]Sato H,Takai C,Kazama JJ,et al.Serum hepcidin level,iron metabolism and osteoporosis in patients with rheumatoid arthritis[J].Sci Rep,2020,10(1):9882.
[36]Ledesma-Colunga MG,Adán N,Ortiz G,et al.Prolactin blocks the expression of receptor activator of nuclear factor κB ligand and reduces osteoclastogenesis and bone loss in murine inflammatory arthritis[J].Arthritis Res Ther,2017,19(1):93.
[37]Yin WL,You XY.Vitamin D receptor gene polymorphism in hyperthyroidism patients with osteoporosis[J].Chin J Exp Surg,2017,34(8):1414-1415.
[38]Delitala AP,Scuteri A,Doria C.Thyroid Hormone Diseases and Osteoporosis[J].J Clin Med,2020,9(4):1034-1051.
[39]Jiang K,Teng GD,Chen YQ.MicroRNA-23 suppresses osteogenic differentiation of human bone marrow mesenchymal stem cells by targeting the MEF2C-mediated MAPK signaling pathway[J].J Gene Med,2020,22(10):e3216.
[40]Yu H,Jiang L,Wan B,et al.The role of aryl hydrocarbon receptor in bone remodeling[J].Prog Biophys Mol Biol,2018,134:44-49.
(2020-11-13收稿 责任编辑:魏庆双)
