发酵型青腐乳菌群结构与风味物质及其相关性分析
2020-12-13张雅婷于寒松朱先明朱世杰周树辉任大勇
孙 娜,张雅婷,于寒松,朱先明,朱世杰,周树辉,任大勇,
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.长春市朱老六食品股份有限公司,吉林 长春 130500)
青腐乳是我国传统腐乳中风味最为独特的一种,因其“闻着臭、吃着香”被部分人所喜爱[1-2]。根据工艺不同青腐乳可分为非发酵型和发酵型两种。南方青腐乳属于非发酵型,采用浏阳黑豆豉、香菇、苋菜等长期发酵制成的卤水浸泡后形成,油炸即可食用。发酵型青腐乳以北方为代表,经严格的前发酵和长时间的后发酵形成[3]。青腐乳营养价值高,VB12、游离氨基酸及铁、锌、钙等矿物质含量丰富,利于人体肠道的吸收[4]。
青腐乳的制作由于工艺和地域的不同,卤水差异较大,导致青腐乳的风味差别很大。影响风味的因素有很多,其中微生物[5-7]对其影响最大。而挥发性风味物质[8]也是青腐乳重要的质量参数,对产品整体风味起着重要作用。因此研究青腐乳中微生物多样性和菌群构成与其风味之间的关系具有重要意义。目前对青腐乳中微生物的多样性研究,主要是采用传统的分离培养方法。但基于传统的方法在研究复杂的微生物菌群时,无法检测出所有微生物,导致低估了菌群数量和多样性[9-11]。相比之下,高通量测序技术具有较为明显的优势,不仅能检测出优势微生物,对于低丰度微生物也能检出,能够全面准确地揭示环境中微生物的多样性[12-13]。高通量技术已被广泛应用[14-15]于发酵食品中,如发酵豆腐[16-18]、发酵酒精饮料[19-20]、发酵蔬菜[21]和发酵乳[22]等。到目前为止,对青腐乳中微生物资源及卤水中挥发性成分分析并进行对比的研究报道较少。
本研究通过高通量测序技术对青腐乳中的微生物信息进行比较,采用固相微萃取方法对其中的挥发性成分进行提取,并结合气相色谱-质谱联用方法进行分析,以探讨微生物与青腐乳风味成分的关系,有利于深入了解青腐乳中细菌和挥发性成分的组成,进而改进青腐乳的制作工艺,提高产品风味质量及稳定性。
1 材料与方法
1.1 材料
发酵前期青腐乳和发酵末期青腐乳均来自长春市朱老六食品股份有限公司,发酵前期青腐乳为刚加卤水发酵时的样品作为对照实验,发酵末期青腐乳为发酵6 个月的可售青腐乳。
1.2 仪器与设备
T100梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;Ion S5TMXL高通量测序分析仪 美国Thermo Fisher公司;QP 2010气相色谱-质谱联用仪 日本岛津公司;DVB/CAR/PDMS固相微萃取装置 美国Supelco公司。
1.3 方法
1.3.1 基因组DNA提取和PCR扩增
采用十二烷基硫酸钠方法对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng/μL。以稀释后的基因组DNA为模板,选择通用引物515F(5’-GTGCCAGCMGCCGCGG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)扩增DNA中V3、V4区域。使用带Barcode的特异引物,New England Biolabs公司的Phusion®High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR,确保扩增效率和准确性[23]。
1.3.2 PCR产物的混样和纯化
PCR产物使用2%的琼脂糖凝胶进行电泳检测;根据PCR产物浓度等量混合样品,充分混匀后使用2%的琼脂糖胶电泳纯化PCR产物,剪切回收目标条带[24]。
1.3.3 文库构建和上机测序
使用Thermo Fisher公司的Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测合格后,使用Thermo Fisher公司的Ion S5TMXL进行上机测序。建库、上机测序以及数据分析由北京诺禾致源科技股份有限公司完成。
1.3.4 固相微萃取
取10 mL青腐乳卤水置于20 mL的顶空样品瓶中,盖上密封垫和铝帽,密封后在80 ℃条件下磁力搅拌加热平衡12 min,搅拌速率500 r/min,通过隔垫插入已活化好的固相微萃取萃取头,推出纤维头,顶空吸附40 min,在拔出萃取头前抽回纤维头,再将萃取头插入气相色谱进样口,并推出纤维头,在250 ℃条件下解吸5 min。
1.3.5 气相色谱-质谱条件
Agilent色谱柱DB-5 MS(30 m×0.25 mm,0.25 μm),分流比10∶1,载气为高纯氦气,流速1 mL/min。升温程序:40 ℃保持2 min,以10 ℃/min升至300 ℃保持3 min。离子源温度200 ℃,接口温度260 ℃,扫描m/z33~500[25]。
1.4 数据统计
高通量测序结果采用可分类操作单元(operational taxonomic unit,OTU)聚类整合分析;气相色谱-质谱检测得到离子色谱图,通过计算机谱库检索,去除相似度低于90%组分,确定青腐乳挥发性风味物质成分。
2 结果与分析
2.1 青腐乳中微生物物种多样性曲线
稀释曲线可用说明检测样品的测序数据量是否足以反映环境中的微生物多样性,也可用来比较不同样品中的微生物多样性情况。从图1A可以看出,发酵末期青腐乳和发酵前期青腐乳的曲线趋于平坦,说明测序数据足以覆盖所有的微生物,表明了样品中微生物的多样性。
通过图1B的Rank-Abundance曲线能够更清晰地反映出发酵前期与发酵末期青腐乳中微生物丰度和分布均匀程度,曲线的形状反映物种组成的均匀程度,两条曲线形状相似,说明发酵末期青腐乳和发酵前期青腐乳中物种组成均匀程度相近;用曲线在横轴上的长度反映物种的丰富程度,由图1B可知,发酵前期青腐乳的曲线比发酵末期青腐乳的曲线宽,说明发酵前期青腐乳中的微生物组成比发酵末期青腐乳更丰富,物种多样性存在明显差异。
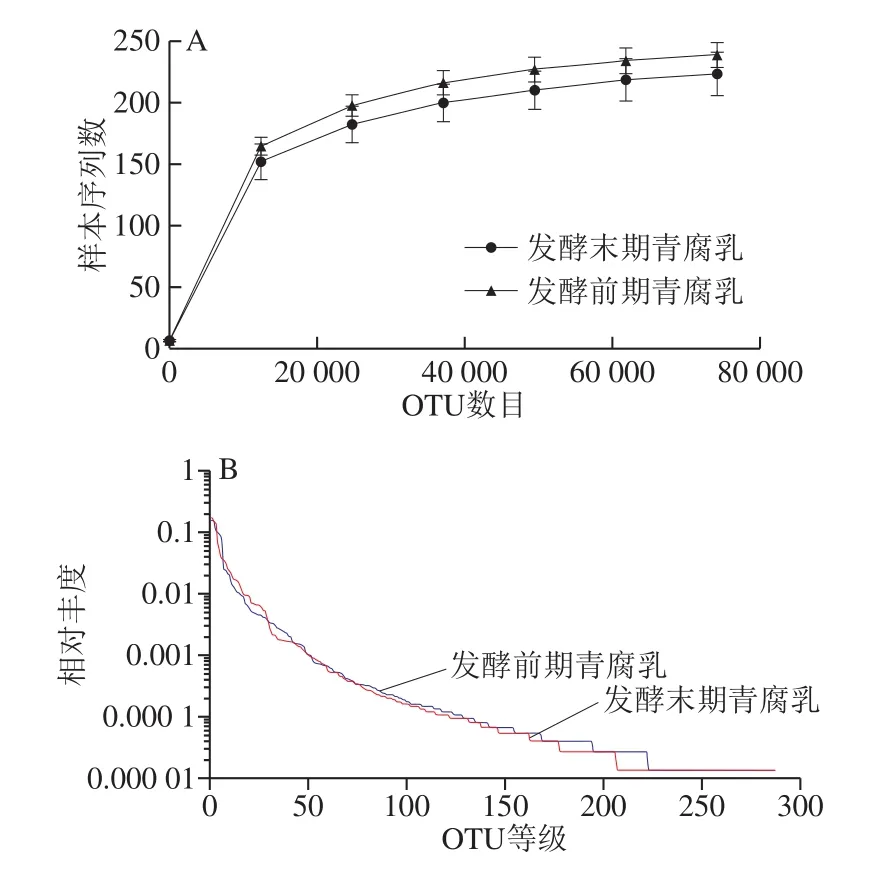
图1 稀释度曲线(A)和Rank-Abundance曲线(B)Fig. 1 Rarefaction curves (A) and Rank-Abundance curves (B)
2.2 青腐乳OTU分布Venn图
Venn图可以直观地表现出样品独有和共有的OTU数目,以及样本的OTU数目组成相似性和重叠情况。由图2可知,发酵前期与发酵末期青腐乳中OTU的重叠数目为259,占总OTU的76.17%;发酵末期青腐乳与发酵前期青腐乳独有的OTU数目分别为29和52,说明两个样品间微生物存在一定的差异。发酵末期青腐乳和发酵前期青腐乳共有的物种数占总数的比例较高,而发酵前期青腐乳和发酵末期青腐乳的风味差距较大,可推断共有的物种数对青腐乳风味不起主要作用,而单独的物种才是影响青腐乳风味的关键。
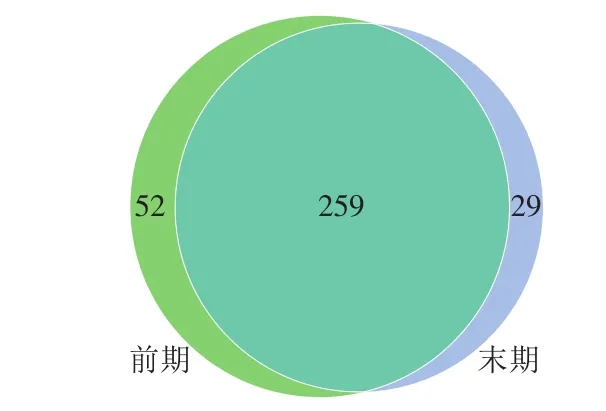
图2 青腐乳样品OTU分布Venn图Fig. 2 Venn diagram of OTU distribution in fermented stinky tofu samples
2.3 青腐乳中微生物在属水平的分类比较

图3 青腐乳样品在属水平的细菌相对丰度Fig. 3 Bacterial abundance of fermented stinky tofu samples at the genus level
由图3A可知,在发酵末期青腐乳中分列前3 位的属为Lactobacillus、Chishuiella、Tetragenococcus,所占比例分别为23.44%、21.45%、16.28%。而发酵前期青腐乳中Lactobacillus的比例为19.5%,所占比例最高。其次为Chishuiella和短稳杆菌属(Empedobacter),分别占18.12%和15.59%;发酵前期Tetragenococcus含量相对发酵末期青腐乳较低,在发酵前期青腐乳中位居第3的Empedobacter在发酵末期青腐乳中含量几乎为零。其他微生物菌属,如Leuconostoc、Halanaerobium在发酵前期青腐乳和发酵末期青腐乳中均有体现,但是在发酵末期青腐乳中所占比例显著高于发酵前期青腐乳,所占比例差异较大。通过图3B可知,发酵末期青腐乳相比,除Halanaerobium末期-3比末期-1、末期-2所占比例高,其他菌属含量接近。发酵前期青腐乳相比,Empedobacter在前期-3中最多,其他菌属含量相似,说明所测样品的菌属比较稳定。综合分析可推断,发酵前期与发酵末期青腐乳细菌差异显著,虽然Lactobacillus、Chishuiella、Tetragenococcus、Empedobacter所占比例较高,但都不是青腐乳风味的主要贡献者,而Leuconostoc与Halanaerobium为青腐乳独特风味提供了主要贡献。
2.4 青腐乳中菌群主成分分析
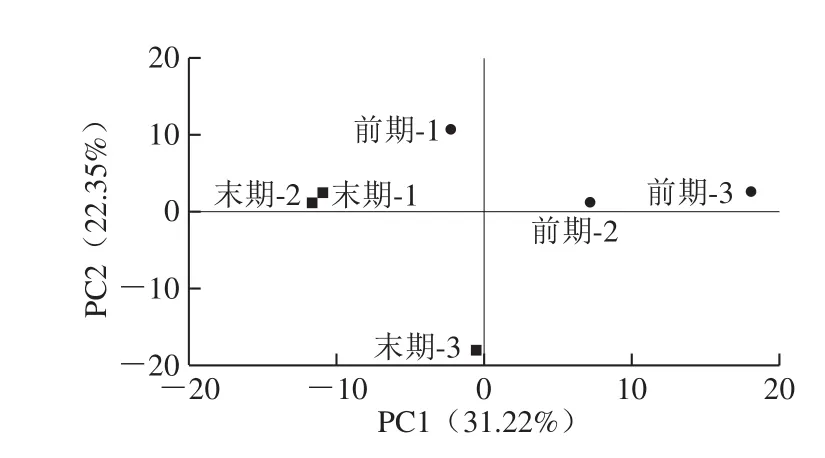
图4 青腐乳样品菌群结构的主成分分析Fig. 4 PCA analysis of bacterial community structure of fermented stinky tofu samples
由图4可以看出,发酵末期青腐乳末期-1与末期-2两点距离较近说明两样品相似度较高,而这两点与末期-3距离较远,菌群结构差异明显。发酵前期青腐乳前期-1、前期-2与前期-3三点呈现明显的分离状态且距离较远,可推断菌落结构差异比较大。发酵末期青腐乳与发酵前期青腐乳之间距离相对较远,表明发酵前期与发酵末期青腐乳之间的菌落结构有明显的差异。这些现象说明,在进行发酵的过程中发酵环境有所改变导致了青腐乳中微生物的情况差异显著。
2.5 各组样本距离矩阵热图分析
β多样性研究中,选用Weighted Unifrac距离和Unweighted Unifrac距离衡量2 个样本间的相异系数,其值越小,表示这2 个样本在物种多样性方面存在的差异越小。以Weighted Unifrac和Unweighted Unifrac距离绘制的热图结果见图5。发酵末期青腐乳末期-1、末期-2与末期-3之间的相异系数较小、发酵前期青腐乳前期-1、前期-2与前期-3之间相异系数也不大,说明微生物群落结构差异小,而发酵末期青腐乳与发酵前期青腐乳的各个相异系数较大,表明发酵前期与发酵末期青腐乳之间物种多样性的差异较大。
2.6 青腐乳卤水挥发性风味成分的气相色谱-质谱分离鉴定

图5 青腐乳样品的β多样性指数热图Fig. 5 Heat map for β-diversity index of fermented stinky tofu samples
将检测的青腐乳总离子流图中各峰一级质谱经计算机检索以及与NIST14标准普库相匹配,并与标准物质对照,结合保留时间和相关文献[26-29]进行鉴定,最终得到青腐乳香气组分的定性结果,利用峰面积归一化法得出不同化学成分的相对含量,结果见表1。

表1 青腐乳卤水中主要挥发性物质的相对含量Table 1 Relative contents of volatile components in fermented stinky tofu brine
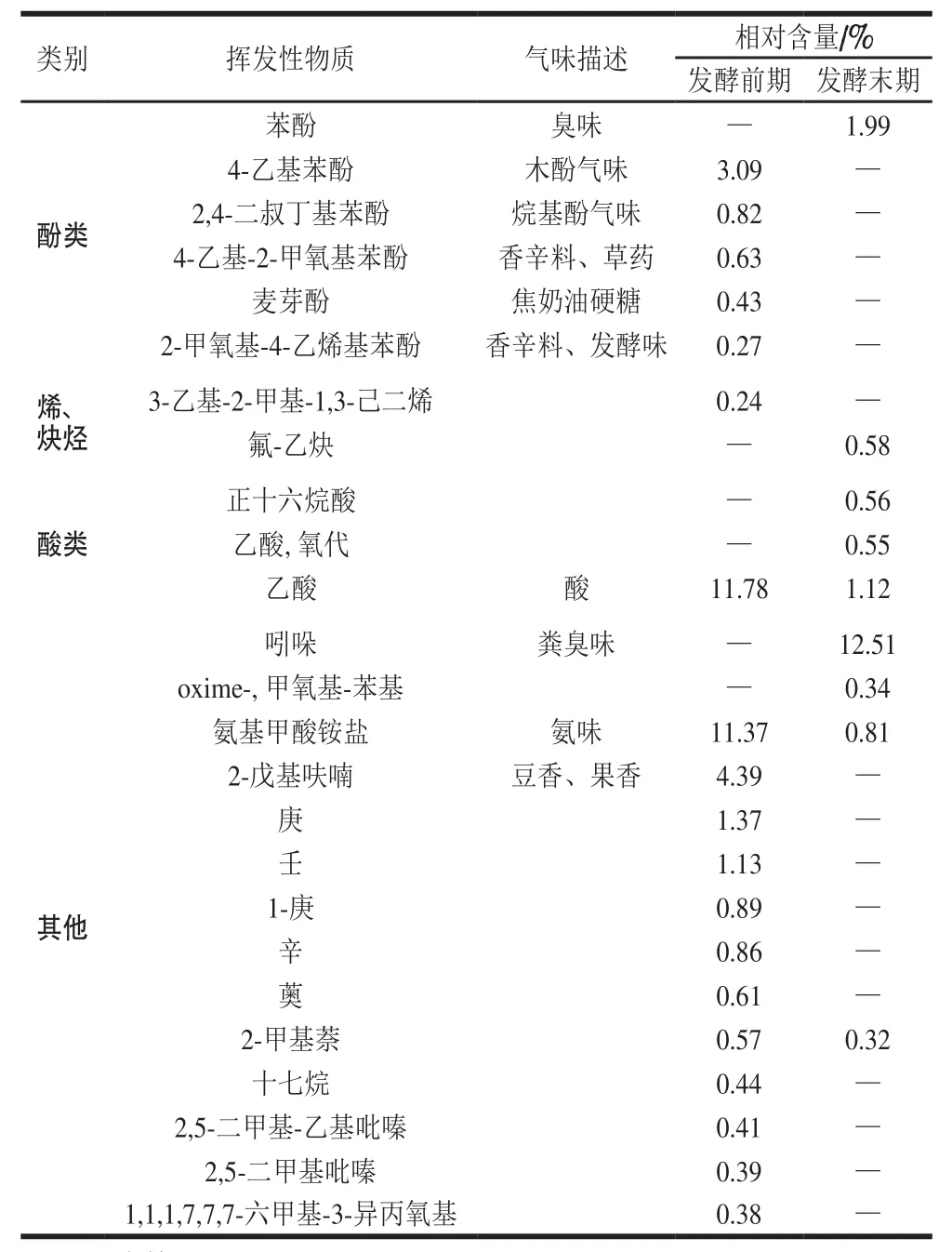
续表1
由表1可知,发酵末期青腐乳卤水中共鉴定出27 种挥发性物质,其中含硫化合物7 种,醇类3 种,酯类4 种,酸类3 种,烷烃类2 种,醛类3 种,酚类1 种,其他化合物4 种。发酵前期青腐乳卤水中共鉴定出45 种挥发性物质,其中醇类12 种,酯类1 种,酸类1 种,酮类6 种,醛类7 种,酚类5 种,烷烃类1 种,其他化合物12 种。郑小芬等[30]从湖南臭豆腐中共鉴定出38 种挥发性风味物质成分,主要以酯类化合物为主,但文献中鉴定出的挥发性物质成分与本研究在种类和数量上都存在较大差异,如文献中未鉴定出醛类物质而在本研究中鉴定出,这与青腐乳的制作工艺及产地的不同有很大关系。刘玉平等[31]从北京王致和臭豆腐中鉴定出31 种成分,其中鉴定出的正己醇、苯酚,也存在于本研究的青腐乳卤水中。马艳莉等[32]在青方腐乳中鉴定出25 种关键挥发性风味物质,认为对风味贡献最大的为苯酚、三甲基肼、吲哚、二甲基二硫醚、乙酸乙酯,为完善青腐乳的工业化生产及风味起到很大作用。本研究从发酵末期青腐乳卤水中鉴定出的成分中含硫化合物最多,发酵前期青腐乳卤水中醇类化合物最多,含硫化合物大多呈臭味,醇类化合物大多具有花香、水果香、酒香或干草香。
从发酵前期青腐乳和发酵末期青腐乳中鉴定出相同的挥发性物质成分有6 种,其中醛类物质2 种,分别为苯乙醛和3-甲基丁醛;酸类1 种,为乙酸;醇类1 种,为二甲基西拉二醇;其他化合物2 种,分别为氨基甲酸铵盐和2-甲基萘。其中,苯乙醛具有浓郁的风信子的香气,稀释后有水果的甜香,天然存在于鸡肉、西红柿、面包、玫瑰油、柑橘油。3-甲基丁醛具有苹果香气;乙酸具有食醋内酸味;氨基甲酸铵盐具有氨味。分析可知,这6 种相同的挥发性成分在发酵前期青腐乳卤水中的含量比在发酵末期青腐乳卤水中的都要高;尤其是苯乙醛、3-甲基丁醛、乙酸和氨基甲酸铵盐的含量高出很多,而二甲基西拉二醇和2-甲基萘在发酵前期和末期青腐乳卤水中的含量都比较低。这些物质都提供了青腐乳的香气,但并不包含特有的臭味,表明发酵前期与发酵末期青腐乳具有一定相同的风味物质成分,但这些物质成分不是青腐乳主要的风味物质成分,主要成分是发酵末期青腐乳鉴定出而发酵前期青腐乳未鉴定出的含硫化合物及吲哚,这些物质具有特有的臭味,青腐乳才会具有独特的令人喜爱的香气。

图6 青腐乳卤水中各类物质的相对含量Fig. 6 Relative contents of major classes of volatile compounds in fermented stinky tofu brine
由图6可知,发酵末期青腐乳卤水中的挥发性物质成分以含硫化合物、醇类和酯类为主,其中含硫化合物含量最高,主要为二甲基二硫化物、二甲基三硫化物和二甲基四硫化物,二甲基三硫化物和二甲基四硫化物相对含量高达20%,其次是吲哚。含硫化合物和吲哚的嗅觉阀值很低,在较低浓度时就能闻到臭味,浓度高时具有强烈的臭味,增强了青腐乳的特征香气。而发酵前期青腐乳的挥发性物质成分以醇类和酸类为主,主要呈花香、果香、酒香和酸味。除此之外,3-辛酮、2-戊基呋喃的含量也较高,3-辛酮具有水果的香气,2-戊基呋喃具有豆香和果香的气味。
2.7 青腐乳菌群结构与风味的相关性
由图7可知,Lactobacillus、Tetragenococcus和Chishuiella在发酵前期与发酵末期青腐乳中所占比例最高,与风味成分酯类、酮类、醇类相关性最大,这些物质呈现的大多为水果香气、花香、酒香,虽不是青腐乳独特风味的主要贡献者,却是青腐乳风味中必不可少的菌属和香气;Leuconostoc和Halanaerobium与含硫化合物、吲哚含量呈正相关,相关性最大且仅在发酵末期青腐乳卤水中出现,说明这两个菌属是提供风味的主要贡献者,这与前文推断相符。在发酵前期青腐乳中占有较高比例的Empedobacter与含硫化合物相关程度极低,不是臭味的来源。
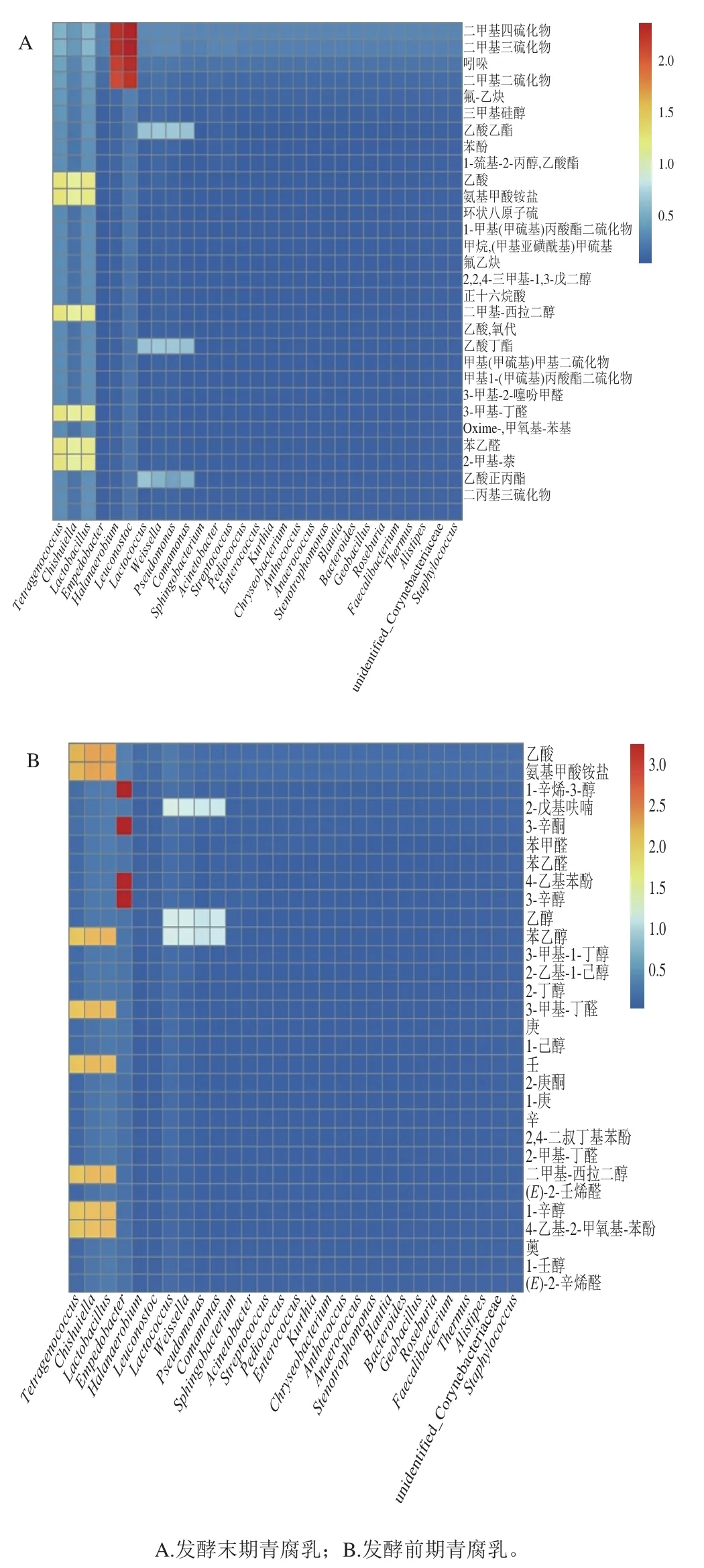
图7 青腐乳菌群结构与风味相关性热图Fig. 7 Heat map for correlation between bacterial community structure and flavor components of fermented stinky tofu
3 结 论
研究结果表明,发酵前期与发酵末期青腐乳卤水中微生物的相似度较低,差异显著。发酵前期与发酵末期青腐乳中含有相同且比例较高的属为Lactobacillus、Chishuiella;Leuconostoc和Halanaerobium差异尤为明显。Leuconostoc和Halanaerobium与二甲基三硫化物、吲哚等呈臭味挥发性成分相关性最大。Empedobacter与含硫化合物相关程度极低,不贡献臭味。Lactobacillus、Tetragenococcus和Chishuiella与酯类、酮类、醇类相关性最大,为青腐乳提供了香气。本研究有助于解析青腐乳菌群结构对风味的形成机制,开发基于微生物调控技术的优质腐乳生产技术,提高产品风味及品质稳定性,为传统产业升级提供依据。后续将在菌株水平上鉴定呈味细菌,并通过单菌株发酵进一步验证其呈味作用及其对青腐乳核心风味的贡献度。
