驼乳蛋白α-淀粉酶抑制活性肽的制备与鉴定
2020-12-13吉日木图
苏 娜,伊 丽,2,吉日木图,2,
(1.内蒙古农业大学 乳品生物技术与工程教育部重点实验室,内蒙古 呼和浩特 010018;2.内蒙古骆驼研究院,内蒙古 阿拉善 750306)
随着生活水平的提高,越来越多的人患上糖尿病,致使其成为仅次于心脑血管疾病、恶性肿瘤后排名第三的慢性非传染疾病[1]。目前,在预防糖尿病方面采用了各种策略,如改变饮食、避免加工食品,增加蔬菜和水果的摄入量、定期进行锻炼以及使用不同的降血糖药物[2]。然而由于胰岛素和常规口服降血糖药物的副作用和有限的长期持久性,需要探索自然和安全的方法防止糖尿病的进一步发展。近年来,食源性降血糖肽不断被开发出来,例如植物源降血糖肽(核桃、燕麦和山杏仁等)[3-5];动物源性降血糖肽(山羊乳、蚕蛹和带鱼等)[6-8]。它们较化合药物具有很多优势,已成为当下的研究热点。文献表明,一些降血糖肽能有效刺激胰岛素的分泌,改善糖尿病动物模型和受试者的血糖水平[9]。其中α-淀粉酶抑制活性肽可有效控制餐后血糖,降低血糖水平,备受学术界关注。
驼乳营养成分独特,容易消化吸收,过敏原性低,含有丰富的蛋白质、不饱和脂肪酸、维生素和必需的矿物质元素,营养价值远高于其他动物乳。它的基本化学成分与牛乳相似,但干物质、蛋白质、灰分和脂肪等含量都高于牛乳[10]。驼乳独特的健康益处可能与自身的蛋白质组成有关[11],驼乳含有其他动物乳所罕有的纯天然生物活性蛋白,如乳铁蛋白、溶菌酶、免疫球蛋白、重链抗体、胰岛素和类胰岛素生长因子等,可应用于抑制血糖升高的研究中[12]。研究表明,驼乳在体外和体内试验都显示出良好的降血糖活性[13-16],引起消费者的极大兴趣。以驼乳蛋白为原料制备α-淀粉酶抑制活性肽,显得十分有价值。
本实验预采用碱性蛋白酶和木瓜蛋白酶对驼乳蛋白进行水解,优化其工艺条件。测定最优酶解条件下驼乳多肽的α-淀粉酶抑制活性,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)验证驼乳多肽的酶解效果和基质辅助激光解吸电离飞行时间质谱(matrix assisted laser desorption ionization-time of flight-mass spectrometry,MALDI-TOF-MS)测定驼乳多肽的分子质量分布。并利用氨基酸自动分析仪和液相色谱-质谱(liquid chromatograph-mass spectrometry,LC-MS)联用仪对驼乳多肽进行鉴定,比较不同蛋白酶作用下驼乳多肽的氨基酸组成和肽段序列,分离出有效的生物活性肽,为今后驼乳蛋白α-淀粉酶抑制活性肽的研究提供参考。
1 材料与方法
1.1 材料与试剂
驼乳由内蒙古阿拉善盟阿拉善右旗养驼户提供。
BCA蛋白浓度测定试剂盒(增强型) 上海碧云天生物技术有限公司;碱性蛋白酶(200 000 U/g)、木瓜蛋白酶(6 000 000 U/g)、1,4-二巯基苏糖醇(1,4-dithiothreitol,DTT,纯度为99%)、丝氨酸、α-淀粉酶(40 000 U/g)、可溶性淀粉、DNS试剂、考马斯亮蓝蛋白胶快速染色液 北京索莱宝科技有限公司;SDS、三羟甲基氨基甲烷、甘氨酸、α-氰基-4-羟基肉桂酸(α-cyano-4-hydroxycinnamic acid,CHCA) 美国Sigma公司;邻苯二甲醛(o-phthalaldehyde,OPA,纯度为97%) 天津市光复精细化工研究所;标准蛋白Marker(10~180 kDa) 美国Thermo Fisher Scientitic公司;SDS-PAGE预制胶 江苏金斯瑞有限公司;SDSPAGE上样缓冲液(5×) 北京博奥森生物技术有限公司;乙腈、三氟乙酸(均为色谱纯) 德国Merck公司;Mass Standards Kit for thr 4700 Proteomics Analyzer美国AB Sciex公司;其他试剂均为分析纯。
1.2 仪器与设备
FE28 pH计 上海梅特勒-托利多仪器有限公司;DK-8AXX电热恒温水槽、GHP-9270隔水式恒温培养箱 上海一恒科学仪器有限公司;5810R离心机德国Eppendorf公司;MD25(3 500 Da)透析袋 北京索莱宝科技有限公司;SCIENTZ-10N冷冻干燥机宁波新芝生物科技股份有限公司;SYNERGY H1酶标仪、165-8001垂直电泳槽、164-5050电泳仪、GelDoc XR+凝胶成像系统 美国Bio-Tek有限公司;TS-1000水平脱色摇床 海门市其林贝尔仪器制造有限公司;L-8900型全自动氨基酸分析仪 日本日立公司;4800 Plus MALDI TOF/TOF质谱仪 美国AB Sciex公司;Q-Exactive质谱仪 美国Thermo Fisher Scientitic公司。
1.3 方法
1.3.1 驼乳蛋白的制备
新鲜的驼乳经离心(8 000 r/min、20 min、4 ℃),弃去上层脂肪,即得脱脂驼乳。脱脂后的驼乳置于透析袋中,透析外液为磷酸盐缓冲液,透析24 h除杂。取出后置于-80 ℃预冻24 h,放入真空冷冻干燥机中,在-50 ℃、1 Pa条件下干燥成粉备用。驼乳蛋白含量采用BCA蛋白浓度测定试剂盒进行测定,驼乳蛋白质量分数约为64.61%。
1.3.2 酶解制备驼乳多肽
驼乳蛋白以0.1 g/mL的底物质量浓度复原后,选用碱性蛋白酶和木瓜蛋白酶分别对驼乳蛋白进行水解。水解完成后90 ℃、20 min灭酶,冷却,离心沉淀(4 000 r/min、10 min、4 ℃)提取上清液,即为驼乳多肽。
1.3.3 单因素试验
分别对碱性蛋白酶和木瓜蛋白酶的酶用量、酶解温度、酶解pH值和酶解时间进行单因素试验,测定各酶解液的蛋白质水解度,确定单因素试验的酶解条件。
控制酶解温度55 ℃、酶解pH 7.0、酶解时间3 h,设定酶用量分别为(E/S)质量分数1%、3%、5%、7%、9%,考察酶用量对驼乳蛋白水解度的影响。控制酶用量5%、酶解pH 7.0、酶解时间3 h,设定酶解温度分别为45、50、55、60、65 ℃,考察酶解温度对驼乳蛋白水解度的影响。控制酶用量5%、酶解温度55 ℃、酶解时间3 h,设定酶解pH值分别为6.0、6.5、7.0、7.5、8.0,考察酶解pH值对驼乳蛋白水解度的影响。控制酶用量5%、酶解温度55 ℃、酶解pH 7.0,设定酶解时间分别为1、2、3、4、5 h,考察酶解时间对驼乳蛋白水解度的影响。
1.3.4 正交试验设计
在单因素试验结果的基础上,以蛋白质水解度作为评价指标,设计酶用量、酶解温度、酶解pH值和酶解时间的4因素3水平L9(34)正交试验,以期获得碱性蛋白酶和木瓜蛋白酶水解驼乳蛋白的最佳工艺条件,正交试验的因素与水平设计见表1、2。
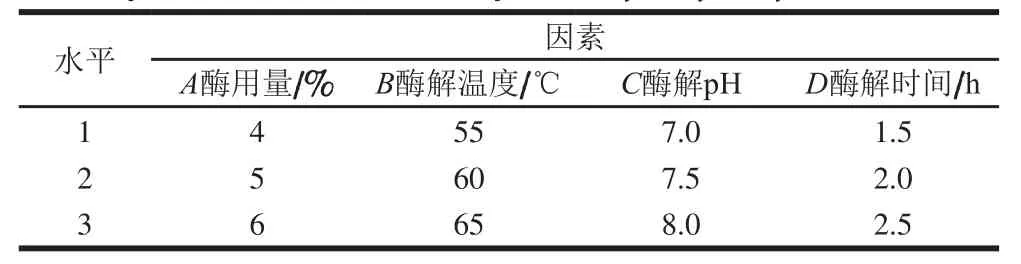
表1 碱性蛋白酶水解驼乳蛋白正交试验设计L9(34)因素与水平Table 1 Factors and levels used in L9(34) orthogonal array design for optimization of camel milk protein hydrolysis by alcalase

表2 木瓜蛋白酶水解驼乳蛋白正交试验设计L9(34)因素与水平Table 2 Factors and levels used in L9(34) orthogonal array design for optimization of camel milk protein hydrolysis by papain
1.3.5 蛋白质水解度的测定
采用OPA法测定蛋白质水解度[17]。在避光条件下,向装有3 mL OPA试剂(200 mg SDS、7.62 g四硼酸钠、160 mg OPA、4 mL乙醇和176 mg DTT用去离子水溶解,定容至200 mL,避光保存)的试管中分别加入400 μL丝氨酸溶液(标准溶液)、去离子水(空白溶液)和驼乳多肽溶液(样品溶液),混匀5 s后,室温反应2 min,于波长340 nm处测定吸光度。按式(1)计算蛋白质水解度:

式中:h为被水解的肽键数/(meqv/g);htot为蛋白质总肽键数(8.2 meqv/g)。
1.3.6α-淀粉酶抑制活性的测定
吸取不同浓度的驼乳多肽与驼乳蛋白溶液100 μL及1 U/mL的α-淀粉酶(用pH 6.8,0.1 mol/L的磷酸盐缓冲液配制)100 μL于试管中,混匀后于37 ℃恒温反应5 min,再加入250 μL 1%淀粉溶液(用pH 6.8,0.1 mol/L的磷酸盐缓冲液配制),混匀后于37 ℃恒温反应5 min,加入200 μL的DNS试剂,反应液于沸水浴中加热15 min后取出,并于冰水浴中迅速冷却,再加入2 mL蒸馏水,于波长540 nm处测定吸光度[18]。按式(2)计算α-淀粉酶抑制率:

式中:A样品为样品反应液吸光度;A空白为以磷酸盐缓冲液代替酶的吸光度;A对照为以磷酸盐缓冲液代替样品的吸光度。
1.3.7 SDS-PAGE
配制SDS-PAGE 15%分离胶、5%浓缩胶和质量浓度为30 mg/mL的驼乳多肽和驼乳蛋白,并与蛋白上样缓冲液4∶1混合,备用。待浓缩胶凝固后,取下胶板,装入电泳槽,倒入电泳缓冲液,取下样品梳,开始加样。碱性蛋白酶水解驼乳蛋白制备的多肽(以下简称JX)、木瓜蛋白酶水解驼乳蛋白制备的多肽(以下简称MG)、驼乳蛋白和标准蛋白分子Marker(10~180 kDa)的上样量为5 μL,浓缩胶和分离胶的电压分别为90 V和120 V。电泳结束后,用考马斯亮蓝染色液对胶片进行染色,再用脱色液脱色至背景透明,条带清晰可见,并置于凝胶成像仪上拍照分析。
1.3.8 氨基酸组成的测定
根据GB/T 5009.124—2016《食品中氨基酸的测定》的测定方法[19],采用L-8900型全自动氨基酸分析仪对驼乳多肽的游离氨基酸组成进行测定。
1.3.9 分子质量的测定
将驼乳多肽样品与CHCA基质溶液按体积比1∶1混匀,取1 μL点至样品靶上,再以相同的方法将校准标准品点在样品的相邻靶位上,待自然干燥成结晶后,置于4800 Plus MALDI TOF/TOF质谱仪离子源中进行测定,图谱扫描范围为m/z0~10 000,累计10 次单次扫描信号为最终质谱图[20]。
1.3.10 多肽的鉴定
1.3.10.1 样品处理
驼乳多肽通过10 kDa离心过滤器过滤,SPE C18柱除盐,真空蒸发后,用40 μL 0.1 mol/L的三氟乙酸溶液重溶,通过LC-MS鉴定。
1.3.10.2 色谱分离
流动相A液为0.1%甲酸溶液,B液为0.1%甲酸-乙腈溶液(乙腈体积分数84%)。色谱柱为RP-C18(0.15 mm×150 mm,5 μm),进样量20 μL,流速0.25 mL/min,进样时间60 min。流动相洗脱程序:流动相梯度:0~50 min,96%~50% A,4%~50% B;50~54 min,50%~20% A, 50%~80% B;54~60 min,0% A,100% B。
1.3.10.3 质谱鉴定
检测方式:正离子模式,质量扫描范围m/z300~1 800,离子源温度280 ℃,喷雾电压3 800 V,信号强度阈值2×104,碰撞能量27 eV。肽段序列用软件MaxQuant 1.5.5.1检索相应的数据库,最后得到驼乳多肽鉴定和定量的分析结果。
1.3.11 多肽的合成
采用固相合成法对筛选的肽段进行合成,并通过LC-MS分析仪对合成肽的纯度和分子质量进行鉴定,以上步骤由浙江昂拓莱司生物技术有限公司辅助完成。
1.4 数据处理
所得数据均用SPSS 20.0和Microsoft Excel 2016进行统计分析。各组实验均重复3 次,采用ANOVA进行Duncan差异分析,P<0.05,差异显著。
2 结果与分析
2.1 单因素试验结果
2.1.1 酶用量对驼乳蛋白水解度的影响

图1 酶用量对驼乳蛋白水解度的影响Fig. 1 Effect of enzyme dosage on hydrolysis degree of camel milk protein
从图1可以看出,随着酶用量的增加,水解度整体呈现上升的趋势。碱性蛋白酶和木瓜蛋白酶在酶用量达到5%时,水解度分别为67.17%和52.96%。继续增加酶用量,酶解反应达饱和,蛋白质水解度变化无显著性差异(P>0.05)。为节约成本,故确定碱性蛋白酶和木瓜蛋白酶水解驼乳蛋白的最佳酶用量为5%。
2.1.2 酶解温度对驼乳蛋白水解度的影响
由图2可知,随着酶解温度的升高,酶与底物接触机会增多,水解程度增大。当酶解温度到达60 ℃,蛋白质水解度达最高,分别为63.27%(碱性蛋白酶)和57.28%(木瓜蛋白酶)。随后酶解温度继续升高,导致蛋白酶失活,酶解效果变差,蛋白质水解度也开始下降。故确定碱性蛋白酶和木瓜蛋白酶水解驼乳蛋白的最佳酶解温度为60 ℃。
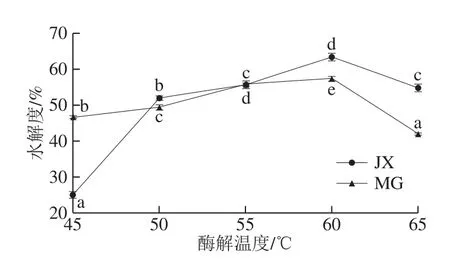
图2 酶解温度对驼乳蛋白水解度的影响Fig. 2 Effect of hydrolysis temperature on hydrolysis degree of camel milk protein
2.1.3 酶解pH值对驼乳蛋白水解度的影响

图3 酶解p值对驼乳蛋白水解度的影响Fig. 3 Effect of pH on hydrolysis degree of camel milk protein
如图3所示,随着酶解pH值的增大,碱性蛋白酶水解驼乳蛋白水解度也逐渐增大。在酶解pH值为7.5时,蛋白质水解度相对较高,达62.94%,随后蛋白质水解度又下降,因此确定碱性蛋白酶水解驼乳蛋白最佳酶解pH值为7.5。木瓜蛋白酶水解驼乳蛋白随着酶解pH值的增大,水解度呈先升高后降低的趋势。酶解pH值为6.5时,蛋白质水解度为60.61%,达到最大。这可能是由于过碱会影响蛋白酶的稳定性,改变酶的空间结构,最终导致酶失活。因此确定木瓜蛋白酶的最佳酶解pH值为6.5。
2.1.4 酶解时间对驼乳蛋白水解度的影响

图4 酶解时间对驼乳蛋白水解度的影响Fig. 4 Effect of hydrolysis time on hydrolysis degree of camel milk protein
如图4可知,在碱性蛋白酶作用下,在1~3 h内驼乳蛋白的水解度呈上升趋势,水解度由46.09%增加到61.27%。随着水解的进行,底物逐渐被消耗,3 h后的水解度开始下降。但在2~3 h内,水解度已基本趋于平缓,无显著差异(P>0.05)。故确定碱性蛋白酶水解驼乳蛋白的最佳酶解时间为2 h。木瓜蛋白酶水解驼乳蛋白随着酶解时间的延长,水解度有所提高,酶解时间在2 h时,蛋白质水解度达最高,为50.04%。因此确定2 h为木瓜蛋白酶水解驼乳蛋白的最佳酶解时间。
2.2 正交试验结果

表3 碱性蛋白酶水解驼乳蛋白正交试验L9(34)结果Table 3 Results of L9(34) orthogonal array design for optimization of camel milk protein hydrolysis by alcalase

表4 木瓜蛋白酶水解驼乳蛋白正交试验L9(34)结果Table 4 Results of L9(34) orthogonal array design for optimization of camel milk protein hydrolysis by papain
如表3、4所示,碱性蛋白酶水解驼乳蛋白的实际最优组合为A2B1C2D3,即酶用量5%、酶解温度55 ℃、酶解pH 7.5、酶解时间2.5 h,水解度达64.43%;木瓜蛋白酶水解驼乳蛋白的实际最优组合为A3B1C3D2,即酶用量6%、酶解温度55 ℃、酶解pH 7.0、酶解时间2 h,水解度达62.95%。
碱性蛋白酶水解驼乳蛋白的理论最优水平组合为A2B2C3D3,即酶用量5%、酶解温度60 ℃、酶解pH 8.0、酶解时间2.5 h;木瓜蛋白酶水解驼乳蛋白的理论最优组合为A1B1C3D2,即酶用量4%、酶解温度55 ℃、酶解pH 7.0、酶解时间2 h。碱性蛋白酶水解驼乳蛋白的极差结果得出RA>RB>RD>RC,即影响水解度因素的主次关系为酶用量>酶解温度>酶解时间>酶解pH值;木瓜蛋白酶水解驼乳蛋白极差结果得出RA>RC>RB>RD,即影响水解度因素的主次关系为酶用量>酶解pH值>酶解温度>酶解时间。
经实验验证,理论最优水平组合所得酶解产物测得的蛋白质水解度高于实际最优水平组合,所以碱性蛋白酶水解驼乳蛋白的最佳工艺组合为A2B2C3D3,木瓜蛋白酶水解驼乳蛋白的最佳工艺组合为A1B1C3D2。
2.3 α-淀粉酶的抑制作用

图5 JX、MG和驼乳蛋白质量浓度对α-淀粉酶抑制率的影响Fig. 5 α-Amylase inhibitory effects of different concentrations of JX,MG and camel milk protein
碳水化合物的分解是引起餐后血糖升高的主要原因,控制餐后血糖可有效预防糖尿病。α-淀粉酶是碳水化合物分解的关键酶,可随机水解淀粉等碳水化合物内部的α-1,4-糖苷键,将淀粉类物质分解。因此可以通过抑制其酶促反应减少葡萄糖的生成,从而防止血糖浓度的升高[21-22]。如图5所示,随着样品质量浓度的升高,α-淀粉酶的抑制率先升高后趋于平缓。这是由于样品质量浓度的增加,与α-淀粉酶结合的有效肽段增多,因而抑制作用越来越强。随后样品质量浓度继续增加,有效肽段与α-淀粉酶的结合达到了饱和,再增加样品质量浓度对于抑制效果并不明显[23]。JX、MG和驼乳蛋白对α-淀粉酶的IC50分别为0.027、0.026 mg/mL和0.089 mg/mL。驼乳多肽的IC50值低于驼乳蛋白,表明驼乳蛋白被酶解后,生成了有效的生物活性肽,从而使抑制α-淀粉酶的作用增加,这与Mudgil等[24]研究的结果相同。相比于JX,MG的IC50值更低,对α-淀粉酶的抑制作用更强,表明MG产生了更为有效的α-淀粉酶抑制活性肽。由于蛋白酶种类和水解条件的差异,可能导致蛋白质更大程度水解成一些无效的短肽和游离氨基酸,从而使JX的α-淀粉酶抑制活性偏低[25]。Jan等[6]研究发现绵羊乳酪蛋白水解3 h时,α-淀粉酶抑制活性升高,而水解5 h后α-淀粉酶抑制活性降低。后续Ngoh等[26]也发现用复合蛋白酶水解黑白斑豆1 h可改善α-淀粉酶抑制活性,而水解1.5 h后α-淀粉酶抑制活性降低。因此,木瓜蛋白酶更适合制备α-淀粉酶抑制活性肽。
2.4 SDS-PAGE结果

图6 JX、MG和驼乳蛋白的SDS-PAG结果Fig. 6 SDS-PAGE profiles of JX, MG and camel milk protein
如图6所示,大多数驼乳蛋白在水解后都被降解成SDS-PAGE无法检测到的小分子肽段。JX和MG都有不明显的κ-酪蛋白条带,说明这2 种蛋白酶对κ-酪蛋白的降解能力有限,且κ-酪蛋白含量较高。对于α-乳白蛋白,木瓜蛋白酶有一定程度的水解作用,而碱性蛋白酶都对α-乳白蛋白有一定的抗性。相对来说,由于蛋白质的结构不同,酪蛋白和α-乳白蛋白都比较难水解。酪蛋白的水解是随机且灵活的,而α-乳白蛋白的肽段分裂位置藏在较深的桶状结构中,导致蛋白酶对它们表现出较差的降解能力[24]。酶解后的产物在10 kDa以下的条带颜色较深且连续,说明驼乳蛋白已经水解成多肽,酶解很彻底。总的来说,酪蛋白和α-乳白蛋白较其他蛋白难降解,木瓜蛋白酶较碱性蛋白酶更容易水解蛋白质,这与Salami等[27]的研究一致。
2.5 驼乳多肽的氨基酸组成
如表5所示,在驼乳蛋白中,谷氨酸、亮氨酸和脯氨酸的含量普遍较高,与伊日贵等[28]的研究结果一致。从整体上看,酶解前后游离氨基酸的含量变化不大,可能是因为酶解只能将蛋白质水解成长短不一的肽段,而不能极大地改变酶解产物中游离氨基酸的含量。由于蛋白酶种类的不同,对蛋白质的作用位点不同,因而可以产生不同的酶解产物,导致JX和MG的氨基酸组成有所区别。MG中除丝氨酸和缬氨酸外,其余15 种氨基酸、总氨基酸含量都高于JX,说明MG水解更完全。有研究发现,淀粉酶有许多芳香族氨基酸残基,这些残基会与多肽中的芳香族氨基酸残基(苯丙氨酸、酪氨酸)结合,形成氢键、静电和范德瓦尔斯作用,使得多肽和酶之间产生芳香族氨基酸和芳香族氨基酸的相互作用,这与α-淀粉酶的抑制活性密切相关[29]。MG的芳香族氨基酸含量稍高于JX,说明MG的α-淀粉酶抑制活性偏高与其芳香族氨基酸有一定关系。

表5 JX、MG和驼乳蛋白的氨基酸组成Table 5 Amino acid composition of JX, MG and camel milk protein
2.6 驼乳多肽的分子质量分布
MALDI-TOF-MS是一种新型软电离质谱技术,可直接应用于混合物的分析,测定其绝对的分子质量,具有准确、快速、灵敏度高和检测范围广等优点,广泛应用于众多领域[30]。本实验在正离子检测模式下,利用反射方式(0~5 000 Da)和线性方式(5 000~10 000 Da)对2 种驼乳多肽进行分子质量的测定。如图7、8所示,JX和MG都表现出很好的水解效果,其中MG的洗脱峰更多,水解程度高于JX。JX和MG分子质量分布如图9所示,MG的分子质量主要集中在400~2 000 Da,JX的分子质量主要集中在400~3 000 Da。MG分子质量在400~1 000 Da范围内肽段最多,所占比例高达68.29%,明显高于其他分子质量范围,说明木瓜蛋白酶相比于复合蛋白酶水解驼乳蛋白可以得到更多的小分子肽。

图7 反射方式(A)和线性方式(B)下JX的分子质量质谱图Fig. 7 Mass spectra showing molecular mass of JX in reflection mode (A) and linear mode (B)

图8 反射方式(A)和线性方式(B)下MG的分子质量质谱图Fig. 8 Mass spectra showing molecular mass of MG in reflection mode (A) and linear mode (B)

图9 JX和MG的分子质量分布(0~10 kDa)Fig. 9 Molecular mass distribution of JX and MG (0–10 kDa)
2.7 驼乳多肽鉴定结果

表6 JX和MG中被鉴定的多肽及蛋白信息Table 6 Information about the identified peptides and proteins in JX and MG
JX和MG鉴定出的肽段在UniProt Camelidae数据库中进行比对。表6表明,JX鉴定出110 种肽段,共计147 条肽段,对应16 种蛋白,主要来源于酪蛋白,可达50.91%,分子质量主要集中在900~2 800 Da。MG鉴定出69 种肽段,共计81 条肽段,对应13 种蛋白,主要来源于酪蛋白,可达68.12%,分子质量主要集中在900~2 600 Da。经过不同的蛋白酶处理,获得不同序列和大小的肽段以及分解蛋白质的来源也不同。由图10可以看出,JX和MG有19 种相同肽段,JX和MG的差异性肽段分别有91 和50 种。基于Peptide Ranker评分大于0.80的标准,筛选潜在的生物活性肽[31],见表7。JX筛选出1 条肽段HAGPTWNPISIGISFM,MG筛选出2 条肽段IPLPLPLPLP和LPLPLPLR。由于碱性蛋白酶主要作用于C-末端的芳香族或疏水性氨基酸[32],酶切范围较广,易被水解,获得的肽段序列比较复杂,而木瓜蛋白酶则主要作用于蛋白质N-末端的疏水性氨基酸残基[33],水解后疏水性基团暴露,导致肽序中含有较多的亮氨酸(L)和脯氨酸(P),MG有较高的α-淀粉酶抑制活性可能与此有关。筛选出的3 条肽段在数据库(BIOPEP、PeptideDB、SwePep和EROPMoscow)中搜索无记录,表明发现了新的生物活性肽,这为驼乳蛋白在防治糖尿病方面提供了新的依据。

图10 JX和MG差异性肽段Venn图Fig. 10 Venn diagram of differential peptides between JX and MG

表7 JX和MG中Peptide Ranker评分大于0.80的肽段Table 7 Selected peptides derived from JX and MG from Peptide Ranker score 0.80
2.8 合成肽的分析和验证
采用固相合成法合成了3 条新发现的肽段,并验证了潜在α-淀粉酶抑制活性相似序列合成肽的效价。如图11A1、B1、C1所示,出峰时间稳定、峰形对称、基线平稳,纯度都大于95%。如图11A2、B2、C2所示,各肽的分子质量测定值与其理论值相近,合成结果可靠,具体数据见表8。HAGPTWNPISIGISFM、IPLPLPLPLP和LPLPLPLR三条肽的α-淀粉酶的IC50分别为0.067、0.039 mg/mL和0.041 mg/mL,都低于与之对应的酶解产物,造成这样结果的原因可能是合成肽仅为单一肽,而酶解产物中是多种混合肽的共同作用;合成肽的氨基酸序列和分子质量虽然与天然肽相近,但空间结构有所不同;此外合成过程中一些毒性物质的影响,也会对活性造成一定的破坏。HAGPTWNPISIGISFM的活性相对较低,IPLPLPLPLP和LPLPLPLR的活性相差不大,说明α-淀粉酶抑制活性与疏水性氨基酸有关,主要是亮氨酸和脯氨酸,验证了氨基酸序列与活性的相关性。

图113 条多肽的LC-MS图Fig. 11 Liquid chromatograms and mass spectra of 3 peptides

表8 合成肽的色谱、质谱信息及α-淀粉酶的IC50Table 8 Chromatographic and mass spectrographic information of synthetic peptides and their IC50 against α-amylase
3 结 论
驼乳因其潜在的健康效益而受到科学界的关注。在本研究中,发现驼乳蛋白是生物活性肽的潜在来源,具有抑制与糖尿病相关的关键代谢酶的潜力。还观察到用于产生生物活性肽的蛋白酶的类型和酶解时间对产生的肽的生物活性有深刻的影响。利用碱性蛋白酶和木瓜蛋白酶水解驼乳蛋白,都提高了α-淀粉酶的抑制活性,但IC50值有所不同,从而证实了用特异性蛋白酶控制水解的重要性。不同蛋白酶水解驼乳蛋白可产生不同的肽段,但JX和MG中鉴定的肽段分解的主要源蛋白相同。其中IPLPLPLPLP和LPLPLPLR可认为是最有效的α-淀粉酶抑制活性肽,验证了肽段的氨基酸序列与α-淀粉酶抑制活性有一定的关系。为了将所制得的活性肽应用到实际生活中,今后的工作还需要对肽的消化稳定性、生物安全性以及体内模型的α-淀粉酶抑制活性进行进一步研究。
