高效降解柠檬酸酵母菌的筛选鉴定及其在红树莓果汁中降酸特性
2020-12-13陈思睿唐琳琳冯建文孙丽娜王金玲
陈思睿,唐琳琳,冯建文,孙丽娜,王金玲,4,
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.呼伦贝尔众合源农业科技有限公司,内蒙古 呼伦贝尔 021000;3.大连市现代农业生产发展服务中心,辽宁 大连 116036;4.黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨 150040)
水果中相当一部分干物质是有机酸,不同种类的水果中有机酸种类和含量差异很大[1]。红树莓有机酸含量高且主要是柠檬酸[2],导致红树莓产品口感不佳,糖酸比不协调,限制了红树莓的开发利用。相关研究表明,水果型饮料中高浓度的有机酸和低pH值对于人牙釉质和牙本质具有腐蚀作用[3-4]。因此,采用有效方法降低红树莓汁的柠檬酸含量,提高pH值,保留活性成分并形成良好风味,成为了开发红树莓产品的研究重点。
果汁降酸的方法主要包括化学降酸、物理降酸、生物降酸。化学降酸是通过添加降酸剂进行降酸,效果明显,操作简单,但会对原料成分、色泽、风味和稳定性产生一定影响。常用物理降酸法有离子交换树脂降酸法、电渗析降酸法、低温冷冻降酸法等,主要是针对酒石酸的降酸[5]。生物降酸是指微生物以有机酸为碳源,利用并分解有机酸,从而达到降酸目的;一种是苹果酸-乳酸发酵法[6-7],不适用于柠檬酸降酸;另一种采用酵母菌发酵,使得有机酸通过相关代谢降解[5]。何志刚等[8]从自然发酵的枇杷酒和刺葡萄酒中分离出2 株酿酒酵母菌,应用于枇杷酒和葡萄酒发酵,分别使总酸下降了16.60%、11.07%和13.76%、8.59%。
目前,对于降低高酸果汁中柠檬酸的菌株及其接种后对果汁有机酸变化影响的研究较少。本研究从红树莓果园泥土和红树莓鲜果中筛选降酸效果最好的菌株,测定发酵过程中有机酸的变化,利用生理生化测定和内转录间隔区(internal transcribed spacer,ITS)序列测定对降酸菌株进行鉴定,旨在为降低高柠檬酸果汁酸度及菌株后续的实际应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
采集哈尔滨阿城区红树莓种植园地表下5~10 cm处土壤和红树莓鲜果作为样品。取土壤2 g和适量红树莓鲜果分别加到盛有100 mL无菌生理盐水的锥形瓶中,并加入8~12 粒无菌玻璃珠,室温150 r/min振荡20 min,取出静置得上清液。
红树莓购自黑龙江省尚志市,品种为秋福,速冻处理后运回东北林业大学食品科学与工程实验室冻藏。
1.1.2 培养基
麦芽汁培养基配制参照文献[9];酵母生孢子培养基配制参照文献[10];孟加拉红培养基购自北京奥博星生物技术有限责任公司;柠檬酸培养基:(NH4)2SO42 g,KH2PO42.5 g,FeSO4·7H2O 0.1 g,酵母膏0.5 g,柠檬酸20 g,溶于1 L蒸馏水中,取100 mL配制溶液分装于250 mL锥形瓶中,121 ℃灭菌20 min。配制固体培养基时,柠檬酸加入200 mL蒸馏水中,其他成分溶于800 mL蒸馏水中,加琼脂粉25 g,分别在121 ℃灭菌20 min,冷却到50~60 ℃,混匀后倒平板[11]。
1.1.3 试剂
酵母菌鉴定生化管 上海江莱生物科技有限公司;柠檬酸、L-苹果酸、α-酮戊二酸、琥珀酸标准品(色谱纯) 上海源叶生物科技有限公司;甲醇(色谱纯)赛默飞世尔(中国)有限公司;DNA胶回收试剂盒、真菌基因组DNA抽提试剂盒 生工生物工程(上海)股份有限公司;常规药品试剂均为国产分析纯或优级纯。
1.2 仪器与设备
HZQ-X100振荡培养箱 哈尔滨市东明医疗仪器厂产品;PHS-3C型pH酸度计 上海精密科学仪器有限公司;SW-CJ-1FD型单人净化工作台 苏州净化设备有限公司;YJ-2005M型生物显微镜 宁波天宇光电科技有限公司;DH6000A型电热恒温培养箱 天津市泰斯特仪器有限公司;5030-PVL型高压灭菌锅 长春百奥生物仪器有限公司;Verity 96well型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;FR-980A型凝胶成像仪 上海复日科技有限公司;DYY-6C型电泳仪 北京六一仪器厂;1260 Infinity II液相色谱仪美国安捷伦科技有限公司。
1.3 方法
1.3.1 红树莓果汁预处理
红树莓冻果自然解冻后,榨汁机打浆1 min,在水浴锅中进行酶解,酶解条件为50 ℃、2 h,果胶酶(40 000 U/g)添加量为0.02%(质量分数)。酶解结束后,置于90 ℃水浴锅中灭酶5 min,经8 层纱布过滤取果汁,置于灭菌锥形瓶中,巴氏杀菌后冷却,待用[12-13]。
1.3.2 菌种筛选和分离纯化
取1.1.1节预处理的上清液5 mL,接入柠檬酸质量浓度为2 g/L且以柠檬酸为唯一碳源的锥形瓶中,在装液量100 mL/250 mL、28 ℃、120 r/min条件下振荡培养24 h。以同样条件依次将所培养的菌液转接,连续转接培养5 次,柠檬酸质量浓度由4、8、12、16 g/L逐渐递增到20 g/L;通过初筛和复筛,选出对柠檬酸具有较好降酸效果的菌株,挑取单菌落重复平板划线纯化培养[4,11]。
1.3.3 降酸菌降酸效果
将分离到的菌株在装液量100 mL/250 mL、28 ℃、120 r/min条件下培养24 h,制成种子液,活菌数为8×107CFU/mL,以接种量4%(体积分数)接种于柠檬酸液体培养基中,培养基装液量为50 mL/250 mL,28 ℃静置发酵8 d。发酵期间,每1 d取样测定总酸含量,比较菌株降酸能力,选择降酸速度快和降酸量高的菌株。
将上述降酸效果较好菌种的种子液,以接种量4%接种于1.3.1节制得的红树莓果汁中,果汁装液量为50 mL/250 mL,以未接菌的红树莓果汁作为对照,28 ℃静置发酵8 d,发酵期间,每1 d取样测定pH值和总酸含量,采用高效液相色谱(high performance liquid chromatography,HPLC)法对红树莓果汁中有机酸进行定量和定性分析,验证酵母菌的降酸效果。
1.3.4 菌株形态学鉴定
进行平板培养和菌体染色镜检,观察菌落的生长特征和菌株的形态特征。
菌落培养特征:将菌液稀释涂布于麦芽糖平板培养基上,28 ℃恒温培养2~3 d,观察菌落形态。经美蓝染色后[14],显微镜观察菌株细胞形态及芽殖方式。采用芽孢染色法,观察菌株子囊孢子形状及每个子囊内子囊孢子的数目[8]。
液体培养基培养特征:将菌株活化后挑取单菌落接种于100 mL麦芽汁液体培养基中,28 ℃恒温培养2~3 d,观察液体培养基中菌体培养状态。
1.3.5 菌株生理生化鉴定
参照文献[15-16]的方法进行降酸菌株的糖发酵、同化碳源、同化氮源实验等生理生化鉴定。
1.3.6 分子生物学鉴定
采用真菌基因组DNA抽提试剂盒提取菌株基因组DNA,以此基因组DNA为模板,使用ITS的通用引物:ITS1(5’-TCCGTAGGTGAACCTGCGC-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’),扩增ITS序列。PCR条件:94 ℃预变性4.0 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1.0 min,30 个循环;72 ℃延伸10.0 min。测序由生工生物工程(上海)股份有限公司完成,将测得的ITS序列在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)进行BLAST分析,在GenBank核酸序列数据库中搜索同源序列,与已知序列进行比较分析,找出与其相似性最高的菌株,确定菌株的生物学分类地位[17-18],利用MEGA Version 7软件构建系统发育树。
1.3.7 指标测定
1.3.7.1 总酸和pH值测定
总酸测定参考GB/T 12456—2008《食品中总酸的测定》中电位滴定法,以柠檬酸计;pH值用pH计测定。
1.3.7.2 降酸率的计算

式中:A0为未发酵样品中总酸或有机酸的质量浓度;A1为发酵结束后总酸或有机酸的质量浓度。
1.3.7.3 有机酸组分测定
HPLC条件:色谱柱Agilent ZORBAX Extend-C18(4.6 mm×250 mm,5 μm);流动相A为0.5% KH2PO4溶液(用磷酸调节pH 2.5),流动相B为甲醇,A-B体积比为97∶3;等度洗脱10 min,流速0.7 mL/min,进样量10 μL,柱温35 ℃,检测波长210 nm。依次测定标准品系列和样品。采用外标法对样液中的有机酸定量。
标准曲线:分别用纯净水溶解配制不同质量浓度的L-苹果酸、α-酮戊二酸、柠檬酸、琥珀酸混合标准溶液,经0.22 μm的微孔滤膜过滤后进行HPLC分析,得到峰面积(x)和有机酸质量浓度(y)的回归方程及相关系数。
样品处理:样品4 000 r/min离心15 min[19],吸取上清液于容量瓶中,用超纯水定容,混匀,稀释为适合浓度。用0.22 μm滤膜过滤后上机测定。
1.4 数据处理
2 结果与分析
2.1 降酸菌筛选
用柠檬酸固体培养基对降酸菌株进行筛选,结果显示,共有8 株菌可利用柠檬酸生长,分别接种到柠檬酸液体培养基中,比较菌株降酸能力,选择降酸速度快且降酸量高的菌株。

图1 各菌株的降酸效果Fig. 1 Deacidification abilities of eight isolates
由图1可知,不同菌株的降酸效果不同,总酸降低速率均呈先增加后降低趋势。其中来自土壤的菌株T2和来自果实的菌株G4降酸效果最好。在发酵8 d后,菌株T2总酸质量浓度从20 g/L下降到7.25 g/L,菌株G4下降到6.55 g/L,均可降解60%以上的总酸,其他菌株的降酸效果不如这2 株菌,故选择对降酸效果最好的菌株T2和G4进行进一步研究。
2.2 红树莓果汁降酸效果
将菌株T2和G4分别接入总酸质量浓度(以柠檬酸计)25.16 g/L、pH 3.08的红树莓果汁中,28 ℃静置发酵8 d,以未接菌红树莓果汁为对照,测定发酵过程中不同时间所取样品的总酸和pH值。
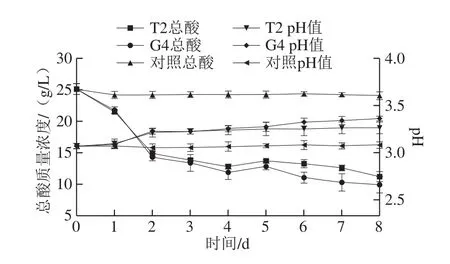
图2 发酵过程中红树莓果汁总酸和p值变化Fig. 2 Variations in total acidity and pH of red raspberry juice during fermentation and storage
由图2可知,对照果汁中总酸和pH值的变化很小,接入降酸菌的果汁与对照果汁相比,变化明显。菌株T2和G4在发酵过程中总酸变化不稳定,但总体呈下降趋势,pH值也相应发生了一定变化。发酵8 d后,菌株T2使果汁总酸质量浓度下降到11.24 g/L,降解果汁中55.32%的总酸,pH值由3.08上升到3.27;菌株G4使果汁总酸质量浓度下降到9.96 g/L,降解果汁中60.41%的总酸,pH值由3.08上升到3.36。
2.3 红树莓果汁降酸过程中有机酸变化
2.3.1 样品测定结果


图3 标准品和红树莓果汁有机酸色谱图Fig. 3 HPLC chromatograms of organic acid standards and red raspberry juice
由图3a可知,有机酸混合标准溶液分离效果良好。图3b~d为样品稀释20 倍发酵8 d的检测结果,3号色谱峰为柠檬酸色谱峰,发酵结束后峰面积明显变小,可知降酸菌将红树莓果汁中的柠檬酸进行了降解。
2.3.2 降酸发酵过程中有机酸的变化

图4 菌株T2(a)和菌株G4(b)发酵过程中红树莓汁有机酸含量变化Fig. 4 Variations in organic acid concentrations of red raspberry juice during fermentation with strains T2 (a) and G4 (b)
发酵所使用的红树莓果汁总酸质量浓度为25.16 g/L,柠檬酸质量浓度为22.87 g/L,占总酸的90.9%,所以柠檬酸为红树莓果汁中的主要有机酸,可通过降解柠檬酸进而降低果汁总酸。由图4可知,随着静置发酵时间的延长,接种菌株T2和G4的果汁中柠檬酸含量持续下降,L-苹果酸含量整体均呈下降趋势,琥珀酸含量在第1天增加后呈下降趋势,L-苹果酸和琥珀酸含量均在5~8 d保持在相对稳定的水平,α-酮戊二酸含量在第2天降到最低,之后呈现相似的缓慢波动上升趋势。与0 d的红树莓果汁相比,发酵8 d,菌株T2降柠檬酸效果显著(P<0.05),柠檬酸质量浓度为9.48 g/L,下降了58.55%,L-苹果酸含量下降了44.67%,琥珀酸含量下降了9.16%;菌株G4降柠檬酸效果也显著(P<0.05),柠檬酸质量浓度为9.25 g/L,下降了59.54%,L-苹果酸含量下降了43.12%,琥珀酸含量下降了20.29%。
果汁发酵过程中的有机酸随着发酵菌种生长与代谢而发生改变[20]。它们作为中间产物或最终产物参与代谢的各种基本途径[21],如苹果酸、α-酮戊二酸、琥珀酸和柠檬酸,这些酸属于三羧酸循环(tricarboxylic acid cycle,TCA)的链环酸[22],它们的定量可以提供细胞中发生的分解代谢和合成代谢过程的基本信息[23]。
发酵过程中,L-苹果酸含量的缓慢降低可能是菌株在降解柠檬酸的同时降解L-苹果酸。α-酮戊二酸质量浓度在发酵过程中波动可能主要是由代谢积累引起的[24]。α-酮戊二酸是氨基酸和核苷酸生物合成所必需的前体代谢物,它在TCA过程中基本没有净生成,2~8 d含量升高可能是由于一些回补途径合成得到[25]。柠檬酸通过其他途径降解,也可提高α-酮戊二酸含量。柠檬酸可以首先在顺乌头酸酶的催化作用下生成异柠檬酸,然后通过NADP-异柠檬酸脱氢酶催化生成α-酮戊二酸[26]。琥珀酸是糖类和大部分氨基酸代谢过程中的重要中间产物[27]。推测琥珀酸含量在第1天增加的原因是柠檬酸经TCA代谢,使得含量略有增加[28]。琥珀酸下降的原因可能是被降酸菌直接消耗代谢或者发生转化生成其他物质,经其他途径降解。有的酵母菌能够同化琥珀酸,通过合成反应利用,也会导致琥珀酸含量降低。
结果表明,菌株T2有机酸总体变化趋势与菌株G4的变化趋势相似,菌株T2和G4是2 株可分解柠檬酸且降酸能力较强的优良菌株。
2.4 降酸菌形态特征
菌株T2和G4的形态特征相似,在麦芽汁固体培养基上的形态如图5A所示,菌落为乳白色,菌落较大,呈圆形,具有一定厚度,中间略有凸起,表面光滑、湿润,质地均匀较黏稠,容易挑起,边缘整齐。显微镜观察细胞形态如图5B所示,细胞呈圆形或椭圆形。繁殖方式为芽殖,在酵母产子囊孢子培养基中25 ℃培养3 d,显微镜观察,子囊内产生1~4 个光滑的球形子囊孢子。在麦芽汁液体培养基中28 ℃培养2 d,培养基表面有醭形成。

图5 菌株菌落形态(A)和细胞形态(B)(×1 000)Fig. 5 Colonial morphological characteristics (A) and cell morphology (B)of strains T2 and G4 (×1 000)
2.5 生理生化鉴定
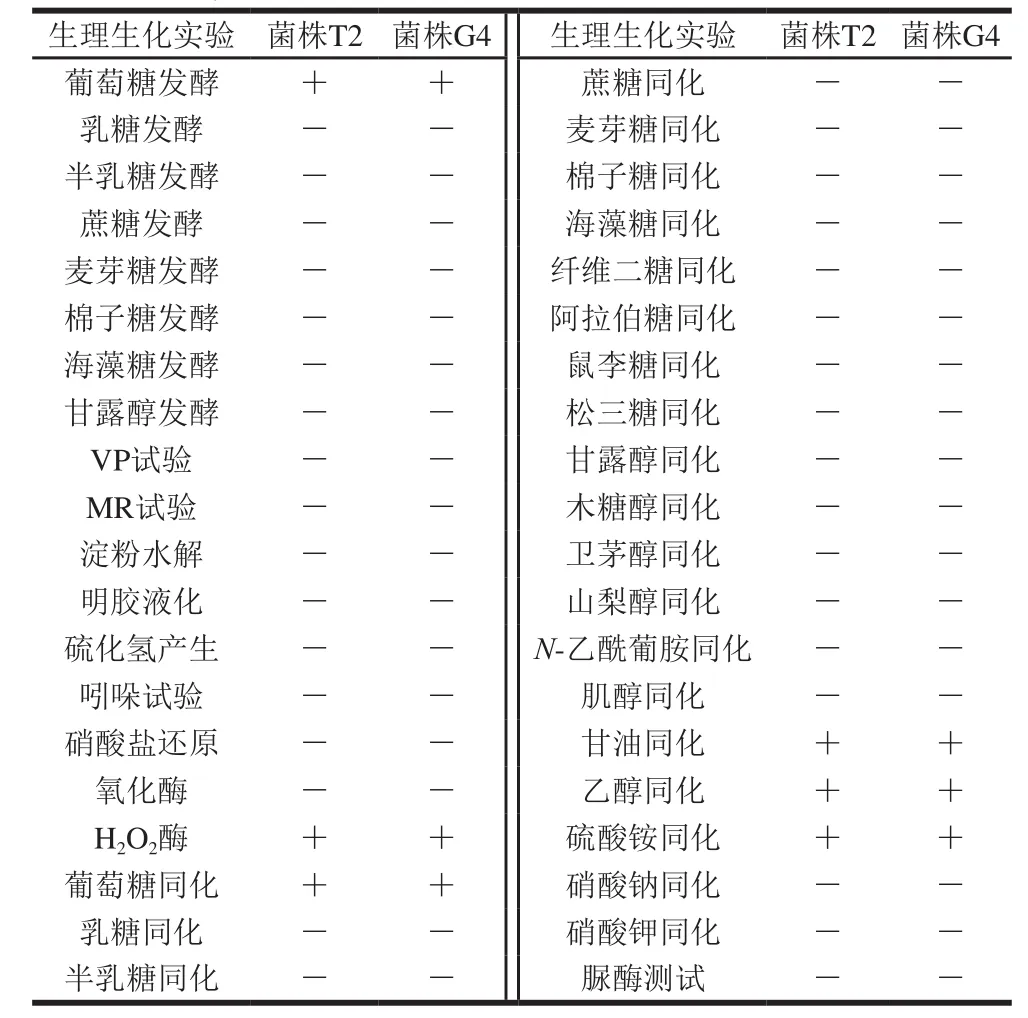
表1 生理生化实验结果Table 1 Physiological and biochemical properties of strains T2 and G4
由表1可知,菌株T2和G4均能利用葡萄糖,不能利用乳糖、半乳糖、蔗糖等其他糖源,除均能同化葡萄糖、甘油和乙醇外,其他碳源均不能被同化,菌株T2和G4可同化硫酸铵,不能同化硝酸盐。
2.6 分子生物学鉴定
2.6.1 菌株的PCR扩增结果
将纯化后的PCR扩增产物进行电泳,在紫外灯照射下观察,结果如图6所示。菌株T2和G4的ITS序列PCR产物电泳样品条带出现在300~500 bp之间,大小均为400 bp左右。
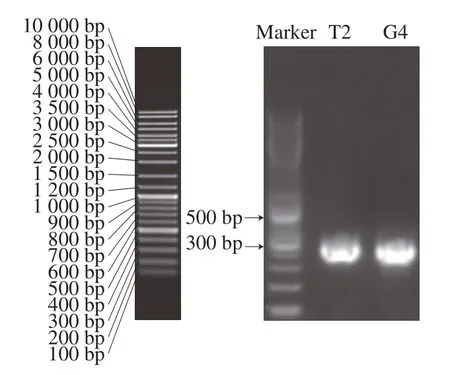
图6 菌株T2和G4的PCR产物电泳图Fig. 6 Agarose gel electrophoretograms of PCR amplified DNA fragments of strains T2 and G4
2.6.2 菌株T2和G4的ITS序列分析与系统发育树的建立
通过对降酸菌的ITS序列进行同源性分析,确定菌株T2和G4种属。菌株T2和G4的ITS序列在GenBank核酸序列数据库中进行同源序列搜索,利用NCBI网站(http://www.ncbi.nlm.nih.gov/blast)上的BLAST软件与已知菌株序列进行比对分析,并依此构建系统发育树。菌株T2和G4的ITS系统发育进化树如图7所示。

图7 菌株T2和G4的ITS系统发育进化树Fig. 7 Phylogenetic tree based on ITS sequences of strains T2 and G4
从图7可知,菌株T2和G4与P. terricola和陆生伊萨酵母(I. terricola)的同源性最好,亲缘关系最近。多重序列分析已将伊萨酵母属(Issatchenkia)归入毕赤酵母属(Pichia),这2 个属菌株的亲缘关系较近[29-30],可将P. terricola和I. terricola认定为一种菌,即I. terricola。结合上述菌株的形态学特征和生理生化实验结果,确定菌株T2和G4均为I. terricola,并分别重新定名为I. terricolaWJL-T2、I. terricolaWJL-G4。
3 结论与讨论
利用柠檬酸培养基对红树莓果园土壤和红树莓鲜果中的酵母菌进行筛选,得到具有良好降解柠檬酸效果的菌株T2和G4,在柠檬酸液体培养基中,菌株T2和G4的总酸降酸率分别为63.73%和67.23%。在红树莓果汁中,菌株T2和G4可分别降解55.32%和60.41%的总酸,58.55%和59.54%的柠檬酸。经生理生化实验及分子学鉴定,结果均为I. terricola,由于降酸速率和效果略有不同,最终将菌株T2和G4分别命名为WJL-T2和WJL-G4,后续可以通过其他测序方法进一步确定2 株菌的关系。王立芳等[31]从葡萄园土壤中分离得到1 株可降解L-苹果酸和柠檬酸的菌株为I. terricola,测得该菌株对12 g/L的L-苹果酸和柠檬酸的降解率分别达到93.17%和92.08%。说明I. terricola具有很好的降酸能力。
I. terricola属于果酒酿造的相关酵母。Bezerra-Bussoli等[32]的研究表明,通常情况下,自然发酵葡萄酒的发酵始于优势非酿酒酵母,它们来自于葡萄汁和生长环境,并决定了葡萄酒的品质和风味,非酿酒酵母中就包括I. terricola和毕赤酵母属的酵母。Drumonde-Neves等[33]在葡萄园中鉴定出包括P. terricola在内的23 种酵母菌种。在果酒酿造过程中,酿酒酵母会面临果实中有机酸尤其是柠檬酸的胁迫,高质量浓度柠檬酸(19.21~76.86 g/L)或pH≤2.80时,酿酒酵母的生长受到抑制[34],因此,将降酸菌应用于果酒降酸,提高pH值,有助于果酒生产。隋韶奕[35]利用I. terricolaS8进行生物降酸,降酸率为64.87%,并通过热浸提等工艺酿造了全汁树莓干型酒,总酸为6.1 g/L。可见,I. terricola应用在高酸果汁及果酒的降酸,能达到理想的效果。
从降酸发酵过程可知,在第8天柠檬酸含量仍有下降趋势,说明降酸率仍有可能增加;实验还发现降酸菌在有氧条件下降酸速率更快,关于2 菌株的最适降酸条件,可综合降酸率和对果汁中活性物质影响等因素,进一步实验摸索。降酸菌的降酸途径较复杂,可能不只TCA代谢一条途径,后续研究还可以测定柠檬酸代谢中的相关酶类活性,更准确深入地研究降酸的途径和机理。本实验结果为降低红树莓果汁酸度、提高果汁品质、研究生物降酸提供一定参考。
