Nisin、ɛ-聚赖氨酸、pH值对虾源枯草芽孢杆菌生长/非生长界面模型构建与评价
2020-12-13郭全友李保国姜朝军
郭全友,刘 玲,,李保国,杨 絮,姜朝军
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海理工大学医疗器械与食品学院,上海 200093)
熟制水产品通常是以鱼类、甲壳类、贝类、软体类、棘皮类等动物性水产品为主要原料,经蒸、煮、烘烤、油炸等加热熟制过程制成的直接食用的水产加工品,在加工过程中自原料、预处理、熟制或灭菌、包装等工艺难以将芽孢杆菌完全杀灭,即使经过高温杀菌的食品,可能因残存芽孢杆菌和孢子萌发而受到污染。枯草芽孢杆菌耐高温,极端条件下还可被诱导产生抗逆性很强的内源孢子[1],孢子的萌发为食品安全埋下隐患。枯草芽孢杆菌常存在于烤肠、对虾或鲍汁等熟制水产品中[1-3]。陈晓等[1]在酸臭的蒜蓉烤肠中检出枯草芽孢杆菌,发现该菌滋生与原料、设备、加工和二次灭菌等关键控制点均密切相关。郑瑞生[3]发现,枯草芽孢杆菌感染的鲍鱼无明显恶臭和黑变特征,但存在部分流汁和酸败现象,其分泌的酶类物质可能是其变质的重要因素。郑丽君等[4]通过测定免泡豆杆中腐败代谢产物(挥发性盐基氮)的产量因子为35.38 mg/100 g,确定枯草芽孢杆菌是致腐能力较强的腐败菌之一。表明枯草芽孢杆菌是熟制水产品中被检出常见的优势腐败菌,因而抑制其生长对保障食品质量安全至关重要。
预测微生物学是食品微生物学领域中一种有效的预测工具,可定量描述环境因子(温度、pH值、水分活度等)与微生物(如致病菌和腐败菌)生长的关系,在食品货架期预测及安全质量管理中具有较强的应用价值[5]。预测微生物模型分为初级模型、二级模型和三级模型,经验模型和理论模型,动力学模型及概率模型等[6]。20世纪90年代以来,动力学模型是预测微生物学的研究重点,能较好描述微生物生长与环境因子之间的关系,但不能对微生物的非生长状况进行定量表述[7]。微生物生长/非生长模型可定量描述不同因子作用下微生物生长的可能性(或概率),获知其生长/非生长动态信息,为食品保藏和风险评价提供一种有效工具[8]。目前微生物的生长/非生长模型有确定性方法[9]、Logistic回归法[10]、最小凸多面体法[11]、人工神经网络法[12]、简化式法[13]等。Logistic回归模型具有模型拟合度高、表达直观、应用方便等优点,更适合多种控制因子不同水平生长/非生长模型的建立。研究者多采用改变温度、pH值、水分活度及NaCl等环境因子控制微生物的生长[8,14-15],目前,通过生物因子(如乳酸链球菌肽(Nisin)、ɛ-聚赖氨酸(ɛ-polylysine,ɛ-PL))与环境因子的交互作用定量调控生长/非生长状况逐渐引起关注,如Boziaris等[16]研究了NaCl、KCl、pH值及Nisin对单核细胞性李斯特菌生长/非生长边界的影响,Na等[17]研究ɛ-PL和壳聚糖涂层对冷藏虾质量及其微生物群生长的影响。相关研究表明[18]Nisin对大多数革兰氏阳性菌具有较强抑制作用,其机理表现为对菌体净表面电荷改变、疏水性变化、磷脂组成改变、膜脂肪酸组成的变化、细胞壁增厚或蛋白水解等起重要作用;ɛ-PL是一种对革兰氏阳性菌、革兰氏阴性菌、酵母菌及霉菌均有抑制作用的天然防腐剂,且对细菌的抑制作用强于霉菌,尤其对枯草芽孢杆菌等抑制作用较明显[19],同时有研究[20]发现Nisin具有依赖于pH值的即时性杀菌效果,其杀菌效果随pH值的降低而增加。
目前针对枯草芽孢杆菌在Nisin、ɛ-PL和pH值交互作用下生长/非生长界面模型与效应评价少见报道,本研究以源自熟制南美白对虾优势腐败菌枯草芽孢杆菌为研究对象,在37 ℃通过pH值、Nisin及ε-PL交互作用对枯草芽孢杆菌生长概率产生影响,用Logistic回归模型建立该交互作用下生长/非生长模型,对其拟合优度和适用性进行评估及验证,分析比较3 种抑菌因子对枯草芽孢杆菌的交互作用,以期为优化熟制水产品生产工艺、定量预测枯草芽孢杆菌生长/非生长情况状况提供一种有效手段。
1 材料与方法
1.1 材料与试剂
真空包装熟制对虾虾仁采购于宁德市某水产公司,在其货架期终点时分离纯化出优势菌株,经MIDI脂肪酸鉴定、BIOLOG微生物鉴定和16S rRNA测序(序列号:KU570452.1)鉴定为枯草芽孢杆菌[21-22],冻干,4 ℃贮藏,待用。
0.01 mol/L HCl标准溶液 深圳市博材达科技有限公司;营养琼脂、营养肉汤、氯化钠 上海市国药集团化学试剂有限公司;Nisin 浙江新银象生物工程有限公司;ɛ-PL 郑州博研生物科技有限公司。
1.2 仪器与设备
Bioscreen C微生物生长测定仪 芬兰Oy Growth Curves Ab有限公司;PHS-3C pH计 上海雷磁仪器厂;SW-CJ-1FB洁净工作台 上海博讯实业有限公司医疗设备厂;ZM-100反压蒸煮消毒锅 广州标际包装设备有限公司;ZHWY-200H恒温培养振荡器 上海智城分析仪器制造有限公司;低温培养箱 日本三洋公司。
1.3 方法
1.3.1 生长介质的制备
设计多因子交互试验,使用营养肉汤作为培养介质。参考GB 2760—2014《食品添加剂使用标准》及相关文献[23],Nisin在熟制水产品中限量≤0.5 g/kg,ɛ-PL在熟肉制品中限量≤0.25 g/kg 。ɛ-PL及Nisin溶液梯度皆设置为0、20、60、100、140、180 μg/mL共6 个水平。枯草芽孢杆菌及孢子在3.0~10.0的pH值范围内具有耐受性[24-25],考虑到产品特性,参考GB 4789.26—2013《食品微生物学检验 商业无菌检验》低酸性食品与酸性食品界定为pH 4.6,取pH 4.0、4.6、5.0、6.0、7.0共5 个水平。参考文献[10,12]选取144 例数据作为训练集,36 例数据作为验证集,试验设计见表1。

表1 交互试验训练集与验证集设计Table 1 Design of training and validation set for interactiom experiments
1.3.2 菌悬液的制备及接种
菌株活化:取枯草芽孢杆菌接种于无菌营养肉汤中,振荡30 s,37 ℃培养24 h,在营养琼脂培养基中划线得到单菌落。
菌悬液制备:挑取单菌落,接种到10 mL无菌营养肉汤中,37 ℃培养18 h,取1 mL培养液至9 mL无菌生理盐水中得到10-1菌悬液,逐级稀释,制成10-1、10-2、10-3、10-4、10-5、10-6梯度菌悬液,各取0.1 mL涂布于营养琼脂平板,37 ℃培养48 h,选取菌量约105CFU/mL菌悬液作为接种液。
调节过pH值、ε-PL质量浓度的营养肉汤溶液经121 ℃灭菌处理,无菌条件下调节Nisin至所需质量浓度,每孔180 μL接入200微孔板中,取105CFU/mL 的接种液20 μL,确定最终接种液浓度为3.8×104CFU/mL ,接种入孔,每个条件10 组平行,1 个空白,微生物生长测定仪中速振荡25 ℃培养,7 d内每隔1 h测其OD600nm值。
1.3.3 生长/非生长界面的判别
实验结束时,微孔中出现明显混浊或沉淀物且OD值读数大于3×空白值(0.10左右)则判定枯草芽孢杆菌生长[10,12,26],当OD值∈(0.10,0.30)或对小孔中菌悬液浑浊度无法判定时,通过涂布营养琼脂平板证明,出现该菌典型菌落形态,且菌数大于初始菌量0.5(lg(CFU/mL))时[14],则确定枯草芽孢杆菌生长,否则确定为不生长。当结果确定枯草芽孢杆菌生长,记为“1”,反之则记为“0”。
1.3.4 生长/非生长模型构建与验证
1.3.4.1 Logistic模型构建
Ratkowsky等[27]提出了简单Logistic回归模型,其能够在一个或多个生长控制因子和添加剂的情况下,拟合菌株生长与非生长之间的边界,通过预测微生物学概率及动力学方面的整合,从而应用于预测食品微生物学中,选取144 例数据为训练集用以构建模型。

式(1)中:Logit(P)=ln[P/(1-P)];P为枯草芽孢杆菌生长概率;ai(i=0~3)为拟合参数;Nisin、ε-PL均表示质量浓度/(μg/mL)。式(2)同。
多项式Logistic回归模型是一种建立在一个多项式的逻辑回归模型的算法,可避免对大系数的过度拟合[12]:
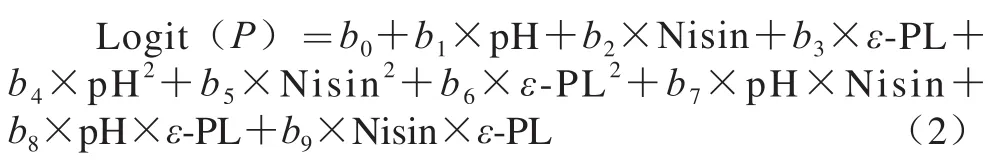
式(2)中:bi(i=0~9)为拟合参数。
1.3.4.2 模型评价与验证
模型评价:评价指标主要包括R2-Nagelkerke和Hosmer-Lemeshow。Hosmer-Lemeshow测试常用来评估模型的拟合优度及任意数量的连续与分散的解释变量,其值越小拟合效果越好。R2-Nagelkerke值主要反映了解释变量与响应变量间的关系,其值越接近1,拟合优度越好[12]。预测正确率(fraction correct,FC)是指预测值与实际值一致样本占总样本数量的百分比,可用来评价模型预测精度[28]。
模型验证:选取表1中36 例验证集,代入建立的Logistic模型中,采用C-matrix获得FC,验证模型的准确度。

式(3)中:FC=(a+d)/(a+b+c+d)。
1.4 数据分析
模型拟合通过SPSS 18.0(美国IBM公司),并通过Origin 9.0(美国OriginLab公司)绘制生长概率等高线图(选取概率Pi(i=1~9)为0.1~0.9时的预测值)。
2 结果与分析
2.1 生长/非生长模型构建及验证
2.1.1 Logistic回归模型构建及评价
枯草芽孢杆菌2 种生长/非生长模型的拟合参数见表2。采用简单Logistic回归模型,pH值、ε-PL与Nisin对枯草芽孢杆菌生长/非生长影响显著(P<0.05);采用多项式Logistic回归模型,pH值、ε-PL与Nisin对枯草芽孢杆菌生长/非生长影响亦显著(P<0.05)。
简单Logistic回归模型:

多项式Logistic回归模型:


表2 Logistic模型拟合参数及拟合优度比较Table 2 Comparison of parameters and goodness of fit between simple and polynomial Logistic models

表3 两种模型拟合优度评价和验证Table 3 Goodness of fit evaluation and verification of simple and polynomial Logistic models
表3 为两种模型拟合优度评价。R2-Nagelkerke是评价模型拟合度的指标;Hosmer-Lemeshow检验表明,测试P值越大,χ2值越小,模型拟合优度越高[28]。由表3可知,多项式Logistic模型的R2-Nagelkerke为0.91,高于简单Logistic模型R2-Nagelkerke为0.79,说明多项式Logistic模型拟合优度高于简单Logistic模型,枯草芽孢杆菌生长/非生长拟合效果更好。比较Hosmer-Lemeshow结果亦得出,多项式Logistic模型(χ2=0.76,P=1)拟合效果优于简单Logistic模型(χ2=2.00,P=0.981),多项式Logistic模型拟合效果优于简单Logistic模型。
2.1.2 生长/非生长模型的验证
FC一般用以反映模型的预测能力,通常作为模型预测准确度的评价指标,反映预测值和实际值的一致性[14]。由表3可见,简单Logistic模型训练集FC为65.2%,验证集FC为61.8%,训练集和验证集的FC较接近,但FC较低,说明该模型预测准确度较低。多项式Logistic模型的训练集和验证集的FC分别为87.4%和84.1%,两者较接近,对于同一性质的数据预测准确度较高。从验证集看,FC值越高,代表模型对验证集的预测准确度较高。
2.2 环境因子对枯草芽孢杆菌生长/非生长的作用
2.2.1 Nisin对枯草芽孢杆菌生长/非生长的作用
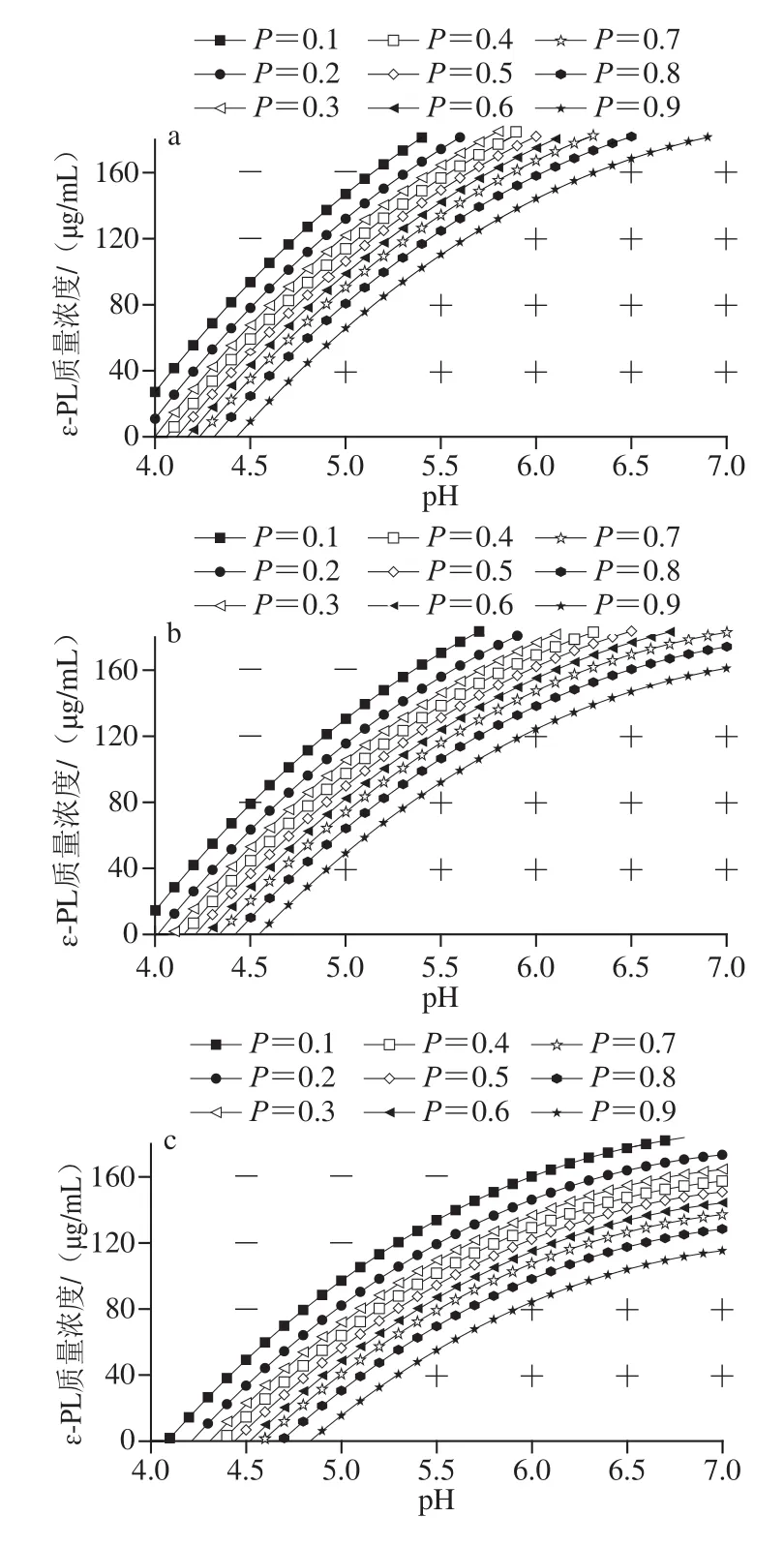
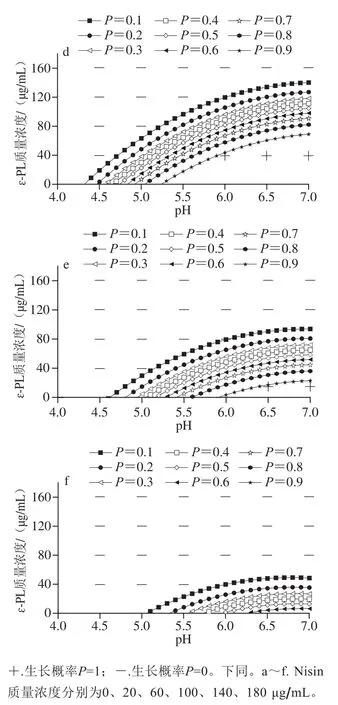
图1 不同Nisin质量浓度下枯草芽孢杆菌生长/非生长界面图Fig. 1 Growth/no growth boundaries at different concentrations of nisin for B. subtilis
图1 为Nisin对枯草芽孢杆菌生长概率的影响,根据模型拟合出生长概率P为0.1~0.9的分界线,P=1表明该条件下适宜生长;P=0说明该区域条件下Nisin、ɛ-PL和pH值的交互作用对枯草芽孢杆菌有较好的抑制作用,该条件下不适宜生长。随着Nisin质量浓度增加,枯草芽孢杆菌非生长区变大,其生长受到抑制,Nisin质量浓度对枯草芽孢杆菌的生长/非生长情况影响显著(P<0.05)。
图1 a~c中,根据非生长区大小可知,Nisin质量浓度≤60 μg/mL时,Nisin对枯草芽孢杆菌生长/非生长界面的影响较小,ɛ-PL质量浓度越高则生长区越小,pH值越接近7.0则生长区越大;图1d~f中,Nisin质量浓度大于60 μg/mL时,Nisin是影响枯草芽孢杆菌生长/非生长界面的主要因素。随Nisin质量浓度的增加,生长概率等高线图逐渐变缓,说明pH值与ɛ-PL质量浓度的交互作用中pH值的影响减弱,ɛ-PL质量浓度的影响增强。无论ɛ-PL质量浓度为何值,Nisin质量浓度为60、100、140、180 μg/mL时,枯草芽孢杆菌在pH值分别为4.0、4.25、4.5、5.0时表现为不生长。随pH值增大至7.0,图1c中Nisin质量浓度为60 μg/mL时,生长概率在ɛ-PL质量浓度为90 μg/mL时达到0.98;图1d中Nisin质量浓度为100 μg/mL时,生长概率在ɛ-PL质量浓度为60 μg/mL时达到0.94;图1e中当Nisin质量浓度为140 μg/mL时,ɛ-PL质量浓度为20 μg/mL,生长概率为0.92;图1f中当Nisin质量浓度达到180 μg/mL时,生长概率在ɛ-PL质量浓度为20 μg/mL时仅为0.40。随Nisin质量浓度增加,生长/非生长界限向更高ɛ-PL质量浓度、更低pH值方向移动。Nisin在本次实验中表现出对枯草芽孢杆菌生长/非生长界面的影响,其背后机理可能为Nisin中ATP结合盒转运蛋白对枯草芽孢杆菌等细菌起到抗菌作用[29]。枯草芽孢杆菌的生长区随Nisin质量浓度的增加而变小,这与Boziaris等[16]研究NaCl、KC、pH值及Nisin对单核细胞性李斯特菌生长/非生长边界的影响结果较为相似,其结果显示增加Nisin质量浓度显著影响生长/非生长界面,导致单核细胞性李斯特菌Scott A非生长区增大,Nisin的存在导致单核细胞性李斯特菌Scott A更受抑制;因此,结合生长/非生长界面模型对调控Nisin与pH值间的交互作用,以及靶向控制熟制水产品中的腐败菌具有重要意义。
2.2.2ɛ-PL对枯草芽孢杆菌生长/非生长的作用
由图2可知,与Nisin对枯草芽孢杆菌生长/非生长界面的作用类似,ɛ-PL对其生长/非生长情况影响显著,即随着ɛ-PL质量浓度增加,枯草芽孢杆菌非生长区变大,其生长受到抑制越强。由图2可知,随ɛ-PL质量浓度的增加,生长概率等高线图也逐渐变缓,说明pH值与Nisin质量浓度交互作用中Nisin占主导作用,且Nisin与ɛ-PL的交互作用增强。无论Nisin质量浓度为何值,ɛ-PL质量浓度为60、100、140、180 μg/mL时,枯草芽孢杆菌在pH值分别为4.0、4.5、4.75、5.25时生长概率为0。随pH值增大至7.0,图2c中当ɛ-PL质量浓度为60 μg/mL时,生长概率在Nisin质量浓度为90 μg/mL时达到0.97;图2d中当ɛ-PL质量浓度为100 μg/mL时,生长概率在Nisin质量浓度为50 μg/mL时达到0.98;图2e中当ɛ-PL质量浓度为140 μg/mL时,Nisin质量浓度为20 μg/mL时,生长概率为0.97;图2f中当ɛ-PL质量浓度达到180 μg/mL时,生长概率在Nisin质量浓度为20 μg/mL时仅为0.73。若ɛ-PL质量浓度不断增加,生长/非生长界限向更高Nisin质量浓度、更低pH值方向移动。综上,ɛ-PL对枯草芽孢杆菌表现出较好的抑制作用,与蔡瑞等[30]研究得出ɛ-PL对芽孢杆菌属具有显著抑制效果结论相似,当添加量为最小抑菌质量浓度(1.25~5 mg/L)时,对芽孢杆菌属菌数减少量为1~2 个数量级,与Sun Haitao等[31]通过浇铸法将Nisin(质量分数0.25%~0.5%)和ɛ-PL(质量分数0.2%)掺入玉米磷酸二淀粉/纳米纤维素薄膜中制备抑菌生物纳米复合薄膜,结果表明结合Nisin和ɛ-PL的纳米纤维素薄膜生物纳米复合膜对革兰氏阳性菌(金黄色葡萄球菌)和革兰氏阴性菌(大肠杆菌)具有协同抑菌活性也较为一致。ɛ-PL作用机理主要呈现为导致细菌质壁分离,菌体塌陷及细胞质溢出等现象[19],而ɛ-PL与Nisin、pH值交互作用下对枯草芽孢杆菌的内在抑菌机制仍需进一步研究。
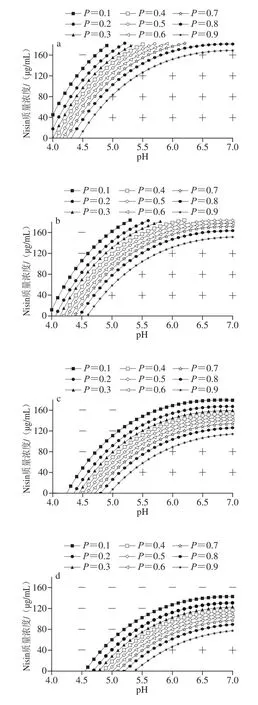

图2 不同ɛ-PL质量浓度下枯草芽孢杆菌生长/非生长界面图Fig. 2 Growth/no growth boundaries at different concentrations of ɛ-polylysine for B. subtilis
2.2.3 pH值对枯草芽孢杆菌生长/非生长的作用
由图3可知,pH值由7.0逐渐调至4.0,枯草芽孢杆菌非生长区逐步扩大,pH值抑制作用增强。当pH值低于5.0,枯草芽孢杆菌的生长受到强烈抑制(非生长区/生长区>1)。图3a中,当pH值为4.0时,pH值是影响枯草芽孢杆菌生长的主要因素;图3b~d中,当pH≥5.0时,Nisin与ɛ-PL的交互作用影响加强。同时,随pH值的升高,生长概率等高线逐渐变陡,可能是Nisin与ɛ-PL的交互作用中,ɛ-PL的影响减小,Nisin的影响增强导致的。pH值对枯草芽孢杆菌生长/非生长情况影响显著(P>0.05)。pH值越低,Nisin与ɛ-PL的交互作用被减弱,枯草芽孢杆菌越不适宜生长,生长/非生长界限开始变化点向低浓度生物因子(Nisin与ɛ-PL)范围移动。
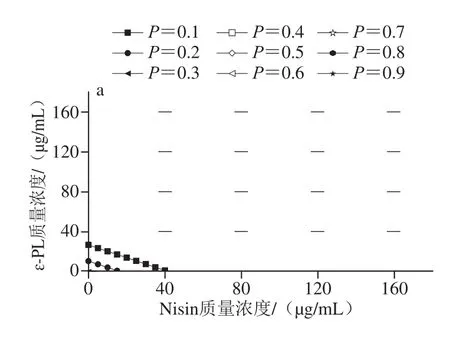

图3 不同p值下枯草芽孢杆菌生长/非生长界面图Fig. 3 Growth/no growth boundaries at different pH for B. subtilis
pH值下降会改变细胞膜通透性[26],造成微生物新陈代谢有关酶失活[32],进而导致微生物死亡。有学者指出pH值对枯草芽孢杆菌的生长和失活等影响显著,如Balasubramanian等[33]研究了热-压力-pH值(4.0~7.0)的交互效应下柠檬酸盐-磷酸盐缓冲液中枯草芽孢杆菌ATCC 6633孢子的失活过程,结果显示当孢子分别悬浮在pH 5.0和pH 3.0的缓冲溶液中,孢子数量能减少约为6 个和7 个对数值。于枯草芽孢杆菌而言,pH值低于5.0时,Nisin与ɛ-PL的交互作用逐渐受到影响,此时pH值为影响生长/非生长边界的主导因素。Vermeulen等[34]研究了pH值、水分活度及乙酸对单核细胞性李斯特菌的生长/非生长情况,pH值越小,非生长区范围变大,生长概率降低,生长/非生长界面往更低乙酸质量分数(0%~0.4%)、更高水分活度(0.960~0.990)方向偏移,这也与本研究结果一致。考虑到产品安全性及感官品质的可接受性,例如为避免水产品或酸性食品中肉毒杆菌中毒的危害,pH 4.6通常被普遍接受为达到安全剂量的最小值[35];有研究者[15]在调味软烤扇贝中发现,pH值在5.7~5.9时,有一定去腥效果且酸感不明显,而当pH值低于5.5时,酸感较显著。因此,结合生长/非生长界面模型,调节适当pH值并结合产品感官品质特征在熟制水产品的加工及应用中也具有一定参考价值。
3 结 论
研究源自熟制南美白对虾的优势腐败菌(枯草芽孢杆菌)37 ℃条件下,pH值、Nisin及ɛ-PL的交互作用对其生长概率的影响,通过简单Logistic和多项式Logistic方程拟合生长/非生长模型,并对模型进行了评价和验证,比较3 种抑菌因子对枯草芽孢杆菌的生长抑制效用,主要结论如下:1)建立了枯草芽孢杆菌简单Logistic和多项式Logistic生长/非生长模型,可预测pH值、Nisin及ɛ-PL作用下的枯草芽孢杆菌生长概率。简单Logistic模型与多项式Logistic模型训练集FC、R2-Nagelkerke及Hosmer-Lemeshow测试结果得出,多项式Logistic模型拟合效果优于简单Logistic模型,表明多项式Logistic生长/非生长模型能更好预测pH值、Nisin及ɛ-PL作用下枯草芽孢杆菌的生长概率。2)随Nisin质量浓度、ɛ-PL质量浓度增加或pH值的降低,生长区域逐渐减小,非生长区域逐渐扩大,枯草芽孢杆菌的生长受到抑制。当Nisin质量浓度增加,枯草芽孢杆菌的生长/非生长界限往更高ɛ-PL质量浓度、更低pH值方向移动。无论第3种因子质量浓度为何值,当Nisin质量浓度为60、100、140、180 μg/mL时,枯草芽孢杆菌在pH值分别为4.0、4.25、4.5、5.0时表现为不生长。ɛ-PL质量浓度为60、100、140、180 μg/mL时,枯草芽孢杆菌在pH值分别为4.0、4.5、4.75、5.25时生长概率为0。当pH<5.0时,枯草芽孢杆菌的生长受到较强抑制,此时pH值是影响枯草芽孢杆菌生长/非生长界限的主要因素。
综上,通过构建水产品中腐败菌/致病菌的生长/非生长模型,在预测和控制微生物安全和产品品质等方面具有重要参考价值,为实际生产中有效预测风险概率提供指导。由于水产品原料、加工、流通、销售过程中影响因素的复杂性及不确定性,仍需根据产品特性和关键控制点导入更多调控因子,并对其协同/拮抗效应作进一步研究。
