高选择性过氧化亚硝酰荧光探针的合成及性能研究
2020-12-06后际挺王冰雅郑凌云
后际挺 王冰雅 郑凌云

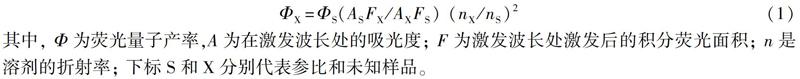
摘 要 过氧化亚硝酰(ONOO)是生物体系中重要活性氧之一,对其高效检测一直备受关注。本研究以4-二乙基氨基水杨醛和6-甲氧基-1-萘满酮为原料,经一步有机反应,合成了一种带氧鎓正离子的荧光探针PFP,用于检测ONOO。通过紫外-可见吸收光谱和荧光发射光谱系统考察了探针PFP对ONOO的光学响应。结果表明,此探针具有选择性好、灵敏度高(检出限为15.5 nmol/L)、响应快速(数秒内)、Stokes位移较大(42 nm)、水溶性好等优点。细胞毒性实验表明,探针PFP具有良好的生物相容性,探针浓度为20 μmol/L时,细胞存活率>95%。激光扫描共聚焦显微成像结果表明,此探针可用于活细胞中外源性和内源性ONOO的荧光成像研究。
关键词 荧光探针; 活性氧; 过氧化亚硝酰; 细胞成像
1 引 言
作为细胞内活性氧(Reactive oxygen species,ROS)之一,过氧化亚硝酰(ONOO)是由一氧化氮(NO)和超氧根自由基(O·2)以1∶1的化学计量比,通过扩散控制的反应方式生成(k = 0.4×1010~1.9 ×1010 L/(mol s))[1]。由于其强氧化性,ONOO具有抗微生物和抗菌活性[2]; 同时,ONOO在细胞信号传导过程中起着重要作用[3]。然而,细胞内过度表达的ONOO可引起生物大分子损伤,如DNA和蛋白质的硝化失活[4~6]; 另外,ONOO还可引起线粒体功能失调。近年的研究表明, ONOO参与多种病理生理过程,如心血管疾病、炎症、癌症、药物引起的肝中毒等[7~10],因此,ONOO被认为是一种疾病诊断的生物标志物[10]。
基于ONOO重要的生理功能,开发可靠有效的ONOO检测手段具有十分重要的意义。目前,由于其高灵敏性、非侵入性成像、高时空分辨率等优点[11~15],荧光分析法已成为检测生物体系中ONOO的最有效手段[16~18]。自2006年Yang等首次报道高选择性ONOO荧光探针以来[19],研究者合成了许多不同性能的荧光探针, 用于ONOO的检测及生物成像研究[20~32]。这些探针与ONOO的作用模式主要有:硫属化合物的氧化[20,21]、硼酸或硼酸酯的氧化水解[22,23]、肼的氧化水解[24,25]、活性CC双键的氧化裂解[26,27]和N-氧化去芳基化[28,29]。虽然这些探针对ONOO表现出良好的光学响应,且已在生物体系中得到了较为广泛的应用,但都存在一些问题。例如,硼酸酯或硼酸类探针的水溶性较差并且易受HOCl和H2O2的干扰[18]; 含活性CC双键的探针则易受亲核性物质(如SO23)的影响[33,34]。此外,目前报道的大多数ONOO荧光探针的最大发射波长λmax<600 nm,易受细胞内背景荧光信号干扰,不利于活体成像。因此,开发具有良好水溶性、高选择性及长波发射(λem>600 nm)的荧光探针用于ONOO的生物成像,仍然具有挑战性。
自2014年以来,本研究组先后以香豆素-吡啶盐和香豆素-喹啉盐为探针平台,通过活性CC双键的氧化裂解途径,实现了ONOO的荧光检测[35,36]。该系列探针具有良好的水溶性和选择性,但其λmax仅约为490 nm,不利于高信噪比荧光成像。最近,本研究组利用吩噻嗪衍生物构建了一个比率荧光探针,与ONOO作用后,λmax可从630 nm蓝移至480 nm,然而该探针水溶性较差,需要使用表面活性剂Triton X-100作为助溶剂[37]。
考虑到上述工作的不足,本研究以水杨醛和萘酮为原料,通过一步缩合反应制备了一种检测ONOO的新型荧光探针PFP。此探针带有一个正电荷,具有极佳的水溶性; 同时,D-A-D电子结构使此探针在628 nm处具有较强荧光。此探针与ONOO反应后得到无荧光的产物,从而实现对ONOO的长波检测。此探针被成功用于活细胞中外源性和内源性ONOO的荧光成像,在ONOO生理功能研究方面具有潜在的应用价值。
2 实验部分
2.1 仪器与试剂
JEOL ECZ600R/S3 600 MHz核磁共振仪(日本Jeol Resonance公司,TMS为内标); Xevo G2-XS QTof质谱仪(美国Waters公司); UV-3900型分光光度计(日本日立公司); FLS 1000型荧光光谱仪(英国爱丁堡仪器公司); Leica TCS SP8动态超高分辨单双光子激光共聚焦联用系统(德国徕卡公司)。
4-二乙基氨基水杨醛(Ark试剂公司); 6-甲氧基-1-萘满酮(安耐吉试剂公司); 5-氨基-3-(4-吗啉基)-1,2,3-恶二唑鎓盐酸盐(3-Morpholinosydnonimine,SIN-1,阿拉丁试剂公司); 脂多糖(Lipopolysaccharide,LPS)和干扰素(Interferon-γ, IFN-γ)(北京索莱宝科技有限公司)。实验用水为二次蒸馏水。
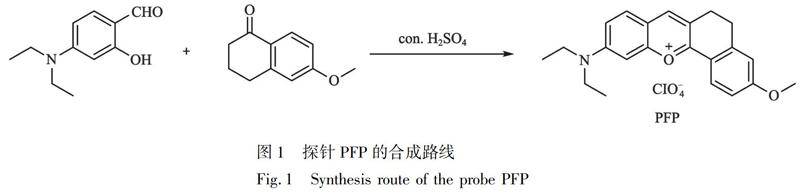
2.2 探针PFP的合成
合成路线参照文献[38]并稍作改动。具体合成路线如图1所示,将4-二乙基氨基水杨醛(1.93 g,10 mmol)和6-甲氧基-1-萘滿酮(1.76 g, 10 mmol)溶于20 mL浓H2SO4(98%),Ar保护下于90℃反应5 h。反应结束后,冷却至室温,然后倒入约200 g冰中。搅拌下缓慢加入HOCl4(70%,10 mL),将所得沉淀抽滤,并先后用大量水和少量丙酮洗涤滤渣。干燥后,得2.8 g深红色固体PFP,产率为65%。1H NMR (600 MHz, DMSO-d6) δ (ppm): 8.58 (s, 1H), 8.30 (s, 1H), 7.87 (d, J=9.3 Hz, 1H), 7.39 (d, J=9.1 Hz, 1H), 7.32 (s, 1H), 6.88 (s, 1H), 3.67 (q, J=6.7 Hz, 4H), 3.40 (s, 3H), 2.97 (s, 4H), 1.20 (t, J=6.9 Hz, 6H)。13C NMR(150 MHz, DMSO-d6) δ (ppm): 163.47, 159.73, 158.62, 155.75, 148.66, 146.44, 132.32, 131.55, 126.34, 120.94, 118.37, 118.18, 118.03, 117.45, 96.37, 45.89, 26.81, 25.06, 16.76, 12.98。TOF MS: calcd. for C22H24NO+2 334.1802, found 334.1811。
2.3 ROS溶液配制
O·2:用CaH2预干燥二甲亚砜(DMSO)过夜,然后将其离心(3000 r/min, 20 min),得到无水DMSO后,加入KO2,超声溶解。
羟基自由基(·OH):利用FeCl2和过量的H2O2现配现用。
ONOO:将20 mL HCl(0.6 mol/L)和H2O2(0.7 mol/L)的混合溶液与20 mL NaNO2溶液(0.6 mol/L)迅速倒入到冰块上,1 s内倒入20 mL冷的NaOH溶液(1.2 mol/L)。溶液颜色由无色变为黄色,然后加入30 mg MnO2除去多余的H2O2,密封,置于20℃保存。利用紫外-可见吸收光谱标定其最终浓度(ε302=1670 L/(mol cm))。
H2O2: 将30% H2O2稀释,通过紫外-可见吸收光谱标定其最终浓度(ε240=43.6 L/(mol·cm))。
ClO: 将5% NaOCl稀释,通过紫外-可见吸收光谱标定其最终浓度(ε292=350 L/(mol·cm))。
TBHP(tBuOOH): 将70% TBHP溶液稀释至最终浓度为20 mmol/L。
2.4 探针PFP的合成
荧光量子产率的测定在PBS溶液中进行。使用罗丹明B(ΦS=0.69,甲醇作为溶剂)作为参比。荧光量子产率通过公式(1)计算:
其中, Φ为荧光量子产率,A为在激发波长处的吸光度; F为激发波长处激发后的积分荧光面积; n是溶剂的折射率; 下标S和X分别代表参比和未知样品。
2.5 光谱测定
配制探针的DMSO母液(5 mmol/L),在磷酸盐缓冲液(PBS,pH 7.2~7.4,10 mmol/L)中进行光谱测试。探针浓度为10 μmol/L,激发波长为568 nm,激发和发射狭缝宽度均为1 nm。选择性实验中,所需各种底物浓度均为100 μmol/L。
2.6 细胞成像实验
外源性:将人乳腺癌细胞(MCF-7)置于37℃、5% CO2的培养箱中培养。在进行荧光成像实验之前,细胞用PBS清洗3次,然后加入10 μmol/L PFP培养30 min。用PBS清洗3次后,加入100 μmol/L SIN-1继续培养30 min,用PBS清洗3次后,在激光共聚焦荧光成像仪下成像。
内源性:将MCF-7细胞置于37℃、5% CO2的培养箱中培养。在进行荧光成像实验之前,在细胞中加入LPS(1 μg/mL)以及IFN-γ(50 ng/mL)培养 24 h。加入10 μmol/L PFP继续培养30 min后, 细胞用PBS清洗3次,在激光共聚焦荧光成像仪下成像。
成像所用激发波长为559 nm,收光窗口为600~660 nm。
3 结果与讨论
3.1 探针的选择性
考察了探针PFP对活性物质的选择性。当探针浓度为10 μmol/L时,PFP在PBS缓冲液中溶解性良好,最大吸收波长位于586 nm(ε=29500 L/(mol·cm))。如图2所示,向探针溶液加入10倍摩尔比常见的细胞内ROS时,包括O·2、·OH、ONOO、H2O2、ClO及TBHP,发现在ONOO存在下,探针在586 nm处的吸收几乎完全消失; ClO可以引起探针吸收部分减弱,其它ROS则对探针的吸收光谱不产生影响。由于探针分子中存在氧鎓正离子,因此考察了亲核性物质(包括S2、SO23、半胱氨酸(Cys)和谷胱甘肽(GSH))对探针结构的影响。结果表明,这些亲核性物质与探针分子不发生反应。荧光发射光谱(图2B)显示,PFP在628 nm具有强烈的荧光发射峰,Stokes位移为42 nm。传统的长波荧光染料(如花菁、甲基蓝)通常具有较短Stokes位移(~20 nm),这导致其用于生物荧光成像实验时常出现窜光干扰。相比之下,PFP具有更大的Stokes位移,有利于荧光成像应用。类似于吸收光谱中的现象,在ONOO作用下,PFP的荧光完全被猝灭(图3A); ClO引起探针荧光强度略微增强,而其它活性物质对探针发射光谱的影响很小,可忽略不计。另外,向ONOO及其它物质的混合溶液中加入探针分子,依然可观察到明显的荧光猝灭现象(图3B),说明探针对ONOO的检测能力基本不受其它物质的影响。综上,探针对ONOO具有良好的选择性和抗干扰检测能力。
3.2 探针对ONOO的识别性能研究
考察了探针的吸收光谱和发射光谱随ONOO浓度的变化趋势。如图4所示,随着ONOO浓度从0 μmol/L逐渐增加到200 μmol/L,探针在586 nm处的吸收峰逐渐消失,颜色从紫红色逐渐变为浅紫色。另一方面,探針在628 nm处的荧光强度也逐渐减弱,荧光量子产率从0.13降至0.03。
由图5A中的荧光滴定曲线可见,在ONOO作用下,探针荧光的猝灭速率由快到慢; 当ONOO浓度高于50 μmol/L时,探针的荧光强度基本不再变化,此时猝灭效率达到98%,说明探针已与ONOO完全反应。如图5B所示,当ONOO浓度在0.1~5.0 μmol/L之间时,探针在628 nm处的荧光强度与ONOO浓度呈线性关系,线性方程为y=86.5-24.9x(R2=0.999),检出限(3σ/k, 其中,σ为扫描探针溶液10次得到的荧光强度的标准偏差,k为探针荧光强度与底物浓度呈线性作用区间的斜率)为15.5 nmol/L, 与文献报道数值相当(表1),说明此探针对ONOO具有较高灵敏度。
3.3 探针对ONOO的细胞成像实验
将此探针用于活细胞内ONOO的荧光成像研究。利用四唑盐(3-(4,5)-Dimethylthiahiazo (-z-y1)-3,5-di-phenytetrazoliumromide,MTT)比色法,对PFP的细胞毒性进行评价。将不同浓度探针与MCF-7细胞培养24 h后,发现探针浓度达到20 μmol/L时,细胞存活率依然大于95%,表明此探针具有良好的生物相容性(图7)。
考虑到细胞内pH范围在4~8之间,为了探究细胞内不同区域pH值对探针荧光是否产生影响,在进行细胞成像实验之前,测试了探针在pH=4和pH=8条件下的稳定性。如图7B所示,探针在pH值不同的两种溶液中持续光照1 h后,其荧光强度基本不变,表明PFP适用于细胞内成像。随后,检测了探针对细胞外源性ONOO的荧光成像能力。如图8所示,将MCF-7细胞与10 μmol/L探针培养30 min后,可观察到细胞内出现强烈的红色荧光,且荧光主要分布在细胞核外,说明PFP具有良好的细胞膜渗透性。SIN-1在水溶液中易缓慢分解,在O2存在下生成NO和O·2,进而生成ONOO[40]。将细胞与探针预孵育30 min后,再与SIN-1培养30 min,细胞内红色荧光明显减弱,说明SIN-1促进了细胞内ONOO浓度升高,从而导致探针被消耗,荧光消失。
由于ONOO是一种细胞内源性ROS,因此考察了探针对LPS和IFN-γ刺激下细胞内ONOO浓度变化的成像能力。LPS和IFN-γ能够诱导细胞表达一氧化氮合成酶(NOS2),从而促进细胞内ONOO水平的升高[20]。如图9所示,将细胞与LPS和IFN-γ孵育24 h后,再与探针培养30 min,红色荧光几乎消失,说明探针可以对细胞受刺激下产生的ONOO进行灵敏的荧光成像。
4 结 论
合成了一种带氧鎓正离子的荧光染料。此染料可发射628 nm强烈红色荧光,与ONOO反应后, 荧光被猝灭。此探针具有响应快速、选择性好、灵敏度高、水溶性好、Stokes位移较大、细胞毒性低等优点。可能由于探针与ONOO反应较为复杂,本研究未能成功鉴定氧化产物,反应机制有待深入探究。与荧光增强型探针相比,此探针由于本身具有强荧光,可以直观地观察其细胞膜渗透性及细胞内分布等。本研究将此探针成功应用于活细胞中外源性和内源性ONOO的荧光成像研究。此探针在细胞及活体层面上的相关病理生理过程中ONOO的荧光示踪方面具有潜在的应用价值。
References
1 Szabo C, Ischiropoulos H, Radi R. Nat. Rev. Drug Discov., 2007, 6(8): 662-680
2 Radi R. J. Biol. Chem., 2013, 288(37): 26464-26472
3 Liaudet L, Vassall G, Pacher P. Front. Biosci., 2009, 14: 4809-4814
4 Kaur H, Halliwell B. FEBS Lett., 1994, 350(1): 9-12
5 Dean R T, Fu S, Stocker R, Davies M J. Biochem. J., 1997, 324(1): 1-18
6 Kawasaki H, Ikeda K, Shigenaga A, Baba T, Takamori K, Ogawa H, Yamakura F. Free Radical Biol. Med., 2011, 50(3): 419-427
7 Levrand S, Vannay-Bouchiche C, Pesse B, Pacher P, Feihl F, Waeber B, Liaudet L. Free Radical Biol. Med., 2006, 41(6): 886-895
8 Wiseman H, Halliwell B. Biochem. J., 1996, 313(1): 17-29
9 Kossenjans W, Eis A, Sahay R, Brockman D, Myatt L. Am. J. Physiol-Heart Circ. Physiol., 2000, 278(4): H1311-H1319
10 Shuhendler A J, Pu K, Cui L, Uetrecht J P, Rao J. Nat. Biotechnol., 2014, 32(4): 373-380
11 Hou J T, Yu K K, Sunwoo K, Kim W Y, Koo S, Wang J, Ren W X, Wang S, Yu X Q, Kim J S. Chem, 2020, 6(4): 832-866
12 WANG Xiao-Li, YAO Meng, LI Yin, WEI Chao, WANG Mei. Chinese J. Anal. Chem., 2019, 47(12): 1915-1921
王肖莉, 姚 猛, 李 引, 魏 超, 王 美. 分析化學, 2019, 47(12): 1915-1921
13 Xiao H, Zhang W, Li P, Zhang W, Wang X, Tang B. Angew. Chem. Int. Ed., 2020, 59(11): 4216-4230
14 Wu X, Shi W, Li X, Ma H. Acc. Chem. Res., 2019, 52(7), 1892-1904
15 Yang J, Chi Z, Zhu W, Tang B Z, Li Z. Sci. China Chem., 2019, 62(9): 1090-1098
16 Prolo C, Rios N, Piacenza L, Alvarez M N, Radi R. Free Radical Biol. Med., 2018, 128: 59-68
17 Wang S, Chen L, Jangili P, Sharma A, Li W, Hou J T, Qin C, Yoon J, Kim J S. Coord. Chem. Rev., 2018, 374: 36-54
18 Bai X, Ng K K H, Hu J J, Ye S, Yang D. Annu. Rev. Biochem., 2019, 88: 605-633
19 Yang D, Wang H L, Sun Z N, Chung N W, Shen J G. J. Am. Chem. Soc., 2006, 128(18): 6004-6005
20 Yu F, Li P, Wang B, Han K. J. Am. Chem. Soc., 2013, 135(20): 7674-7680
21 Yudhistira T, Mulay T S V, Lee K J, Kim Y, Park H S, Churchill D G. Chem. Asian J., 2017, 12(15): 1927-1934
22 Song Z, Mao D, Sung S H P, Kwok R T K, Lam J W Y, Kong D, Ding D, Tang B Z. Adv. Mater., 2016, 28(33): 7249-7256
23 Hu J S, Shao C, Wang X, Di X, Xue X, Su Z, Zhao J, Zhu H L, Liu H K, Qian Y. Adv. Sci., 2019, 6(15): 1900341
24 Li H, Li X, Wu X, Shi W, Ma H. Anal. Chem., 2017, 89(10): 5519-5525
25 Zhu B, Zhang M, Wu L, Zhao Z, Liu C, Wang Z, Duan Q, Wang Y, Jia P. Sens. Actuators B, 2018, 257: 436-441
26 Jia X T, Chen Q Q, Yang Y F, Tang Y, Wang R, Xu Y F, Zhu W P, Qian X H. J. Am. Chem. Soc., 2016, 138(34): 10778-10781
27 Zhang W, Liu J, Li P, Wang X, Bi S, Zhang J, Zhang W, Wang H, Tang B. Biomaterials, 2019, 225: 119499
28 Peng T, Chen X M, Gao L, Zhang T, Wang W, Shen J G, Yang D. Chem. Sci., 2016, 7(8): 5407-5413
29 Cheng J, Li D, Sun M, Wang Y, Xu Q Q, Liang X G, Lu Y B, Hu Y, Han F, Li X. Chem. Sci., 2020, 11(1): 281-289
30 Cheng D, Peng J, Lv Y, Su D, Liu D, Chen M, Yuan L, Zhang X. J. Am. Chem. Soc., 2019, 141(15): 6352-6361
31 Xie X L, Liu G Z, Su X X, Li Y, Liu Y W, Jiao X Y, Wang X, Tang B. Anal. Chem., 2019, 91(10): 6872-6879
32 JiangW L, Li Y, Wang W X, Zhao Y T, Fei J, Li C Y. Chem. Commun., 2019, 55(95): 14307-14310
33 Zhou X, Kwon Y, Kim G, Ryu J H, Yoon J. Biosens. Bioelectron., 2015, 64: 285-291
34 Xu W, Teoh C L, Peng J, Su D, Yuan L, Chang Y T. Biomaterials, 2015, 56: 1-9
35 Hou J T, Yang J, Li K, Liao Y X, Yu K K, Xie Y M, Yu X Q. Chem. Commun., 2014, 50(69): 9947-9950
36 HOU Ji-Ting, LI Kun, QIN Cai-Qin, YU Xiao-Qi. Sci. Sin. Chim., 2019, 49(2): 346-352
后際挺, 李 坤, 覃彩芹, 余孝其. 中国科学: 化学, 2019, 49(2): 346-352
37 Hou J T, Wang B, Zhang Y, Cui B, Cao X, Zhang M, Ye Y, Wang S. Chem. Commun., 2020, 56(18): 2759-2762
38 Shang H M, Chen H, Tang Y, Ma Y, Lin W. Sens. Actuators B, 2017, 95: 81-86
39 Ferrer-Sueta G, Radi R. ACS Chem. Biol., 2009, 4(3): 161-177
40 Li C Q, Trudel L J, Wogan G N. Chem. Res. Toxicol., 2002, 15: 527-535
