基于介孔结构的上转换分子印迹荧光探针检测全氟辛烷磺酸
2020-12-06李晶郭会琴于慧田凌溪颜流水刘小明林立钶汪嘉琳
李晶 郭会琴 于慧 田凌溪 颜流水 刘小明 林立钶 汪嘉琳

摘 要 全氟辛烷磺酸(Perfluorooctane sulfonate,PFOS)作为环境中最典型的全氟化合物之一,具有持久性、毒性及在生物体内积累等效应。发展快速、灵敏检测环境介质中PFOS的分析方法具有重要意义。本研究以PFOS为模板分子,N,O-双(三甲基硅烷基)三氟乙酰胺为功能单体,设计合成了具有介孔结构的表面分子印迹荧光探针NH2-UCNPs@MIPs。PFOS可通过F-F与静电相互作用与NH2-UCNPs@MIPs结合,导致其荧光猝灭,基于此建立了水溶液中PFOS(0.01~15 nmol/L浓度范围内)的高效识别和高灵敏检测技术,并实现了在酸性和中性条件下,对环境水样和人血清基质样品中痕量PFOS的检测。本研究为复杂基质中PFOS的快速检测提供了参考。
关键词 上转换荧光; 全氟辛烷磺酸; 表面分子印迹; 氟-氟相互作用; 血清
1 引 言
全氟辛烷磺酸 (Perfluorooctane sulfonate,PFOS)是由疏水疏脂的全氟烷基链和极性的磺酸基组成,是一种新型的持久性有机污染物[1]。PFOS的独特结构使其对生物和化学降解具有出色的抵抗能力[2],一旦排放到环境中,很难被降解。研究表明,即使微量的PFOS也可能对人体肝脏、肾脏造成严重的功能损害,对脂肪酸代谢、生殖系统、激素分泌系统产生不良影响[3,4]。由于PFOS在环境中存在的广泛性以及对生物体的危害,2009年PFOS被列入《斯德哥尔摩公约》,限制其在全球的生产和使用。2016年,美国环境保护署(EPA)设定了饮用水中PFOS终身暴露的健康咨询水平(Health advisory level,HAL)为70 ng/L[5]。 而我国仅规定饮用水中氟化物含量不得超过1.0 mg/L,尚未制定对单体PFOS的污染控制浓度限制[6]。 然而,在全世界不同地区的地表水环境以及生物样品中均有PFOS檢出[1],因此,开发PFOS的检测分析方法对于监控水质安全及风险暴露途径具有重要意义。
目前,PFOS常用的检测技术为色谱-质谱联用技术[7~10],但其存在仪器操作复杂、仪器使用和维护成本较高, 以及对操作人员要求较高等问题。研究者不断探索简便快速的检测方法,其中, 荧光法由于具有操作简便、分析速度快、灵敏度高等优点而备受关注。目前,荧光法检测PFOS使用的发光材料主要为有机染料[11]和碳点[12]等。稀土上转换材料具有毒性低、化学稳定性高、光稳定性好、吸收和发射带窄、寿命长等优点[13,14],基于其构建的荧光探针已引起广泛关注。本研究组曾通过在NaYF4∶Yb,Er纳米材料表面简单包覆含氟硅烷化试剂,并基于材料表面与PFOS之间的FF相互作用,构建了对PFOS具有较好响应的荧光探针,但所构建探针仍存在对PFOS检测灵敏度和选择性不高等问题[15]。
分子印迹技术(Molecularly imprinting technology,MIT)是一种基于“酶-底物”及“抗体-抗原”相互作用原理的制备技术。将分子印迹技术的良好选择性与荧光纳米材料的优异发光特性结合,可构建高效识别和高灵敏检测目标物的分子印迹荧光探针。目前,所构建的针对PFOS的荧光探针多基于材料表面功能单体与PFOS之间的静电作用,多在较强酸性条件下使用[16,17]。研究表明,将氟化烷基硅烷在基质材料上接枝,材料可通过FF相互作用对全氟化合物吸附结合,并可有效应用于样品前处理,吸附材料在中性条件下表现出与全氟化合物目标物较好的结合效果[18~20]。本研究组在前期研究中发现,基于FF相互作用所构建的PFOS检测探针在弱酸性到碱性条件下也表现出较好的荧光响应灵敏度[15]。
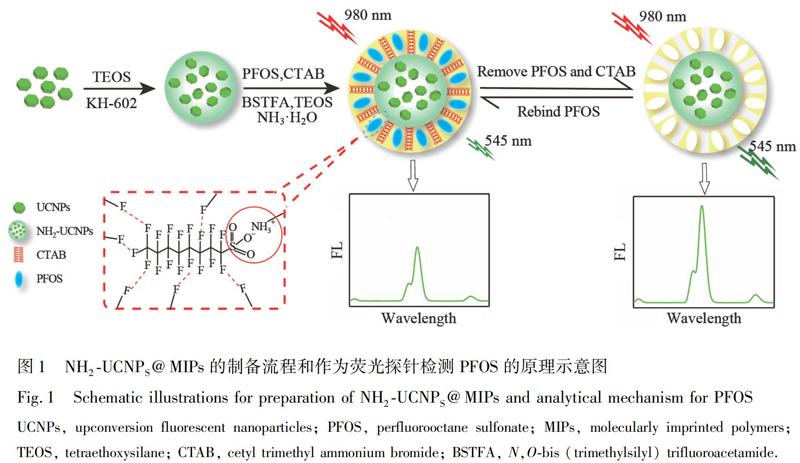
经二氧化硅包覆后的上转换荧光纳米材料不仅能够良好地分散在水溶液中, 同时在二氧化硅表面可方便地进行功能化基团修饰,有利于进一步的应用[21,22]。本研究采用氨基修饰的上转换荧光纳米粒子(NH2-UCNPs)作为核心支撑材料和荧光信号源,N,O-双(三甲基硅烷基)三氟乙酰胺(BSTFA)为功能单体,PFOS为模板分子,正硅酸乙酯(TEOS)为交联剂,十六烷基三甲基溴化铵(CTAB)为致孔剂,结合表面分子印迹技术制备了含有介孔SiO2薄层的NH2-UCNPs@MIPs荧光探针,并对此探针检测PFOS的响应时间、灵敏度、稳定性和选择性进行了系统考察。将PFOS加入检测体系时,基于NH2-UCNPs@MIPs与PFOS之间的FF作用与静电作用导致NH2-UCNPs@MIPs荧光猝灭,根据荧光强度变化可实现对PFOS进行定量检测,基于此建立了一种高选择性, 高灵敏, 并可在酸性和中性条件下检测多种基质中PFOS的荧光分析方法。
2 实验部分
2.1 仪器与试剂
F-7000荧光分光光度计 (日本日立公司); 高稳定性红外激光器(长春新产业光电技术有限公司); JSM-6700F场发射扫描电子显微镜SEM、SM-2010透射电子显微镜TEM (日本电子公司); Nicolet is 5型傅里叶变换红外光谱仪 (美国Thermo Fisher Scientific公司); Nove 2000e比表面分析仪(美国Quantachrome公司); 鼓风干燥箱(上海一恒科学仪器有限公司); 数控超声波清洗器(江苏昆山市超声仪器有限公司)。
YCl3·6H2O(99.99%)、YbCl3·6H2O(99.99%)、ErCl3·6H2O(99.99%)、BSTFA(98%)购自麦克林试剂公司; N-(β-氨乙基-γ-氨丙基)甲基二甲氧基硅烷(KH-602,≥98%)、全氟辛烷磺酸盐(98%)购自阿拉丁试剂公司; 柠檬酸钠购自上海试四赫维化工有限公司; CTAB和TEOS购自西陇化工股份有限公司。所用试剂均为分析纯,无需进一步纯化。
2.2 材料制备
2.2.1 NaYF4∶Yb,Er纳米粒子的制备及氨基化修饰 参考文献[23]方法制备上转换NaYF4∶Yb,Er纳米粒子。在磁力搅拌下,将5 mL含1 mmol LnCl3(Ln=Y∶Yb∶Er, 80∶18∶2)溶液与2 mmol柠檬酸钠加入10 mL水中。将5 mL含2.88 mmol NaCl和6 mmol NH4F的水溶液、10 mL油酸和5 mL乙二醇加至上述溶液,充分搅拌后转入50 mL反应釜中, 180℃反应6 h。反应结束后,自然冷却至室温,倾出混合液,离心分离后,用乙醇洗涤沉淀物, 并于60℃真空干燥12 h,得到上转换材料NaYF4∶Yb,Er (UCNPs)。
采用反相微乳液法[24]制备氨基修饰的UCNPs粒子(NH2-UCNPS)。将100 mg UCNPs、10 mL环己烷和1 mL IGEPAL CO-520混合并超声分散,然后向溶液中依次加入4 mL IGEPAL CO-520和800 μL 氨水,磁力搅拌30 min,缓慢滴加200 μL TEOS,搅拌反应12 h。将400 mL KH-602滴加入溶液中,继续搅拌反应3 h。反应结束后,反应液离心,沉淀物使用乙醇洗涤后,于60℃真空干燥12 h,得到氨基化的上转换纳米材料 NH2-UCNPs。
2.2.2 NH2-UCNPS@MIPs的合成 准确称取50 mg NH2-UCNPs分散于30 mL去离子水中,超声分散10 min。加入30 mg PFOS和100 μL N,O-双(三甲基硅烷基)三氟乙酰胺(BSTFA)进行预组装。搅拌30 min后,依次加入1.6 mL 0.2 mol/L CTAB和0.2 mL 0.2 mol/L NaOH溶液。继续搅拌反应30 min后,依次滴加200 μL 氨水和200 μL TEOS,磁力搅拌下反应12 h。反应完成后,将反应液离心,用乙醇-0.1 mol/L HCl (8∶2,V/V)洗脱液将模板分子PFOS和致孔剂CTAB洗脱,然后用去离子水离心洗涤,以去除表面多余的HCl。最后将所得固体粉末置于60℃真空干燥箱中干燥,即得到印迹荧光探针(NH2-UCNPS@MIPs)。非印迹荧光探针NH2-UCNPS@NIPs制备过程除不加入模板分子PFOS外,其它步骤同上。
2.3 NH2-UCNPS@MIPs对PFOS的荧光响应
于10 mL具塞比色管中加入800 μL NH2-UCNPs@MIPs分散液,再加入100 μL BR缓冲液 (pH=2.9)调节体系酸度,混匀,加入不同浓度的PFOS标准溶液,用去离子水定容至10 mL,于室温下放置10 min。在激发波长980 nm下,测量体系的荧光光谱,根据545 nm处的荧光强度的变化值实现对PFOS的定量检测。
2.4 样品预处理
采样用器皿需预先使用甲醇、去离子水清洗,使用前需用样品水体清洗3次。水样采集后静置,并加热煮沸,冷却至室温后,用0.20 μm滤膜过滤3次,以去除水中杂质,于4℃储存,并于24 h内完成测定。血清样品在室温下以10000 r/min离心10 min,在上清液中添加乙腈(CH3CN∶血清=1∶1,V/V),涡旋2 min,以10000 r/min离心10 min,去除血清中的蛋白。将上清液用0.22 μm滤膜过滤,收集滤液,于4℃储存,并于24 h内完成测定。
3 结果与讨论
3.1 NH2-UCNPS@MIPs的制备
NH2-UCNPS@MIPs材料制备以及检测PFOS的原理如图1所示。通过溶剂热法制备水分散性和发光性能良好的上转换粒子NaYF4∶Yb,Er,在其表面包覆一层SiO2,并修饰硅烷化试剂KH-602,得到表面含有丰富氨基基团的UCNPS粒子,即NH2-UCNPS。以NH2-UCNPS为支撑材料和荧光信号源,PFOS为模板分子,BSTFA为功能单体,CTAB为致孔剂,TEOS为交联剂,在碱性条件下引发NH2-UCNPS表面形成对PFOS具有特异性识别位点的介孔二氧化硅薄层,使用洗脱液去除PFOS和CTAB后,得到介孔分子印迹荧光探针NH2-UCNPs@MIPs。 模板和致孔剂洗脱前,非印迹材料的荧光强度远高于印迹材料; 洗脱完全后, 非印迹材料的荧光强度保持不变,印迹材料的荧光强度得以恢复,以此可以判断模板和致孔剂得以完全去除。荧光材料所具有的介孔结构使其具有大的比表面积,增大了对PFOS的吸附量,加快了传质速率。
3.2 NH2-UCNPS@MIPs表征
3.2.1 NH2-UCNPS@MIPs形貌表征 NH2-UCNPS和NH2-UCNPS@MIPs的形貌通过扫描与透射电镜进行表征。扫描电镜图如图2A和2B所示,两种材料均呈扁平六棱柱状,尺寸分布均匀,分散性较好,平均粒径为1.5 μm。由透射电镜图(图2C)可知,NH2-UCNPS表面有球状颗粒覆在表面,这是由于在UCNPS表面包覆SiO2时,部分TEOS水解缩合生成SiO2微球。由NH2-UCNPS@MIPs的TEM图(图3D)可以估算出,在NH2-UCNPS表面形成约20 nm的印迹层,超薄的印迹层使得NH2-UCNPS@MIPs具有较低的传质阻力和较好的吸附容量,同时提供大量印迹位点,实现对PFOS的特异识别。
3.2.2 红外光谱分析 图3为NH2-UCNPs(图3a)、NH2-UCNPs@MIPs(模板洗脱前) (图3b)、NH2-UCNPs@MIPs(模板洗脱后) (图3c)和NH2-UCNPs@NIPs(图3d)的红外光谱分析结果。由NH2-UCNPs的红外吸收曲线可知,798 cm1處小峰对应 SiO的对称伸缩振动峰,1085 cm1处强而宽的峰对应SiOSi反对称伸缩振动峰,
在1411 cm1处有较弱的CN伸缩振动峰, 3432 cm1处有宽的NH伸缩振动峰,这些结果均表明在UCNPs粒子表面包覆SiO2,并在其表面成功修饰氨基基团。在NH2-UCNPs表面包覆印迹层后,洗脱模板分子和致孔剂之前,在NH2-UCNPs@MIPS(洗脱前)曲线中出现1485 cm1 的CTAB的CH伸缩振动峰,2856和2922 cm1处为亚甲基、甲基的对称和反对称伸缩振动峰,表明CTAB被包覆于分子印迹聚合物中。由图3b可见,在1149和1256 cm1处出现CF的伸缩振动峰,且1234 cm1出现PFOS中磺酸根的SO基团的反对称伸缩振动,表明PFOS与材料成功结合。比较NH2-UCNPs@MIPs(洗脱前后)红外光谱图(图3b和3c)可知, CTAB与PFOS的特征峰消失,说明已将CTAB与PFOS较好去除,从而形成具有特异性识别PFOS介孔结构的荧光探针。 去除模板和致孔剂后的NH2-UCNPs@MIPs红外光谱并未表现出与NH2-UCNPs@NIPs的明显差别。
3.2.3 比表面积与孔径分布分析 由图4A可知, NH2-UCNPs@MIPs的N2吸附-脱附等温曲线为典型的Langmuir Ⅳ型曲线,当P/P0>0.4时,出现一个较宽的滞后环,表明NH2-UCNPs@MIPs表面孔道具有较窄的孔口。此外,NH2-UCNPs@MIPs的比表面积为38.12 m2/g,孔体积为0.033 cm3/g。由图4B可知,NH2-UCNPs@MIPs的孔径分布较宽,主要集中在2~50 nm,介孔的平均孔径为3.8 nm。NH2-UCNPs@MIPs较大的比表面积和适中的孔径提高了对目标分子PFOS的优异传递能力。
3.3 孵化时间、体系pH值及离子强度对检测的影响
考察了室温孵化60 min内, 孵化时间对体系荧光强度的影响。由图5A可知,样品空白的荧光强度值在60 min内基本保持不变(RSD=1.4%),表明其在水溶液中较好的荧光稳定性。加入PFOS后,体系的荧光强度在前5 min内快速下降,6~8 min内荧光强度降低幅度逐渐减缓,在10 min后趋于稳定,并在1 h内基本保持不变。NH2-UCNPs@MIPs与PFOS的快速结合主要归因于材料表面较薄的介孔印迹壳层,较高的传质速率有利于PFOS快速进入孔穴与识别位点结合,导致NH2-UCNPs@MIPs荧光猝灭。
体系pH值对NH2-UCNPs@MIPs与PFOS作用前后体系荧光强度的影响如图5B所示。在pH 2.8~10.2范围内, NH2-UCNPs@MIPs的荧光强度保持稳定,而与PFOS结合后表现出明显的荧光猝灭。当pH值从2.8增加到6.3时,两者的荧光强度差值缓慢降低,随着pH值继续增加到10.2,此差值保持稳定。这可能是由于PFOS在水中有较低的pKa(3.27)[25],带负电荷,在酸性条件下,NH2-UCNPs@MIPs表面的氨基发生质子化,通过静电作用与PFOS相结合,同时,PFOS上的氟原子与探针表面的含氟基团发生FF弱相互作用结合,从而导致电荷在探针和PFOS两者之间发生转移,使NH2-UCNPs@MIPs发生强烈的荧光猝灭。随着溶液pH值增大,虽然NH2-UCNPs@MIPs表面氨基逐渐去质子化而使静电作用逐渐减弱,但由于FF作用的存在,当pH>6时,PFOS仍可与探针发生相互作用,导致其荧光发生明显猝灭。文献[26,27]报道的荧光染料尼罗蓝(Nile blue A, NBA)和氮掺杂碳点荧光探针检测PFOS均只能在酸性条件下进行。本研究构建的荧光探针表现出较好的pH值适用范围,具有较好的实际应用潜能。
考察溶液离子强度对检测体系荧光猝灭的影响时发现, 体系的荧光猝灭值在0.1~0.6 mol/L NaCl溶液中十分稳定,因此体系选择不加入NaCl。根据文献[16,28]报道,基于静电相互作用构建的异硫氰酸荧光素酯荧光团的二氧化硅印迹探针(FITC-APTS-SiO2)和健那绿B荧光探针检测PFOS时,响应信号受离子强度影响较大。本研究制备的荧光探针具有较好的盐耐受度,说明检测PFOS过程中FF作用可能占主导作用。
3.4 NH2-UCNPs@MIPs作为荧光探针检测PFOS
NH2-UCNPs@MIPs的荧光猝灭值与PFOS加入浓度的关系可用Stern-Volmer方程[29]拟合:
其中,F0和F为PFOS不存在和存在时的荧光强度,Cq为PFOS的浓度,Ksv为体系的猝灭常数。将(F0/F)-1定义为猝灭量,NH2-UCNPs@MIPs与NH2-UCNPs@NIPs的Ksv的比值定义为印迹因子(IF),用于评价荧光探针的选择性。
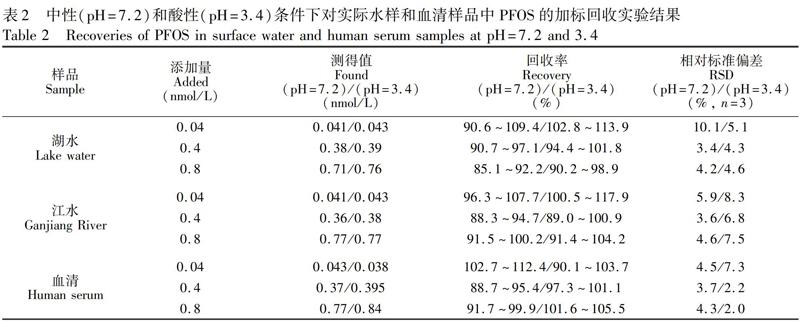
分别在中性和酸性条件下检测不同浓度PFOS存在下的体系荧光光谱,并进行Stern-Volmer方程线性拟合,结果见图6。当PFOS浓度在0.01~15 nmol/L之间时,随着其浓度增加,体系的荧光猝灭程度均逐渐增强。在溶液中,PFOS导致NH2-UCNPs@MIPs荧光猝灭,可归因于其高的电负性和CF键与其表面的氨基与含氟基团发生的静电和FF相互作用。由图6A和6B可知,在pH=7.1时,NH2-UCNPs@MIPs检测PFOS的IF为1.82。当溶液pH=3.4时,NH2-UCNPs@MIPs与PFOS作用后荧光猝灭程度相对更大(图6C),线性相关方程为(F0/F)-1= 0.8559CPFOS+ 0.0402 (R2=0.9958)。结合非印迹材料的检测结果计算得到IF=3.63。以上结果表明,在中性和酸性条件下,所构建的荧光探针均可较好地测定PFOS,且在酸性条件下探针的选择性更强,两种条件下方法的检出限均可达到0.01 nmol/L(S/N=3)。
与目前文献报道的一些分子印迹荧光探针用于典型全氟化合物PFOS或全氟辛酸(PFOA)的检测方法比较(表1),本研究构建的荧光探针并主要通过FF相互作用对PFOS进行检测, pH適用范围广,且检出限低、线性范围宽,所使用发光材料具有低细胞毒性和高穿透深度,光化学稳定性高,显示出良好的应用前景。
