基于Taqman微流控芯片技术高通量检测17种转基因玉米品系
2020-12-06徐君怡曹际娟郑秋月杨莉莉王永邹明强
徐君怡 曹际娟 郑秋月 杨莉莉 王永 邹明强


摘 要 将Taqman微流控芯片技术应用于实时荧光PCR平台的转基因玉米17种品系高通量检测。在一次PCR扩增过程中,以2个玉米内源基因 (hmgA基因、adh1基因)和1个上样控制基因 (18S基因) 为内参照,可同时完成17种转基因玉米品系(TC1507、NK603、MON87640、MON863、MON810、MIR162、GA21、DAS40278、BT176、BT11、98140、59122、3272、MON89034、MIR604、MON88017、T25)的单孔单重扩增的并行检测,检出限可达10~20 copies。本方法特异性强,灵敏度高,与“金标准”单一的实时荧光PCR方法检测结果完全吻合,具有可多样品、多靶标平行检测的优势,为转基因产品多品系混杂鉴定检测提供了高效、快速的方法。采用本方法,从16批进境的实用玉米中检出9批转基因玉米样品,且发现其中不同程度的混杂含有1~8种品系。本方法可用于口岸进境实用农产品中多品系混杂转基因的高通量检测。
关键词 Taqman微流控芯片; 转基因玉米; 品系鉴定; 多品系平行检测
1 引 言
玉米是世界上重要的粮食作物之一,其单位面积产量位居榜首[1]。近二十多年来,转基因植物培育取得突破,推出了一批新品种[2~5]。截至2018年底,总计70个国家/地区批准了可用于食物和饲料及释放至环境中的转基因作物进口,其中,玉米仍然是转化体获批数量最多的作物[6]。
转基因作物及其产品中转基因成分的检测主要有蛋白质检测方法和核酸检测方法。核酸检测的目标通常为插入的外源DNA片段(即鑒定是否为转基因)或外源插入DNA同植物基因组之间的连接区序列(即转基因品系鉴定);蛋白检测目标通常为外源目标基因表达的新蛋白。这两种检测方法因其较高的特异性和灵敏度,被用作转基因产品检测的常用方法[7]。但是,基于蛋白检测的方法有局限性,如目的蛋白稳定性不及核酸,在一些加工处理的产品中,蛋白通常已变性,很难检测到可能有的转基因成分;此外,蛋白抗体的制备成本较高,制备过程复杂,不适用于目前全球贸易市场上出现的越来越多的转基因作物品系及复合品系的筛查和检测。
聚合酶链反应 (PCR) 是目前转基因生物核酸检测的主要方法,实时荧光定量PCR (qPCR) 已成为转基因定性和定量检测的“金标准” [8,9]。转基因作物及其产品中转基因成分的检测、鉴定和定量分析需采用复杂的多步骤程序。首先,初筛阶段检测样品是否含有任何转基因成分,即通过筛查检测植物转化体中广泛使用的调控元件,如CaMV35S启动子、NOS终止子等[10];其次,当筛查检测到存在转基因成分时,必须确定转基因生物的品系,以便核查其生物安全证书状态。此步骤使用的检测方法是针对转基因品系进行特异性鉴定,即外源插入基因同植物基因组之间的连接区序列。对于未经批准的转基因生物品系,则需按照相关规定进行处理。不同国家对于转基因产品的检测阈值有不同的规定,但我国并没有规定阈值限量,唯检出或未检出,未经批准商业化种植或未经审批进境的转基因品系存在极大的生物安全性风险隐患,因此,开展转基因品系鉴定具有极其重要的现实意义。随着食品和饲料产品中转基因转化事件数量的不断增加,在一个PCR反应中检测多个转基因转化事件将加快检测速度并提高检测效率[11~13]。然而,由于引物间的相互干扰和某些靶点的优先扩增,使得多重PCR的扩增条件的优化难度较大。实际上,多重qPCR并未被转基因检测实验室广泛应用于常规检测中。对于进境玉米、大豆等实用农产品业务量大的海关口岸检测机构, 实用农产品中多种转基因品系混杂的品系鉴定检测是最普遍、最繁琐的工作,因此,需要研发一种简单快捷、灵敏准确的高通量品系鉴定检测方法。
微流控芯片是由Manz等[14]在20世纪90年代首次提出并发展起来的跨学科分析技术。通过微加工技术,将常规实验室的多个操作平台集成在一张芯片完成,具有高度集成、样品和试剂消耗量少、反应速度快、可大量平行处理的优点,在生物、化学和医学等领域表现出巨大的发展潜力[15~19]。目前,微流控芯片技术已被广泛用于细菌定量检测[20]、基因扩增与分析[21~23]和蛋白质检测[24]等领域。Kodani等[25]应用微流控芯片在278个临床样品中同时检测21种呼吸道病原体;Liu等[26]利用微流控芯片同时检测19个肠道病原靶标;Rachwal等[27]利用微流控芯片同时检测23种病原细菌;周杰等[21]利用微流控恒温扩增碟式芯片在65℃恒温条件下对转基因样品中的P-CaMV35S、T-NOS等10种筛选靶标基因进行同步检测,检出限可达到0.5% (m/m), 实现一次上样即可完成样品的转基因成分筛查。
Taqman微流控芯片是一种384孔板结构的qPCR反应板,芯片中包埋Taqman探针,可进行qPCR反应。本研究将Taqman微流控芯片技术应用于转基因玉米品系鉴定的实时荧光PCR平台进行高通量检测。在一次PCR扩增过程中,2个玉米内源基因 (hmgA基因、adh1基因)、1个上样控制基因 (18S基因) 为内参照,可同时鉴定17种转基因玉米品系(TC1507、NK603、MON87640、MON863、MON810、MIR162、GA21、DAS40278、BT176、BT11、98140、59122、3272、MON89034、MIR604、MON88017、T25),实现了多品系平行检测、扩增检测试剂体系的全封闭和微量化,减少了检测成本,可为实用转基因玉米混杂品系的快速鉴定检测提供技术支持。
2 实验部分
2.1 仪器与试剂
ND-1000超微量分光光度计(美国Nanodrop公司); 5910R高速冷冻离心机 (德国Eppendorf公司); SORVALL ST40 高速离心机 (美国Thermo Scientific公司);BLENDER 8011S型粉碎机 (美国Waring公司)。
玉米基因组DNA大小为2292 Mb(106 碱基数),大豆的基因组大小为1115 Mb,油菜基因组大小为1100 Mb,马铃薯基因组大小为1597 Mb[29]。将提取的各标准品基因组DNA溶液测定浓度后,将浓度换算成DNA拷贝数,并用10 ng/μL非目标DNA (λ DNA) 进行10倍梯度稀释,共稀释5个梯度,梯度稀释后的浓度分别为100、10、5、2.5和0.5 copies/μL。取浓度为100 copies/μL的基因组DNA模板,按照2.4节的条件进行特异性实验。
2.6 Taqman微流控芯片的灵敏度测定
取2.5节稀释获得的10~0.5 copies/μL浓度梯度模板DNA进行灵敏度实验。用于灵敏度实验的各浓度梯度样品基因组DNA为2 μL,即每个Taqman微流控芯片反应中各转基因品系的拷贝数分别为20、10、5和1 copy/reaction。按照2.4节的条件进行灵敏度实验。每个浓度进行10次重复实验。定义检出限 (Limit of detection, LOD) 为未观察到阴性结果的最低稀释度水平 (即95%重复呈现阳性反应的水平)。
2.7 Taqman微流控芯片的重复性评价
用于重复性实验的各转基因玉米品系模板DNA浓度为100 copies/μL,取各样品基因组DNA 2 μL,即:200 copies/reaction,按照2.4节的条件进行重复性实验。使用5块Taqman微流控芯片反应板进行重复性测试,每个浓度进行10次重复实验,计算相对标准偏差 (RSD),分析测试结果的精密度。各芯片反应板间差异用p值进行统计学分析。
2.8 实际样品的检测
以本实验室留存的从大连口岸进境实用玉米货物中抽取的16批玉米样品为待检对象,按照试剂盒的使用方法提取基因组核酸后,进行Taqman微流控芯片和常规单一的qPCR检测。
3 结果与讨论
3.1 引物和探针设计
本研究所用引物和探针序列在SN/T 1196-2018[30]中转基因玉米品系鉴定引物和探针序列基础上,进行多品系通用并行扩增条件分析,重新调整设计引物和探针序列,详见电子版文后支持信息表S1。在应用Taqman微流控芯片技术进行qPCR扩增检测时,不能将用于单一qPCR反应的引物和探针直接结合到Taqman微流控芯片反应板上,而应调整引物的长度、G+C量值等以适应在卡板上的通用并行检测条件。本研究结合Taqman微流控芯片的实际扩增条件,重新设计了转基因玉米17种品系鉴定的引物和探针序列。此外,在SN/T 1196-2018[30]中,转基因玉米品系鉴定用探针通常為TAMRA淬灭荧光标记的Taqman探针,适合于单一的qPCR反应。MGB标记的探针比TAMRA标记的Taqman探针更短,通常为10~15 bp;MGB探针具有特异性更高的优势,可区分一个模板碱基的差异,模板只有一个碱基的差别探针不能与之杂交,可以更好地防止假阳性结果;此外,淬灭基团MGB本身不产生荧光,所有荧光背景低,灵敏度就高,可避免假阴性结果;相反,TAMRA本身会产生荧光,背景相对高,灵敏度略差,因而MGB探针更适合于微量化检测的微流控芯片。本研究除MON88017品系、T25品系和adh1内参照检测探针设计为常用的TAMRA荧光标记Taqman探针外,其余探针均设计为MGB淬灭荧光探针。
3.2 特异性评价
Taqman微流控芯片用于快速鉴定检测转基因玉米17种品系,是基于空间上的qPCR反应平台,结果也应符合qPCR方法的判定标准[30]。测试样品外源基因检测Ct≥40,内源基因检测Ct≤28,则可判定该样品不含所检品系;测试样品外源基因检测Ct≤36,内源基因检测Ct≤28,则可判定该样品含有所检品系;测试样品外源基因检测Ct=36~40,应调整模板浓度,重做检测。再次扩增后外源基因检测Ct=36~40,则可判定该样品含有所检品系。再次扩增后外源基因检测Ct≥40,则可判定该样品不含所检品系。
用建立的Taqman微流控芯片的方法分别对17种转基因玉米品系的基因组DNA进行交叉反应扩增检测,仅对相对应的品系产生荧光扩增曲线,内参照基因和空白对照均正常;其它品系及物种标准品均未出现扩增,曲线经归一化处理后,对应的扩增曲线处于基线水平。此结果表明,Taqman微流控芯片各个反应孔之间相互独立,无交叉污染,本方法可特异性地并行鉴定检测17种转基因玉米品系。此外,在检测过程中发现,转基因玉米品系MON810 (Ct=29.12) 和T25 (Ct=36.27) 偶尔会有轻微的交叉反应,MON87460 (Ct=28.35) 和59122 (Ct=36.81) 也会有偶尔轻微的交叉反应。与MON810的扩增Ct值比较, T25的Ct值延后7个循环;与MON87460的扩增Ct值比较,59122的Ct值延后8个循环。如果将阳性结果Ct值限定在36个循环,则这两个交叉反应是可以忽略的。此结果也可能是由于玉米基因组相对较大,基因繁杂干扰、MGB探针高灵敏性能等原因所致。
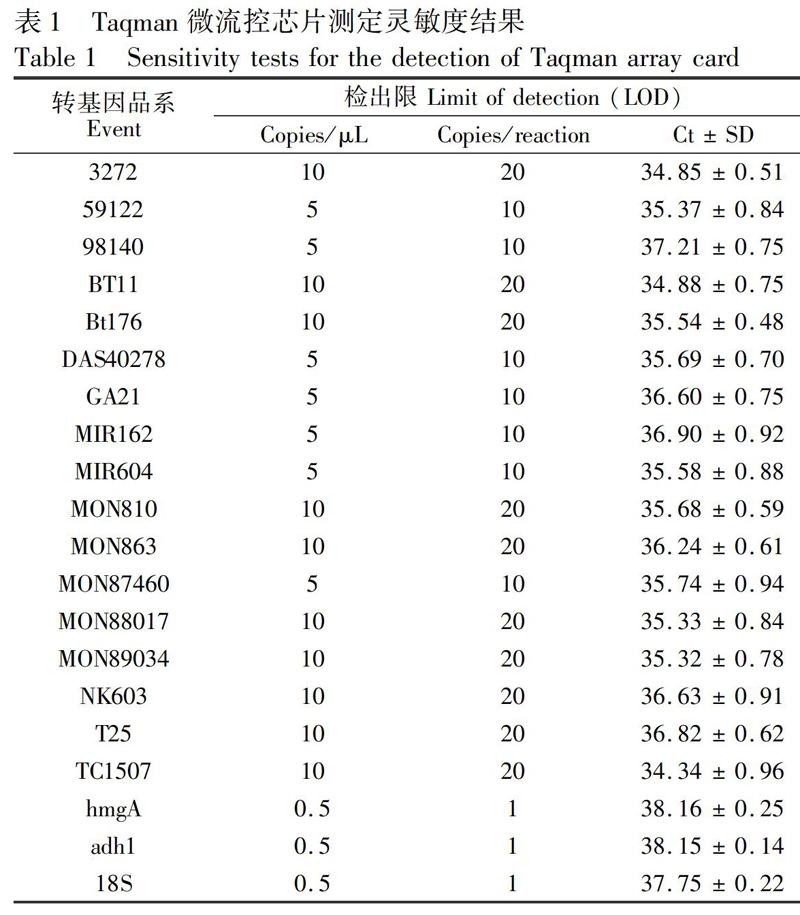
3.3 灵敏度测定
为了确定Taqman微流控芯片的实时荧光PCR方法的灵敏度,将待测物模板梯度稀释进行反应,结果表明,本方法最低可将10~20 copies/reaction的靶标分子扩增至可检测程度;随着浓度降低,扩增曲线起峰时间逐渐延长;当模板浓度太低时,单个拷贝数在此条件下无法完成扩增反应,因而并未出现扩增曲线,具体灵敏度测定结果见表1。由表1可知,在10次重复实验过程中,17种转基因玉米品系的LOD 均可达到20 copies/reaction,其中7种品系LOD 可达到10 copies/reaction。此灵敏度结果符合欧盟转基因食品和饲料参考实验室联合研究中心 (Joint research centre of European Union reference laboratory for GM food and feed, EURL GMFF) 指导文件[31]所定义的转基因产品检测方法最低性能要求,即LOD < 25 copies/reaction。
3.4 重复性分析结果
方法的重复性 (即稳定性,RSD) 是影响Taqman微流体芯片检测结果的重要指标。在转基因品系浓度为200 copies/reaction的条件下,本研究中转基因玉米17个品系鉴定基因和3个内参照在2个平行样本之间的RSD值在0.01%~1.82%范围内,符合EURL GMFF指导文件[31]的要求(RSD≤25%)。重复性实验中, 5个微流体芯片反应板间的差异采用p值进行统计分析。转基因玉米17个品系鉴定基因和3个内参照在5个反应板间的p值均大于0.05,表明本研究建立的Taqman微流控芯片方法差异性不显著,重复性较好,方法稳定。重复性分析结果见电子版文后支持信息表S2。
3.5 进境实用玉米的品系检测
为了验证Taqman微流控芯片方法的准确性,采用本研究建立的检测体系,对进境的16批次实用玉米样品进行检测,同时以采用“金标准”单一的qPCR方法的结果进行对照,结果如图2所示。16批次实用玉米样品中,9批次样品检出含有转基因玉米成分,其中8批次样品混杂有多种转基因玉米品系。由图2可见,#1玉米样品仅含有1个外源重组品系T25;#5玉米样品含有2个外源重组品系MIR604、MON88017;#11玉米样品含有3个外源重组品系Bt11、GA21、MIR604;#10玉米样品含有6个外源重组品系Bt11、NK603、MIR604、MON88017、MON89034、MON810;#12玉米样品含有6个外源重组品系NK603、TC1507、59122、MON88017、MON89034、MON810;#14玉米样品含有7个外源重组品系Bt11、NK603、TC1507、59122、MIR604、MON88017、MON810;#3玉米样品含有8个外源重组品系Bt11、NK603、TC1507、59122、MIR604、MON88017、MON89034、MON810;#4玉米样品含有8个外源重组品系Bt11、NK603、TC1507、59122、MIR604、MON88017、MON89034、MON810;#13玉米样品含有8个外源重组品系Bt11、NK603、TC1507、59122、MIR604、MON88017、MON89034、MON810。Taqman微流控芯片方法的部分检测结果见图3。结果表明,Taqman微流控芯片方法的检测结果与实时荧光PCR方法结果完全一致,因此,建立的Taqman微流控芯片方法特异性良好,能够满足对口岸进境实用玉米中转基因玉米品系的高效并行快速检测需求。Taqman微流控芯片方法与单一的qPCR方法相比,操作簡单,仅需加入一次DNA模板的预混液即可完成多靶标的检测,极大地提高了检测效率,降低了检测试剂用量;与多重PCR扩增相比,单孔单重扩增,可避免样品间相互干扰,具有更高的检测灵敏度。Taqman微流控芯片的不足之处是芯片制造成本较高,单孔的检测成本约是普通实时荧光PCR的8倍。
在ISAAA已获批准的238个转基因玉米品系名录中[6],有192个是多种重组性状杂交的复合品系。目前,很多复合品系转基因作物尚未获得我国生物安全性审批许可。本研究在一份样品进境实用玉米样品中同时检出1~8种外源重组品系,这可能是多个单一品系混杂,也有可能是几个复合品系混杂造成的。如#11玉米样品可能是Bt11 × MIR604 × GA21复合品系,而# 3玉米样品则可能是Bt11 × 59122 × MIR604 × TC1507、MON89034 × NK603、MON89034 × 59122、MON89034 × 59122 × MON88017、MON810 × MON88017、MON810 × NK603 × MIR604等多种复合品系的混杂,存在生物安全性风险。目前,还未见转基因作物复合品系的鉴定方法,因而,未来可以利用Taqman微流控芯片技术的多靶标同时并行检测的特点,进一步研究建立转基因作物复合品系鉴定方法。
4 结 论
采用Taqman微流控芯片技术进行转基因玉米17种品系的高通量鉴定。基于qPCR平台集成建立的Taqman微流控芯片检测方法,可在一次PCR扩增过程中,同时完成17种转基因玉米外源重组品系的鉴定检测,特异性强,灵敏度高,与qPCR检测结果完全吻合,为转基因产品多品系混杂鉴定检测提供了高效快速、单孔单重扩增、多样品多靶标平行通量检测的新方法。未来可设计出适应于转基因大豆、转基因油菜等品系鉴定引物和探针,将其修饰固定于Taqman微流控芯片反应板中,可用于口岸进境实用农产品中多品系混杂转基因的高通量检测。
References
1 Brookes G, Barfoot P. ISAAA Brief No. 36. ISAAA: Ithaca, NY. 2006
2 Pearsall D. GM Crops Food, 2013, 4(3): 143-150
3 James C. ISAAA Brief No.54. ISAAA: Ithaca, NY. 2018
4 Fresco L O. Science, 2013, 339(6122): 883
5 HUANG Da-Fang. Chinese J. Biotech., 2015, 31(6): 892-900
黄大昉. 生物工程学报, 2015, 31(6): 892-900
6 GM Approval Database/GM Crops List/Maize (Zea mays L.) GM Events. www.isaaa.org/gmapprovaldatabase/crop/default.asp?CropID=6&Crop=Maize
7 Demeke T, Dobnik D. Anal. Bioanal. Chem., 2018, 410(17): 4039-4050
8 Holst-Jensen A, Bertheau Y, de Loose M, Grohmann L, Hamels S, Hougs L, Morisset D, Pecoraro S, Pla M, Bulcke M V, Wulff D. Biotechnol. Adv., 2012, 30(6): 1318-1335
9 Miraglia M, Berdal K G, Brera C, Corbisier P, Holst-Jensen A, Kok E J, Marvin H J P, Schimmel H, Rentsch J, van Rie J P P F, Zagon J. Food Chem. Toxicol., 2004, 42(7): 1157-1180
10 Zhang D B, Guo J C. Integr. Plant Biol., 2011, 53(7): 539-551
11 Waiblinger H U, Ernst B, Anderson A, Pietsch K. Food Res. Technol., 2008, 226: 1221-1228
12 Takabatake R, Koiwa T, Kasahara M, Takashima K, Futo S, Minegishi Y, Akiyama H, Teshima R, Oguchi T, Mano J, Furui S, Kitta K. Food Hyg. Safe Sci., 2011, 52: 265-269
13 Huber I, Block A, Sebah D, Debode F, Morisset D, Grohmann L, Berben G, Stebih D, Milavec M, Zel J, Busch U. J. Agric. Food Chem., 2013, 61: 10293-10301
14 Manz A, Fettinger J C, Verpoorte E, Luedi H, Widmer H, Harrison D J. TrAC-Trends Anal. Chem., 1991, 10 (5): 144-149
15 LIN Dong-Guo, LIN Jin-Qiong, LI Pei-Wen, YANG Na, XU Bang-Lao, LIU Da-Yu. Chinese J. Anal. Chem., 2018, 46(1): 113-120
林冬果, 林錦琼, 李佩文, 杨 娜, 徐邦牢, 刘大渔. 分析化学, 2018, 46(1): 113-120
16 Park S, Zhang Y, Lin S, Wang T H, Yang S. Biotechnol. Adv., 2011, 29(6): 830-839
17 LIAO Ze-Rong, LI Yong-Rui, GU Le, LEI Run-Hong, MIAO Yun-Fei, LAN Hong-Ying, DENG Yu-Lin, GENG LI-Na. Chinese Journal of Chromatography, 2019, 37(4): 343-347
廖泽荣, 李永瑞, 古 乐, 雷润宏, 苗云飞, 蓝鸿颖, 邓玉林, 耿利娜. 色谱, 2019, 37(4): 343-347
18 Liu D Y, Liang G T, Zhang Q, Chen B. Anal. Chem., 2013, 85(9): 4698-4704
19 JIANG Hao, LYU Xue-Fei, ZHAO Ke-Xin. Chinese J. Anal. Chem., 2020, 48(5): 590-600
姜 浩, 吕雪飞, 赵可心. 分析化学, 2020, 48(5): 590-600
20 HE Hao-Yan, HUANG En-Qi, LI Zhu-Jun, SHU Bo-Wen, XU Bang-Lao, LIU Da-Yu. Chinese J. Anal. Chem., 2020, 48(7): 855-862
何浩延, 黄恩奇, 黎柱均, 舒博文, 徐邦牢, 刘大渔. 分析化学, 2020, 48(7): 855-862
21 ZHOU Jie, HUANG Wen-Sheng, DENG Ting-Ting, CHEN Ying, LI Min, OUYANG Zhao-Huai, WU Ya-Jun, WANG Yong-Gui. Chinese J. Modern Food Science and Technology, 2017, 33(6): 293-302
周 杰, 黄文胜, 邓婷婷, 陈 颖, 李 敏, 欧阳兆槐, 吴亚君, 王永贵. 现代食品科技, 2017, 33(6): 293-302
22 Qin K, Lv X, Xing Q, Li R, Deng Y. Anal. Methods, 2016, 8(12): 2584-2591
23 Xu J, Lv X, Wei Y, Zhang L, Li R, Deng Y, Xu X. Sens. Actuators B, 2015, 212: 472-480
24 Khandurina J, Guttman A. J. Chromatogr. A, 2002, 943(2): 159-183
25 Kodani M, Yang G, Conklin L M, Travis T C, Whitney C G, Anderson L J, Schrag S J, Taylor T H, Beall B W, Breiman R F, Feikin D R, Njenga M K, MayerL W, Oberste M S, Tondella M L C, Winchell J M, Lindstrom S L, Erdman D D, Fields B S. J. Clin. Microbiol., 2011, 49(6): 2175-2182
26 Liu J, Gratz J, Amour C, Kibiki G, Becker S, Janaki L, Verweij J J, Taniuchi M, Sobuz S U, Haque R, Haverstick D M, Houpt E R. J. Clin. Microbiol., 2013: 51(2): 472-480
27 Rachwal P A, Rose H L, Cox V, Lukaszewski R A, Murch A L, Weller S A. PLoS One, 2012, 7(4): e35971
28 GB/T 19495.7-2004, Detection of Genetically Modified Organisms and Derived Products-Methods for Sampling and Sample Preparation. National Standards of the People′s Republic of China
转基因产品检测 抽样和制样方法. 中华人民共和国国家标准. GB/T 19495.7-2004
29 GB/T 19495.5-2018, Detection of Genetically Modified Organisms and Derived Products-Quantitative Real-Time Polymerase Chain Reaction (PCR) Methods. National Standards of the People′s Republic of China
转基因产品检测 实时荧光定量聚合酶链式反应(PCR)检测方法. 中华人民共和国国家标准. GB/T 19495.5-2018
30 SN/T 1196-2018, Genetically Modified Components Detection Methods for Maize. Industry Standard of Entry Exit Inspection and Quarantine of the People′s Republic of China
轉基因成分检测 玉米检测方法. 中华人民共和国出入境检验检疫行业标准. SN/T 1196-2018
31 European Network of GMO Laboratories (ENGL). Definition of Minimum Performance Requirements for Analytical Methods of GMO Testing, 2015. European Union Reference Laboratory for GM Food and Feed
