姜黄素通过上调miR-124抑制牙龈卟啉单胞菌LPS诱导的人牙龈成纤维细胞炎症反应*
2020-11-05李坤阳左春然刘爱群朱兰省
李坤阳, 陈 栋, 左春然, 刘爱群, 朱兰省, 牛 兵 △
[1河南省中医院(河南中医药大学第二附属医院)口腔科,河南郑州450001;2郑州大学第一附属医院(河南省口腔医院)口腔科,河南郑州450052]
牙周病是菌斑微生物引发的感染性疾病,其中牙周炎是成人失去牙齿主要原因,不仅影响牙周组织健康、引发神经炎症增加,还与糖尿病、脑血管疾病和阿尔茨海默氏病的关系密切[1],影响患者健康。牙龈卟啉单胞菌(Porphyromonas gingivalis,Pg)作为牙周炎主要致病菌,脂多糖(lipopolysaccharide,LPS)是主要毒力因子,可导致牙周组织细胞破坏,加重牙周炎病程[2]。减少Pg LPS 的毒性作用对于缓解牙周炎至关重要。姜黄素(curcumin,Cur)是从姜黄中提取的酚类色素,具有抗炎和抗氧化等多种作用,在人牙髓干细胞中可促进组织修复[3];可缓解LPS诱导成骨细胞线粒体功能改变,并且使细胞凋亡数目明显减少[4]。微小 RNA-124(microRNA-124,miR-124)是一个重要的炎症相关miRNA,可抑制下游核因子κB(nuclear factor κB,NF-κB)活化发挥抗炎作用[5]。Cur 是否影响miR-124 的表达进而影响炎症作用尚未发现报道。本研究采用Pg LPS诱导人牙龈成纤维细胞(human gingival fibroblasts,HGFs)建立HGFs 炎症模型,探究Cur对HGFs炎性反应的影响。
材料和方法
1 细胞
HGFs购自贝纳生物(编号BNCC339845)。
2 药品、试剂及仪器
Pg LPS和Cur 均购自 R&D Systems(货号分别为ATCC33277 和C1385G);免疫细胞化学染色试剂盒购自Protein(货号为BPICC30-1KT);抗波形蛋白、角蛋白、NF-κB p-p65、骨架蛋白(F-actin)、GADPH和lamin B1 抗体,白细胞介素1β(interleukin-1β,IL-1β)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA 试剂盒均购自Abcam(货号分别为ab92547、ab155078、ab222494、ab112127、ab181602、ab220797、ab1793 和ab9722);CCK-8 试剂盒(货号为C0037)购自碧云天生物科技有限公司;RNA 提取试剂盒、miRNA First Strand cDNA Synthesis Kit和2× SYBR qPCR Mix 均购自天根生化科技(北京)有限公司(货号分别为 DP405、KR211和KR108);核蛋白和胞浆提取试剂盒购自上海吉凯基因化学技术有限公司(货号为KGF1100)。CO2培养箱购自上海精密仪器有限公司(型号为LRH-70F);酶标仪购自赛默飞世尔科技有限公司(型号为Varioskan LUX);实时荧光定量PCR 仪购自ABI(型号为7500);蛋白凝胶成像仪购自BIO-RAD(型号为GelDoc 2000)。
3 方法
3.1 实验分组 将HGFs 分为对照(control)组、LPS组和 LPS+Cur(20、40 和80 μmol/L)组。除 control 组外,其余各组用 10 mg/L LPS[6]处理,同时各 LPS+Cur组分别添加 20、40和80 μmol/L Cur 置于 CO2培养箱中培养。
3.2 CCK-8法检测细胞活力 按3.1方法各组细胞置于96孔板中,分别培养24 h,添加CCK-8试剂,CO2培养箱中继续培养2 h,酶标仪检测450 nm 处各孔细胞吸光度(A)值。每个样品做6个重复。
3.3 ELISA 检测上清液中炎症因子 IL-1β和TNF-α水平 按3.1 方法处理各组细胞,置于6 孔板中培养24 h,收集细胞培养液,3 000 r/min离心5 min收集上清,分装后置于4℃冰箱待用。严格按照人IL-1β 和TNF-α ELISA 试剂盒说明书检测上清液中 IL-1β 和TNF-α水平。
3.4 RT-qPCR 法检测细胞中miR-124 的水平 收集完细胞培养液后用RNA 提取试剂盒提取细胞的总RNA,miRNA First Strand cDNA Synthesis Kit 将其逆转录成第1 链cDNA。采用RT-qPCR 实验对miR-124 和内参照 U6 进行扩增,反应体系为 10 μL 2×SYBR qPCR Mix、1 μL 40 mg/L cDNA、各0.5 μL 上、下游引物(10 μmol/L)和8 μL ddH2O。反应条件为:95℃ 30 s;95℃ 30 s,62℃ 35 s,45个循环。miR-124的上游引物序列为5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAG -TACA-3',下游引物序列为5'-GGTGGCTTATGTTTGTAATCCC-3';U6 的上游引物序列为5'-CTCGCTTCGGCAGCACA-3',下游引物序列为 5'-AACGCTTCACGAATTTGCGT-3'。2-ΔΔCt法计算 miR-124 的相对表达水平。
3.5 Western blot 检测细胞胞浆和胞核中NF-κB pp65 蛋白的水平 按3.1 方法处理各组细胞,置于6孔板中培养24 h,收集细胞置1 mL 离心管中,PBS 重悬清洗细胞,500×g离心5 min,移去上清液,加入预冷的胞浆提取试剂Ⅰ充分震荡直至离心管中出现均匀无残留细胞团块得到浑浊液体,振荡器上震荡15 s 后冰上放置10 min,加入胞浆提取试剂Ⅱ混匀,4℃、16 000×g离心5 min,立即取上清液为胞浆,立即吸出至新的EP 管中保存待用。加入预冷的核蛋白提取试剂震荡混匀,振荡器上震荡15 s 后冰上放置10 min,重复4次,4℃、16 000×g离心5 min,立即取上清液为胞核,立即吸出至新的EP 管中保存待用。凝胶电泳分离蛋白质后转膜;5%脱脂奶粉室温封闭2 h;对应加入I 抗[NF-κB p65、内参照GADPH(胞浆)和lamin B1(胞核)],4℃孵育过夜;加入对应Ⅱ抗,室温孵育1 h。DAB 显色试剂盒避光显色,蛋白凝胶成像仪拍照和定量分析。
3.6 激光共聚焦显微镜检测NF-κB p-p65蛋白入核情况 按3.1 处理各组细胞24 h 后的爬片,加入无水乙醇固定 30 min,PBS 清洗,200 μL 4%Triton 静置15 min,滴加NF-κB p-p65(绿色荧光)和F-actin(红色荧光)单克隆抗体,室温孵育1 h,PBS 清洗,加入DAPI后室温孵育5 min,PBS清洗,荧光显微镜下观察并拍照。
3.7 过表达miR-124 检测细胞胞浆和胞核中NF-κB p-p65 蛋白的水平 在上述实验基础上添加mimic-NC 组和 miR-124 mimic 组,各组 10 mg/L LPS处理并同时添加mimic-NC 和miR-124 mimic,其余培养条件与3.2 培养过程相同,检测control 组、LPS 组、mimic-NC 组和 miR-124 mimic 组细胞中 miR-124 的水平,并检测细胞胞浆和胞核中NF-κB p-p65蛋白的水平,实验方法同3.4和3.5。
4 统计学处理
用统计学软件SPSS 25.0 和GraphPad 8.0 进行数据分析,计量数据以均数±标准差(mean±SD)描述,多组间比较采用方差分析,各组均数间的两两比较采用SNK-q法。当P<0.05 时认为差异有统计学意义。
结 果
1 Cur对细胞活力的影响
LPS 组细胞的活力水平低于 control 组(P<0.05);LPS+Cur(40和80 μmol/L)组细胞的活力高于LPS组(P<0.05),见图1。

Figure 1.Comparison of viability in each group after the cells were treated for 24 h.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs LPS group.图1 各组细胞处理24 h活力的比较
2 Cur 对细胞上清液中 IL-1β和TNF-α 水平的影响
LPS 组细胞上清液的 IL-1β和TNF-α 水平高于control 组(P<0.05);LPS+40 μmol/L Cur 组细胞上清液的 TNF-α 及 LPS+80 μmol/L Cur 组细胞上清液的IL-1β和TNF-α水平低于LPS组(P<0.05),见图2。
3 Cur对细胞中miR-124水平的影响
LPS 组细胞的 miR-124 水平低于 control 组(P<0.05);LPS+Cur(40和80 μmol/L)组细胞的miR-124水平高于LPS组(P<0.05),见图3。
4 Cur对细胞中NF-κB p-p65蛋白的影响
LPS组细胞浆的NF-κB p-p65蛋白水平低于control 组(P<0.05);LPS+Cur(40和80 μmol/L)组细胞浆的NF-κB p-p65蛋白水平高于LPS 组(P<0.05),见图 4。LPS 组细胞核的 NF-κB p-p65 蛋白水平高于control 组(P<0.05);LPS+Cur(40 和80 μmol/L)组细胞核的NF-κB p-p65 蛋白水平低于 LPS 组(P<0.05),见图5。

Figure 2.Comparison of the IL-1 β and TNF-α levels in the supernatant of each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs LPS group.图2 各组细胞上清液的IL-1β和TNF-α水平比较
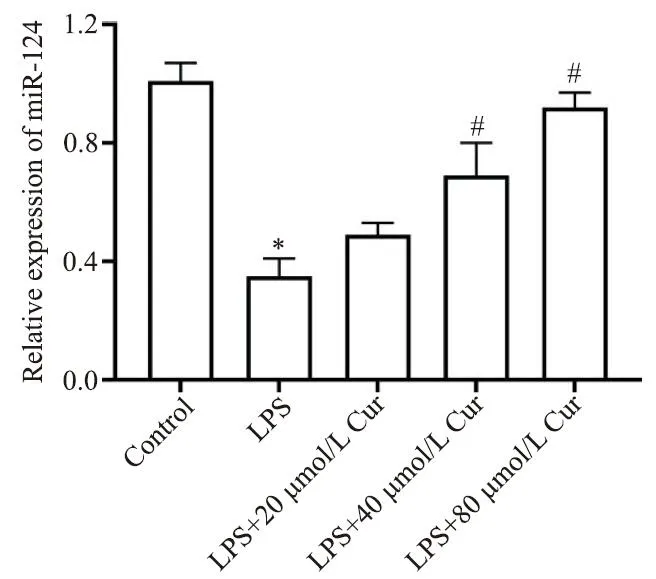
Figure 3.Comparison of miR-124 levels in the cells of each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs LPS group.图3 各组细胞的miR-124水平的比较
5 Cur对细胞中NF-κB p-p65位置的影响
NF-κB p-p65 显示为绿色,F-actin 显示为红色。图 6 中 Merged 1 显示组合的 NF-κB p-p65和F-actin,Merged 2显示组合的NF-κB p-p65、F-actin和核染色。control 组细胞核的 NF-κB p-p65 较少;LPS 组细胞核的 NF-κB p-p65 明显高于 control 组;与 LPS 组相比,LPS+Cur(20、40和80 μmol/L)组细胞核的 NF-κB pp65 减少;且随着 Cur 剂量升高,细胞核的 NF-κB pp65减少,见图6。
6 过表达miR-124细胞中miR-124表达水平
LPS 组和 mimic-NC 组细胞的 miR-124 水平低于control 组(P<0.05);miR-124 mimic 组细胞的 miR-124水平高于LPS 组和mimic-NC 组(P<0.05),见图7。
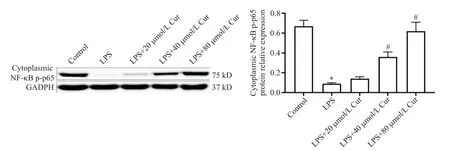
Figure 4.The protein level of NF-κB p-p65 in the cytoplasm of each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs LPS group.图4 各组细胞细胞浆的NF-κB p-p65蛋白水平的变化

Figure 5.The protein level of NF-κB p-p65 in the cell nucleus of each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs LPS group.图5 各组细胞细胞核的NF-κB p-p65蛋白水平的变化

Figure 6.The changes of NF-κB p-p65 in the cells of each group(DAPI double staining,the scale bar=100 μm).图6 各组细胞中NF-κB p-p65的变化

Figure 7.Comparison of miR-124 levels in the cells of each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs LPS group.图7 各组细胞的miR-124水平的比较
7 过表 达 miR-124 细胞的 NF-κB p-p65 蛋白 的影响
LPS 组和 mimic-NC 组细胞浆的 NF-κB p-p65 蛋白水平低于control 组(P<0.05);miR-124 mimic 组细胞浆的NF-κB p-p65 蛋白水平高于LPS 组和mimic-NC 组(P<0.05),见图 8。LPS 组和 mimic-NC 组细胞核的NF-κB p-p65蛋白水平高于control组(P<0.05);miR-124 mimic 组细胞核的 NF-κB p-p65 蛋白水平低于LPS组、mimic-NC组(P<0.05),见图9。
讨 论
牙周疾病涉及宿主免疫反应的激活,不仅充当牙周组织抵抗细菌侵袭的防御者,而且还充当组织破坏的介体,影响机体健康[7]。牙菌斑生物膜中微生物引起的牙周支持组织慢性感染疾病会导致牙周支持组织发生炎症和牙周袋形成;进一步导致进行性附着丧失和牙槽骨吸收,牙周骨丧失[8],影响患者牙齿健康。Cur 具有抗炎和抗肿瘤等作用,同时低毒、安全、耐受性好[9];在线结扎诱导大鼠实验性牙周炎模型中可抑制牙龈炎症,对牙周组织起保护作用[10],但在人中尚未发现相关研究。

Figure 8.The protein level of NF-κB p-p65 in the cytoplasm of each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs LPS group.图8 各组细胞细胞浆的NF-κB p-p65蛋白水平的变化

Figure 9.The protein level of NF-κB p-p65 in the cell nucleus of each group.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs LPS group.图9 各组细胞细胞核的NF-κB p-p65蛋白水平的变化
IL-1β 属典型致炎因子,可促进炎症反应,在牙周炎中高表达,可作为治疗牙周炎抗炎效果的标志物[11];TNF-α 参与炎症反应和免疫反应,可激活破骨细胞活性促进牙槽骨吸收从而损害牙周组织[12]。IL-1β和TNF-α 协同刺激可抑制破骨细胞增殖、分化。本研究发现LPS 组细胞活力低于control 组,提示Pg LPS 诱导HGFs 后抑制细胞活力,细胞生长受到影响。Pg LPS 诱导 HGFs 可使细胞上清液中 IL-1β 和TNF-α 水平升高,提示 IL-1β和TNF-α 可能损害HGFs 导致细胞炎症严重,进而影响细胞生长。Cur处理Pg LPS 诱导的HGFs,随着剂量增加,细胞活性逐渐恢复,上清液中 IL-1β和TNF-α 水平逐渐降低,提示 Cur 可以减少 IL-1β和TNF-α 释放从而缓解炎症作用,但具体机制尚不清楚。
NF-κB 可参与应激反应、免疫和炎性疾病等过程,在牙周炎中可诱导炎症因子表达从而发挥促炎作用[13]。NF-κB 特异性药理抑制剂加入变形链球菌共培养的HGFs 可促进细胞增殖和胶原合成从而改变细胞活力和黏附性,改善 HGFs 状态[14]。IL-1β 和TNF-α 激活表面的细胞因子受体导致NF-κB 从细胞质转移向细胞核,从而促进炎症介质表达,促进炎症反应[15];活化 TNF-α 激活 NF-κB 信号通路进而抑制牙周膜干细胞成骨分化导致组织受损[16]。若将NF-κB 抑制在细胞浆中将会下调NF-κB 活化水平从而抑制炎症发生。本研究发现LPS 组细胞浆中NF-κB p-p65 蛋白水平低于 control 组,细胞核中 NF-κB pp65蛋白水平高于control组,激光共聚焦显微镜同样发现LPS 组NF-κB p-p65 蛋白向核转移较明显,提示可能是由于IL-1β 和TNF-α 等促炎因子的刺激导致NF-κB 从细胞质转移向细胞核发挥炎症作用和抑制HGFs生长。Cur处理Pg LPS 诱导的HGFs,随着剂量增加,细胞浆中NF-κB p-p65 蛋白水平升高、细胞核中 NF-κB p-p65 蛋白水平降低,NF-κB p-p65 活性被抑制从而减缓炎症反应,缓解疾病。
miRNA 在炎症中研究广泛,外伤性脑损伤后小胶质外泌体中miR-124 的增加抑制神经元炎症[17];miR-124 可通过NF-κB 信号通路调节鼻咽癌细胞增殖和凋亡[18];在Amadori糖化白蛋白诱导的视网膜小胶质细胞活化和炎症中miR-124 表达下调,下调miR-124 表达可刺激NF-κB p65 磷酸化并诱导视网膜小胶质细胞释放TNF-α 从而加重炎症反应[19]。本研究发现LPS组细胞中miR-124水平低于control 组,提示 miR-124 在 Pg LPS 诱导 HGFs 中表达下调,促进炎症反应,可能是 miR-124 下调促进 NF-κB p-p65 活化诱导炎症因子 IL-1β和TNF-α 激活并释放,IL-1β和TNF-α 激活后进一步促进NF-κB 从细胞质转移向细胞核加重炎症反应。Cur处理Pg LPS诱导的HGFs后miR-124 水平升高,且进一步发现,miR-124 mimic组细胞浆中NF-κB p-p65 蛋白水平高于LPS 组,细胞核中 NF-κB p-p65 蛋白水平低于 LPS 组,Cur 处理与过表达miR-124 功能类似,均可高表达miR-124 从而缓解上述过程从而实现对HGFs的保护。
综上所述,Cur 可能通过上调miR-124 进而抑制NF-κB p-p65入核实现对Pg LPS诱导的HGFs炎性反应的保护。但Cur 药理机理复杂,miR-124 有多个调控位点,Cur 具体影响miR-124 调控位点尚未清楚,也是接下来研究重点。
