IL-1RII和IL-1RAcP重组质粒对大鼠自身免疫性心肌炎的作用及机制*
2020-11-04刘春晓
常 贺, 宋 颖, 刘春晓
(1厦门大学附属翔安医院老年病科,福建厦门361100;2厦门大学附属心血管病医院,福建厦门361014;3复旦大学附属中山医院厦门医院,福建厦门361015)
心肌炎(myocarditis)是一种严重危害人类健康的心血管疾病,自身免疫介导的免疫反应在心肌炎发病进程中发挥重要作用[1]。实验性自身免疫性心肌炎(experimental autoimmune myocarditis,EAM)动物模型模拟人类心肌炎的临床过程,急性期出现充血性心衰,病理表现为弥漫性心肌坏死伴大量CD11b+和CD4+T淋巴细胞及多核巨细胞的浸润,慢性期进展为扩张型心肌病[2-3]。研究显示,CD4+T细胞及其分泌的多种细胞因子在EAM中发挥重要作用,白细胞介素1(interleukin-1,IL-1)在EAM 初始阶段的CD11b+细胞中高表达,并可诱导其他炎症因子的分泌,被认为是启动EAM 炎症的主要细胞因子[3]。我们前期的研究显示,导入 IL-1 II 型受体(IL-1 type II receptor,IL-1RII)的重组质粒对EAM有治疗作用[4-5],但具体机制尚不明确。因此,本研究从体内和细胞水平观察同时导入IL-1RII 和IL-1 受体辅助蛋白(IL-1 receptor accessory protein,IL-1RAcP)重组质粒对EAM的治疗作用并探讨其机制,为深入阐明心肌炎病人的发病机制及指导临床治疗提供参考资料[6]。
材料和方法
1 实验动物
雄性 Lewis 大鼠,SPF 级,6~8周龄,体重 180~200 g,购自北京维通利华实验动物技术有限公司[许可证号为SYXK(京)2018-0010]。所有大鼠均置于厦门大学动物实验中心SPF 级动物饲养室,温度16~25℃,湿度50%~70%,动物自由摄食水。本研究经厦门大学实验动物伦理委员会批准同意,且动物饲养及处理符合厦门大学动物伦理学标准。
2 主要试剂与仪器
含结核杆菌H37Ra 株的完全弗氏佐剂(complete Freund's adjuvant,CFA;Difco);SwaI、NotI、BamH I和XbaI 限制性核酸内切酶,T4 DNA 连接酶,逆转录试剂盒,LipofectamineTM2000 转染试剂(Thermo Fisher Scientific);Trizol(Invitrogen);SYBR荧光定量PCR试剂盒(TaKaRa);Real-time PCR Master Mix 试剂盒(TOYOBO);空载质粒pUC19、pEGFP-actin 和pEGFP-tubulin(优宝生物有限公司);引物合成(上海生工生物公司);琼脂糖凝胶回收试剂盒和质粒提取试剂盒(北京索莱宝科技有限公司);蛋白酶抑制剂(Roche);Protein A 琼脂糖珠(Santa Cruz);SDS-PAGE 试剂(Solarbio);IL-1RII 及 IL-1RAcP 抗体(Santa Cruz);α-tubulin 及 β-actin 抗体(Sigma-Aldrich);HRP 标记的羊抗兔Ⅱ抗(北京联科生物公司);HRP 标记的羊抗小鼠Ⅱ抗(Jackson);MyCycler梯度 PCR 仪(Bio-rad);7500 实时荧光定量 PCR 仪(ABI);Vivid 7型彩色多普勒血流显像仪(GE)。
3 方法
3.1 重组质粒的构建 (1)构建体内导入用重组质粒 pCAGGS-IL-1RII-Ig(IgG1Fc)-Glu(glucagon 19-29)和pCAGGS-IL-1RAcP-Ig-Glu:采用本实验室前期一直使用的重组质粒pCAGGS-Ig-Glu和对照质粒pCAGGSSP(signal peptide)-Ig-Glu,制备方法如前述[4-5,7]。(2)构建体外细胞转染用重组质粒pUC19-IL-1RII-actin、pUC19-IL-1RAcP-tub、pEGFP-IL-1RII-actin和pEGFPIL-1RAcP-tub。质粒载体见图1,引物序列见表1。

Figure 1.The vectors used for construction of recombinant plasmids.图1 构建重组质粒用载体
3.2 EAM 大鼠模型的建立 提纯猪心室肌球蛋白溶解于0.3 mol/L 氯化钾溶液中使得浓度为10 g/L,加入同等体积含结核杆菌H37Ra 株的CFA,充分混合后,在大鼠双足底皮下注射上述混合液,每只0.1 mL,以制备EAM模型。
3.3 重组质粒的体内导入 将实验大鼠(总计29只)分成4组:(1)对照(control)组(n=5):未免疫、未注射质粒的大鼠;(2)EAM+SP 组(n=9):第0 天免疫大鼠,第6天应用流体动力学基因导入技术[4-5,7],尾静脉注射pCAGGS-SP-Ig-Glu(800 μg);(3)EAM+IL-1RII组(n=8):对已免疫的大鼠尾静脉注射pCAGGS-IL-1RII-Ig-Glu(800 μg);(4)EAM+IL-1RII+IL-1RAcP组(n=7):对已免疫的大鼠尾静脉注射pCAGGS-IL-1RII-Ig-Glu(800 μg)和 pCAGGS-IL-1RAcP-Ig-Glu(800 μg)。第17天处死动物,评估导入以上重组质粒对EAM的作用。
3.4 超声心动图评估 第17天对所有大鼠腹腔注射10%水合氯醛(3 mL/kg),麻醉后仰卧位固定,采用GE Vivid 7 型彩色多普勒血流显像仪(探头频率14 MHz)行M型经胸超声心动图检测。
3.5 组织病理学评估 第17天处死所有大鼠,称取大鼠体重及心脏干重(去除血液),计算心重/体重比(ratio of heart weight to body weight,HW/BW;g/g)。获取心脏组织,10%甲醛溶液固定,石蜡包埋,切成5 μm厚度的切片进行HE染色。
3.6 心肌中炎症因子的检测 取大鼠心尖组织,Trizol 提取总RNA 并进行逆转录,合成cDNA(2 μg/20 μL),RT-qPCR 法检测心衰标志物心房钠尿肽(atrial natriuretic peptide,ANP)和脑钠尿肽(brain natriuretic peptide,BNP),以及炎症因子TNF-α、IL-2、IFN-γ、TGF-β、IL-10和IL-13的表达水平,GAPDH 作为内参照。扩增方法如前述[4-5,7],引物序列见表1。
3.7 重组质粒的体外细胞转染 Cos7细胞(非洲绿猴肾细胞)铺于六孔板,每孔约2×105个,将pUC19-IL-1RII-actin和pUC19-IL-1RAcP-tub各2 μg,与LipofectamineTM2000 转染试剂混合,加入 opti-MEM 稀释至100 μL,混合均匀后,将质粒与转染试剂形成的混合物直接加入培养基中,37℃、CO2培养箱培养72 h,留取含有IL-1RII和IL-1RAcP 蛋白的培养上清液,于-80℃保存备用。取pEGFP-IL-1RII-actin 和pEGFPIL-1RAcP-tub 各2 μg,与转染试剂形成的混合物直接加入培养基中,37℃、CO2培养箱培养72 h,弃上清,添加RIPA 蛋白裂解液30 min,收集细胞提蛋白,进行Western blot 和免疫共沉淀(co-immunoprecipitation,Co-IP)检测。

表1 构建质粒及RT-qPCR引物序列Table 1.The sequences of the primers for plasmid construction and RT-qPCR
3.8 LPS 诱导的H9c2 细胞中炎症因子的检测 将本实验室存有的H9c2 细胞(大鼠心肌细胞株)铺于6 孔板,每孔约 2×105个,分成 4 组:(1)对照(control)组(n=5):仅为静息细胞;(2)LPS 组(n=5):细胞中加入 LPS(1 g/L);(3)LPS+IL-1RII 组(n=5):细胞中加入LPS(1 g/L)+含有IL-1RII 蛋白的培养上清液 100 μL;(4)LPS+IL-1RII+IL-1RAcP 组(n=5):细胞中加入 LPS(1 g/L)+含有 IL-1RII和IL-1RAcP的培养上清液 100 μL。37℃、CO2培养箱培养24 h后收集细胞,提取RNA 合成cDNA,RT-qPCR 法测定炎症因子TNF-α、IL-2、TGF-β、IL-6、IL-10 及IL-13的表达水平。
3.9 Western blot 检测重组质粒转染入细胞 将Cos7 细胞分成静息细胞(control)组、转染pEGFP-IL-1RII-actin(IL-1RII)组、转染 pEGFP-IL-1RAcP-tub(IL-1RAcP)组和共转染pEGFP-IL-1RII-actin+pEGFP-IL-1RAcP-tub(IL-1RII+IL-1RAcP)组。收集细胞,抽提总蛋白,BCA 法测定蛋白浓度后,SDSPAGE 分离等量蛋白,冰上行转膜反应,添加BSA 封闭,清洗后添加 anti-IL-1RII(1∶1 000)或 anti-IL-1RAcP(1∶1 000),4℃过夜孵育,添加HRP标记的Ⅱ抗(1∶5 000),室温下孵育2 h,ECL 发光显影后置于凝胶成像仪中,GAPDH 为内参照,采用ImageJ 软件对蛋白表达灰度进行定量分析。
3.10 Co-IP 检测目的蛋白的形成 共转染pEGFPIL-1RII-actin+pEGFP-IL-1RAcP-tub 后的 Cos7 细胞提取的蛋白分成3 份:(1)阴性对照;(2)加1 μg anti-α-tubulin(1∶1 000)沉淀后孵育anti-IL-1RII 曝光,或加 1 μg anti-β-actin(1∶1 000)沉淀后孵育 anti-IL-1RAcP 曝光;(3)阳性对照(经mouse IgG 沉淀的蛋白)。4℃过夜孵育,protein A 琼脂糖珠加入到与抗体孵育过夜的细胞裂解液中,4℃孵育2~4 h,使抗体与protein A 琼脂糖珠偶联,将蛋白-抗体复合物拉下来,最后加入 15 μL 的 2× SDS 上样缓冲液,经 SDSPAGE检测目的蛋白的形成。
4 统计学处理
采用SPSS 18.0 软件进行统计分析。数据以均数±标准差(mean±SD)表示。多组间比较行单因素方差分析,进一步的两两组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 心脏组织病理学评估
心脏外观改变:与control 组比较,EAM+SP 组大鼠可见明显炎症充血、水肿伴大面积的心肌坏死(颜色变白),部分大鼠甚至出现心包积液;与EAM+SP组比较,EAM+IL-1RII 组和EAM+IL-1RII+IL-1RAcP组的心肌炎症程度均有减轻,见图2A。HE 染色显示,control组大鼠的心肌形态结构完整,细胞排列紧密,纤维结构排列规则;而EAM+SP 组大鼠心肌细胞破碎、坏死,细胞排列不规则,心肌纤维断裂,并伴有大量炎症细胞浸润;EAM+IL-1RII 组和EAM+IL-1RII+IL-1RAcP 组可见破碎和坏死的心肌细胞有所减少,以心肌纤维化为主,见图2B。
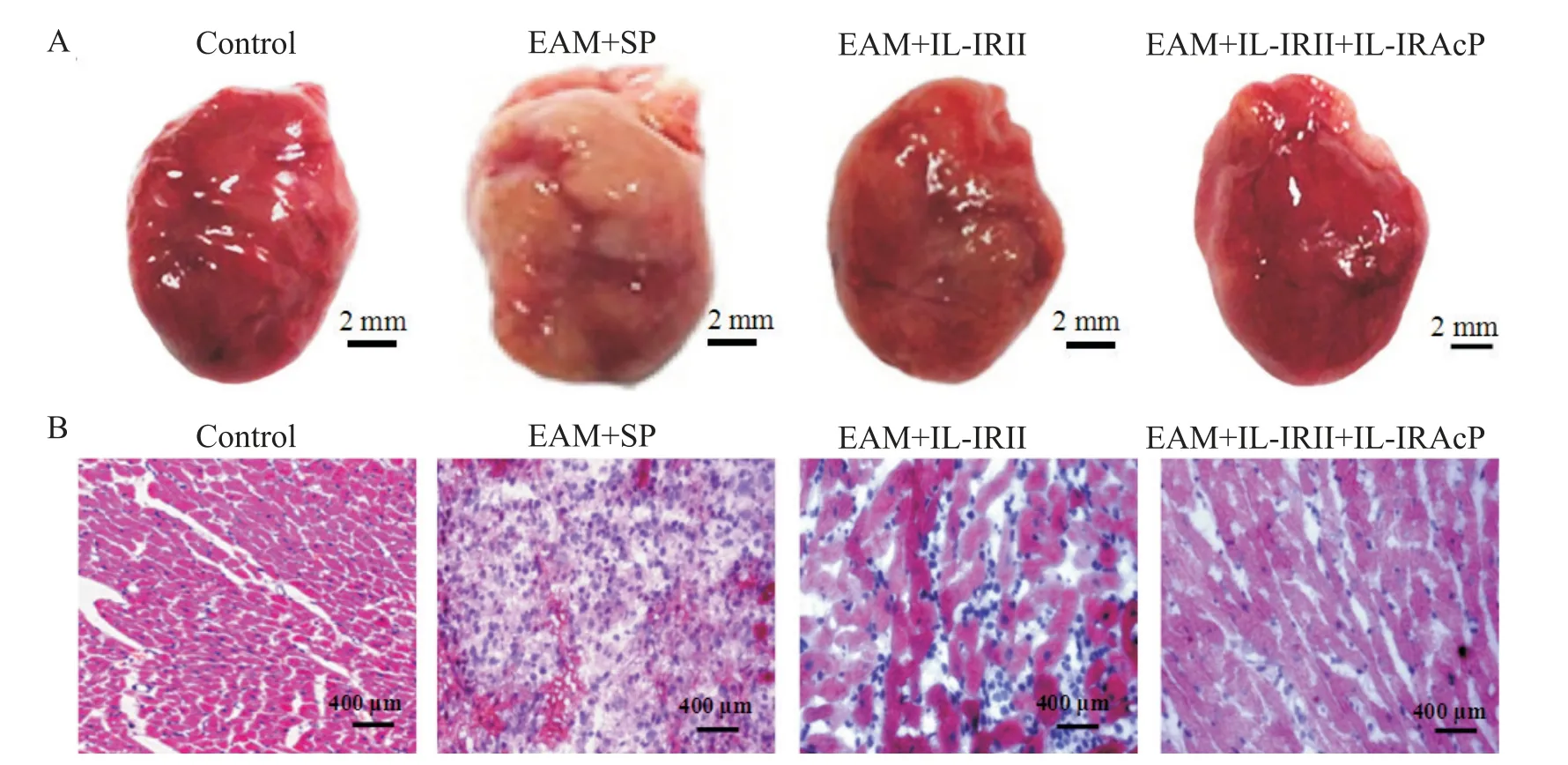
Figure 2.Assessment of myocardial pathomorphological changes.A:representative heart images;B:HE staining of the ventricular sections.图2 心脏外观及HE染色评价大鼠心肌组织病理形态学变化
2 心功能评估
第17天行超声心动图评估,结果显示,与control组比较,EAM+SP 组左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDd)和左心室收缩末期内径(left ventricular end-systolic dimension,LVEDs)显著增大(P<0.01),射血分数(ejection fraction,EF)和左室短轴缩短率(fractional shortening,FS)显著降低(P<0.01);与EAM+SP 组比较,EAM+IL-1RII+IL-1RAcP 组LVEDs 显著缩小(P<0.05),EF和FS 有轻度升高,但差异无统计学意义;与EAM+IL-1RII 组比较,EAM+IL-1RII+IL-1RAcP 组 LVEDd显著缩小(P<0.05),见图3。
3 HW/BW 和心肌中心衰标志物的表达
与 control组比较,EAM+SP 组大鼠 HW/BW 及心肌中心衰标志物ANP 和BNP 的水平均显著升高(P<0.01);与EAM+SP组比较,EAM+IL-1RII组和EAM+IL-1RII+IL-1RAcP 组大鼠 HW/BW 及心肌中 ANP 和BNP水平均显著降低(P<0.01),见图4。
4 心肌中炎症因子的表达
RT-qPCR 结果显示,与control 组比较,EAM+SP组心肌中 TNF-α、IL-2、IFN-γ和TGF-β 的 mRNA 表达水平均显著升高(P<0.01),IL-4和IL-13的表达水平轻度降低,但差异无统计学意义;与EAM+SP 组比较,EAM+IL-1RII组TNF-α和IL-2的表达水平显著降低(P<0.05),IL-4 的表达水平显著升高(P<0.05),EAM+IL-1RII+IL-1RAcP 组 TNF-α、IL-2、IFN-γ 和TGF-β 的表达水平均显著降低(P<0.01),IL-4 和IL-13 的表达水平显著升高(P<0.01),尤其是IL-13 的水平较 EAM+IL-1RII 组显著升高(P<0.01),见图5E、F。
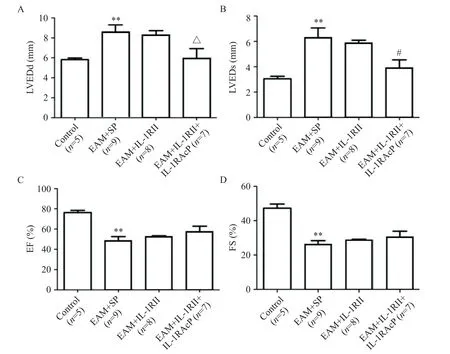
Figure 3.Echocardiogram for determining cardiac structutre and function of the rats in each group.A:left ventricular end-diastolic diameter(LVEDd);B:left ventricular end-systolic diameter(LVEDs);C:left ventricular ejection fraction(EF);D:left ventricular fractional shortening(FS).Mean±SD. **P<0.01 vs control group;#P<0.05 vs EAM+SP group;△P<0.05 vs EAM+IL-1RII group.图3 超声心动图测定大鼠心脏结构和功能

Figure 4.Assessment of ratio of heart weight to body weight(HW/BW;A),and ANP(B)and BNP(C)mRNA expression in the heart.Mean±SD.**P<0.01 vs control group;#P<0.05,##P<0.01 vs EAM+SP group.图4 大鼠心脏重量/体重比及心肌中ANP和BNP的表达
5 LPS诱导的H9c2细胞中炎症因子的表达
RT-qPCR 结果显示,与 control 组比较,LPS 刺激细胞后TNF-α、TGF-β、IL-2和IL-6的mRNA表达水平均显著升高(P<0.01),提示LPS成功诱导了细胞发生炎症反应;进一步加入含有IL-1RII和IL-1RAcP 的培养上清后,与LPS 组比较,LPS+IL-1RII 组和LPS+IL-1RII+IL-1RAcP组TGF-β和IL-6的表达水平显著降低(P<0.01),IL-10 的表达水平显著升高(P<0.05);与LPS+IL-1RII组比较,LPS+IL-1RII+IL-1RAcP组TNF-α 和IL-2 的表达水平降低得更显著(P<0.05),IL-13的表达水平显著升高(P<0.01),见图6。

Figure 5.The expression of inflammatory factors in rat myocardial tissues.The relative mRNA levels were detected by RT-qPCR and normalized to the internal control GAPDH.A:TNF-α;B:IL-2;C:IFN-γ;D:TGF-β;E:IL-4;F:IL-13.Mean±SD.**P<0.01 vs control group;#P<0.05,##P<0.01 vs EAM+SP group;△△P<0.01 vs EAM+IL-1RII group.图5 大鼠心肌中炎症因子的表达
6 IL-1RII和IL-1RAcP质粒被成功转染入细胞
Western blot 结果显示,转染IL-1RII或IL-1RAcP一种质粒后,检测到IL-1RII或IL-1RAcP 的蛋白表达量均比control 组升高,提示质粒转染成功;而共转染IL-1RII和IL-1RAcP两种质粒后 ,IL-1RII和IL-1RAcP 的表达量均比单独转染一种质粒的表达量更高,提示两种质粒共转染成功,见图7。
7 IL-1RII/IL-1RAcP异源二聚体的形成
样品均为共转染IL-1RII 和IL-1RAcP 两种重组质粒后提取的蛋白,且被分为3份。图8A 中,1为阴性对照,2 为目的蛋白(经anti-α-tubulin 沉淀的蛋白加anti-IL-1RII),3 为阳性对照(经mouse IgG 沉淀的蛋白),Co-IP 结果显示,第2 列在约56 kD 处(rat IL-1RII 的分子量为46 kD,rat IL-1RAcP 的分子量为66 kD)检测到一个新的蛋白条带。在图8B 中,1 为阴性对照,2为阳性对照(经mouse IgG 沉淀的蛋白),3为目的蛋白(经anti-β-actin 沉淀的蛋白加anti-IL-1RAcP),Co-IP 结果显示,第 3 列在约 56 kD 处检测到一个新的蛋白条带。这些结果提示IL-1RII 和IL-1RAcP两者结合形成了一个新的异源二聚体。
讨 论
本研究首先从体内水平评估了导入IL-1RII 和IL-1RAcP 重组质粒对EAM 的作用,我们前期构建了质粒pCAGGS-Ig-Glu 和对照质粒pCAGGS-SP-Ig-Glu[4-5,7],在此基础上构建了重组质粒 pCAGGS-IL-1RII-Ig-Glu 和pCAGGS-IL-1RAcP-Ig-Glu。构建质粒载体时融合了IgG1Fc 片段,不仅可以使得目的基因获得更长的循环半衰期并具有免疫球蛋白的特性,还可以使之与配体有更强的亲和力及维持血中持续高浓度水平。另外,为了检测质粒导入后的血中浓度,我们在质粒载体上融合了glucagon 19-29 片段,这样通过检测血中glucagon 的浓度可以间接反映重组质粒导入体内后的浓度[5]。
我们前期的研究已显示,尾静脉注射IL-1RII 重组质粒后,在肝脏和心脏组织中均检测到过表达,证明质粒被有效稳定地导入EAM 大鼠体内[4-5]。本研究结果显示,尾静脉注射IL-1RII和IL-1RAcP 两种重组质粒后,与EAM+SP 组相比,EAM+IL-1RII 组和EAM+IL-1RII+IL-1RAcP组大鼠EAM 均显著减轻,表现为左室内径缩小,HW/BW 减小,心衰标志物ANP和BNP 水平降低,心肌中炎症因子TNF-α、IL-2、IFN-γ和TGF-β表达降低,IL-4和IL-13的表达升高,尤其是同时导入两种质粒能够更强力地抑制炎症因子的表达。我们前期的研究显示,多种炎症因子如IL-1β、TNF-α、IFN-γ、IL-17、IL-6 等在 EAM 早期的急性炎症阶段高表达,在促进炎症方面起主导作用[8-9];而IL-13、IL-10、IL-4 等因子在 EAM 中后期的细胞免疫反应阶段高表达,发挥抗炎作用而缓解EAM[10-11]。IL-1是一种T淋巴细胞激活因子,主要产生于单核细胞、巨噬细胞、自然杀伤细胞等,是调节细胞免疫的主要致炎细胞因子,并且可以诱导其他一些炎症细胞因子如TNF-α、MCP-1、IL-6 等的激活,故被认为是炎症的主要效应因子,其中IL-1β是炎症和宿主防御的重要调节因子,在促进炎症和自身免疫等方面起主导作用[12]。IL-1RII和IL-1RAcP 是 IL-1 受体家族中的重要成员,IL-1RI 是功能性受体,当与IL-1β 结合时具有较高的亲和力,可以招募IL-1RAcP 形成异源二聚体从而发挥促炎作用;相反,IL-1RII作为抑制性受体,因其胞内缺乏Toll 样受体区域,可以与IL-1RI竞争性结合IL-1β,故IL-1RII与IL-1RAcP结合形成异源二聚体后,在一些炎症性疾病中通过抑制IL-1 而发挥抗炎作用[12-13]。在本研究中,我们检测了转染IL-1RII 和IL-1RAcP 重组质粒后获取的培养上清对LPS 诱导的H9c2 细胞中炎症因子的作用,结果显示,与 LPS 组比较,LPS+IL-1RII 组和 LPS+IL-1RII+IL-1RAcP 组 TGF-β和IL-6 表达水平显著降低,IL-10表达水平显著升高,尤其是LPS+IL-1RII+IL-1RAcP组TNF-α 和IL-2 的水平显著降低。因此本研究不仅在体内水平证明了IL-1RII 和IL-1RAcP 对EAM 有更强的抗炎作用,而且在细胞水平也证明了两种蛋白可更强力地抑制炎症因子的表达,这是对抗炎作用机制的初步阐明。
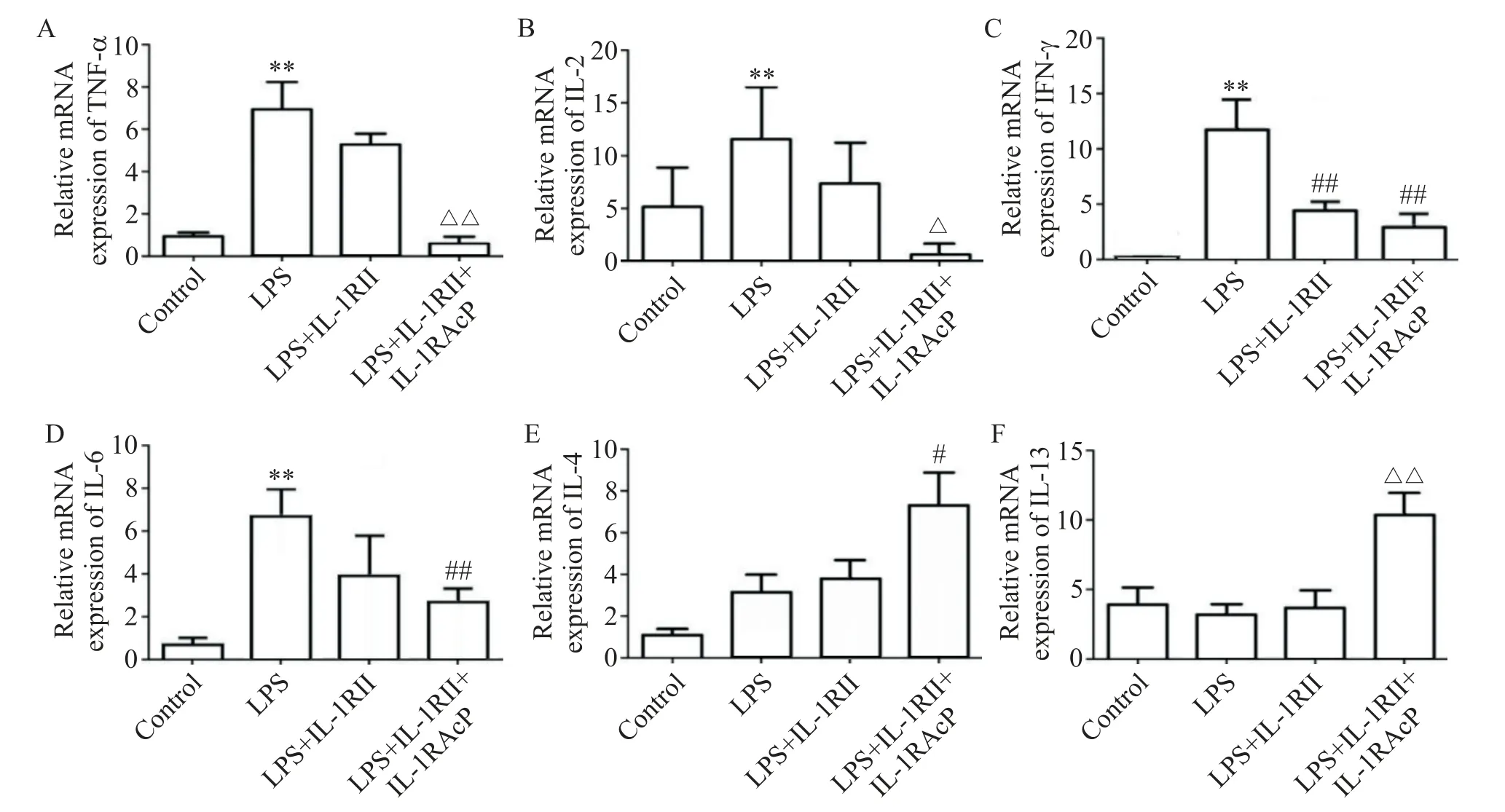
Figure 6.The expression of inflammatory factors in LPS-induced H9c2 cells.The relative mRNA levels were detected by RT-qPCR.A:TNF-α;B:IL-2;C:TGF-β;D:IL-6;E:IL-10;F:IL-13.Mean±SD. n=5. **P<0.01 vs control group;#P<0.05 vs LPS group;△P<0.05,△△P<0.01 vs LPS+IL-1RII group.图6 LPS介导的H9c2细胞中炎症因子的表达
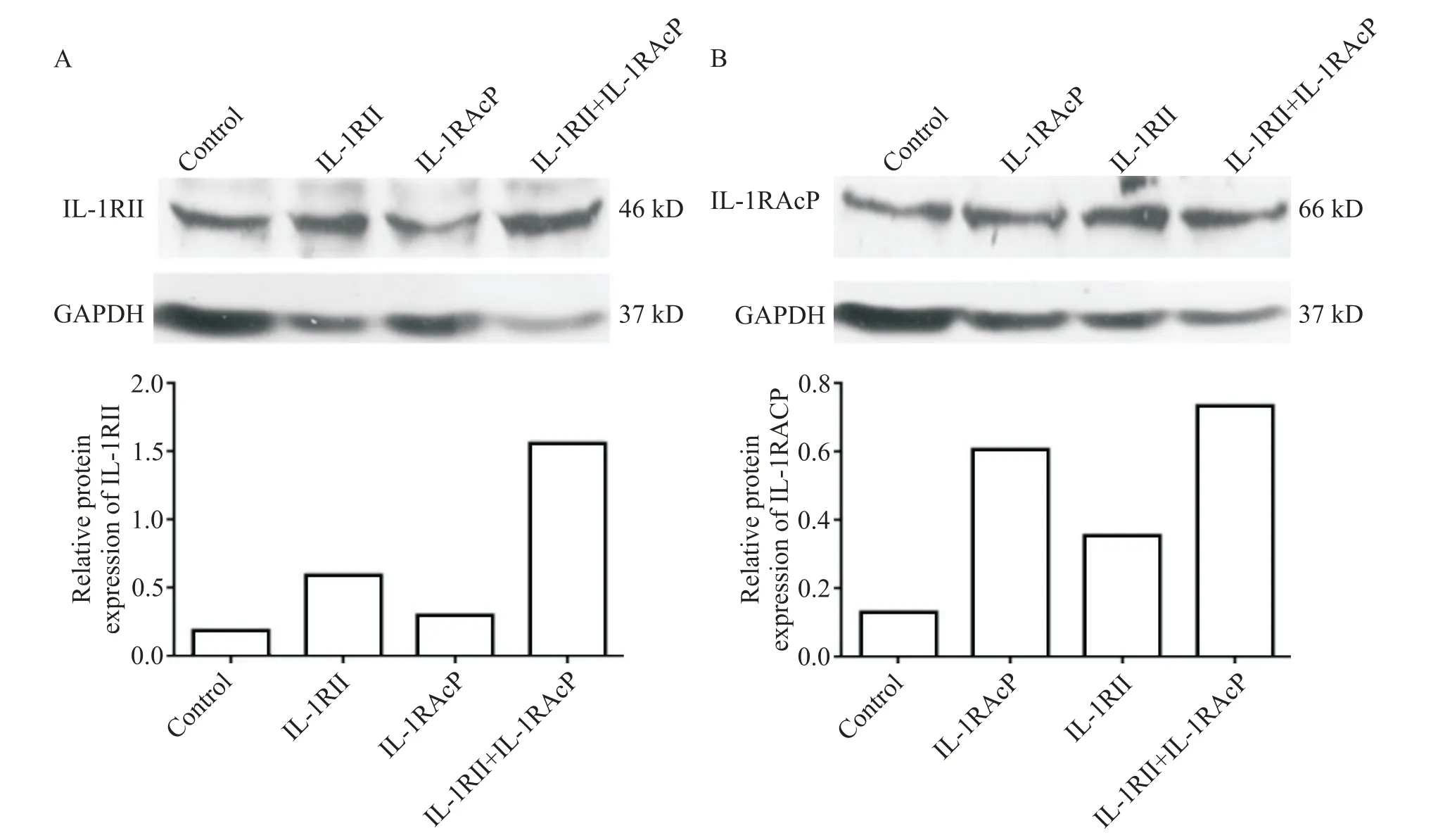
Figure 7.Identification of recombinant plasmid transfection into cells.A:the protein expression of IL-1RII;B:the protein expression of IL-1RAcP.Cos7 cells were transfected with recombinant plasmids pEGFP-IL-1RII-actin(IL-1RII group),pEGFPIL-1RAcP-tub(IL-1RAcP group)or pEGFP-IL-1RII-actin and pEGFP-IL-1RAcP-tub(IL-1RII+IL-1RAcP group).The protein levels were detected by Western blot,and GAPDH served as internal control.图7 Western blot鉴定重组质粒被成功转染入细胞

Figure 8.Detection of IL-1RII/IL-1RAcP heterodimer formation by Co-IP.A:proteins precipitated by anti-α-tubulin plus anti-IL-1RII;B:protein precipitated by anti-β-actin plus anti-IL-1RAcP.Cos7 cells were co-transfected with recombinant plasmids pEGFP-IL-1RII-actin and pEGFP-IL-1RAcP-tub.图8 免疫共沉淀检测IL-1RII/IL-1RAcP异源二聚体的形成
为进一步明确IL-1RII 和IL-1RAcP 两者是否可以相互结合形成异源二聚体,我们将IL-1RII 和IL-1RAcP 两种重组质粒转染入细胞,Co-IP检测到一个新的融合蛋白,间接验证了两者相互结合形成了异源二聚体。二聚体是两种蛋白质相互作用的形式,可以看作是两种功能相关或结构相似的亚单位组成的一种蛋白质-蛋白质复合物。若组成二聚体的两种亚单位的结构和功能完全相同则称为同源二聚体,若结构或功能不完全相同则称为异源二聚体。目前关于IL-1RII/IL-1RAcP 异源二聚体的研究相对较少。Hanawa 等[14]在细胞水平用分离纯化的方法,不仅鉴定了IL-1RII/IL-1RAcP异源二聚体的存在,而且发现此异源二聚体较IL-1 受体拮抗剂(IL-1 receptor antagonist,IL-1Ra)对 IL-1 有更强的抑制作用。Wang 等[15]解析了 IL-1β 与 IL-1RII/IL-1RAcP 异源二聚体结合的空间晶体结构,生化分析表明,IL-1β-IL-1RI和IL-1β-IL-1RII 与 IL-1RAcP 的结合具有一定的相似性,同时也明确了IL-1Ra 对IL-1 的重要拮抗作用,为IL-1 受体家族的激活提供了结构基础。Ge等[16]进一步解析了 IL-1RII/IL-1RAcP 异源二聚体的结构功能域,明确了IL-1受体家族在细胞外区含有3个免疫球蛋白样结构域(D1~D3),负责传递IL-1 细胞因子的多向信号,并应用小角度X 射线散射技术证明了配体结合的共受体由于D2/D3 连接体而具有固有的结构域间灵活性,表明了D2/D3连接体是IL-1受体重要的功能决定因素,并强调了结构域间灵活性在细胞因子/受体结合和信号传递中的重要作用。这些研究从空间结构上解析了IL-1RII 和IL-1RAcP两者可以结合形成异源二聚体,但未对功能进行深入探讨。本实验首次在体内水平评估了导入IL-1RII和IL-1RAcP 重组质粒对EAM 的作用,并且从机制上进行了初步探讨,鉴定了IL-1RII和IL-1RAcP 两者可以相互结合形成异源二聚体,并观察了对炎症因子表达的影响。
综上所述,本研究发现IL-1RII和IL-1RAcP 重组质粒导入可有效缓解大鼠EAM 的炎症损伤,其机制与两者结合形成异源二聚体并强力抑制炎症因子的表达有关。关于异源二聚体的功能区解析以及异源二聚体的作用,还有待后续进一步探究。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
