降低脑脊液miR-16的水平对大鼠抑郁样行为的影响*
2020-11-05李桂萍宋明芬王晟东刘文娟胡霖霖张永华
李桂萍, 宋明芬, 李 静, 王晟东, 刘 义, 刘文娟, 胡霖霖, 张永华
(杭州市第七人民医院 1老年科,2分子生物学实验室,3心身科,浙江杭州310013;4杭州市中医院内科,浙江杭州310007)
目前普遍认为抑郁症的发病是遗传和环境因素相互作用的结果[1-2]。作为表观遗传学中的重要分子,微小RNA(microRNA,miRNA,miR)是真核生物体内一种内源性的、长约20~25 nt、具有调控基因表达功能的非编码 RNA[3]。目前,多个 miRNAs 被报道可能参与了抑郁症发病过程中的基因表达调节[2-4],例如,miR-16 因其序列与5-羟色胺转运体(serotonin transporter,SERT)的3'端非翻译区匹配,从而可能在翻译水平调节SERT的表达,并介导抗抑郁药的疗效发挥[5-6];miR-135a 则能同时调节 SERT 和5-HT1a 受体基因表达,与转基因小鼠的焦虑或抑郁样行为改变相关[7];另外,miR-1202因参与调节代谢型谷氨酸受体4 的表达,被认为与抑郁症的病理机制及其抗抑郁药的疗效相关[8]。
近年来,我们研究发现,抑郁症患者及抑郁大鼠模型脑脊液中 miR-16 水平降低[9-10],且脑脊液中miR-16 水平的大幅下降可导致大鼠出现抑郁样行为[10]。为进一步明确miR-16 在抑郁症发病机制中的作用,本实验通过人为降低脑脊液中miR-16 至不同水平,着重探讨其与中缝核miR-16 与SERT 水平的剂量反应关系,并观察对抑郁行为学指标的影响,为探明抑郁症发病机制并确定生物标志物提供参考。
材料和方法
1 动物
无特定病原体(specific pathogen free,SPF)级健康雌性 Sprague-Dawley(SD)大鼠 50 只,购自浙江省医学科学院实验动物中心,动物合格证号为SCXK(浙)2014-0001,8 周龄,体重200~250 g。饲养室温度(25±1)℃,相对湿度(55±5)%,12 h/12 h 明暗交替,充足的水和食物供大鼠自由摄入。
2 方法
2.1 动物分组 将大鼠随机分为空白对照(saline)组、阴性对照(negative control)组及miR-16 拮抗剂5 nmol组、10 nmol组和20 nmol组,每组10只。
2.2 侧脑室注射 大鼠在4%异氟烷(流速1 L/min)诱导麻醉后,固定于脑立体定位仪(购自瑞沃德生命科技有限公司),2%异氟烷(流速0.5 L/min)维持麻醉,定位侧脑室注射点(上切牙板平面比耳间线平面低2.4 mm,保持前囟点后1.2 mm,中线旁开2 mm,深4 mm)。在侧脑室注射点用牙科钻开一小孔,用牙托粉和502 胶混合,固定导管,用于注射溶液。将一次性7 号注射针头剪成长约5 mm 的导管,把插入口磨光滑,并配备略小于导管内径的尼龙线内芯,用于注射后堵塞导管口,防止感染和脑脊液漏,注射体积为20 μL,miR-16拮抗剂(由上海吉玛基因合成)3 个剂量组分别注射miR-16 拮抗剂5、10、20 nmol,阴性对照组和空白对照组大鼠分别注射等量阴性对照液(上海吉玛基因)和生理盐水,隔天注射1次,共3 次。本次实验的miR-16 拮抗剂采用miR-16 antagomir,其经过特殊化学修饰,在动物体内外具有很高的稳定性和抑制miRNA功能发挥的效果。
2.3 蔗糖偏好实验 包括训练和测试2 个部分。在训练实验中,每笼放置2瓶1%的蔗糖溶液,24 h后将其中1 瓶蔗糖溶液换成自来水,24 h 后进行测试。测试阶段,每只大鼠单笼饲养,禁食禁水23 h,给予1瓶为1%的蔗糖溶液和1瓶自来水,1 h后,测定蔗糖水和自来水的消耗量。糖水偏好率(%)=糖水消耗量/(糖水消耗量+自来水消耗量)×100%。
2.4 强迫游泳实验 采用强迫游泳系统(EthoVision XT)进行实验,游泳桶为高度50 cm、直径30 cm的圆柱形透明塑料桶,水温(25±1)℃,水深30 cm。将大鼠逐一放入水中适应15 min 后,取出烘干,置回笼中。24 h 后,再次将大鼠逐一放入水中,每只大鼠摄像头录像5 min,记录在此期间的不动时间。以大鼠漂浮在水中而不挣扎,仅有必要的动作保持头部在水面以上,或接触水池底部超过1 s 的时间作为不动的标准。
2.5 脑脊液与中缝核的取材 大鼠麻醉后,头颈部剪毛,碘伏消毒,沿纵轴切一约2 cm 的切口,钝性分离颈部背侧肌肉,暴露枕骨大孔,由枕骨大孔进针抽取脑脊液。随后,剪开颅骨,分离脑组织置于冰上,取下脑干,在脑干正中切取约1 mm 厚的组织,即为中缝核。
2.6 RT-qPCR法测定miR-16的表达水平 通过总RNA提取试剂盒[天根生化科技(北京)有限公司]提取脑脊液和中缝核的总RNA,用NanoDrop(Thermo Scientific)测定浓度和纯度;取 2 μg 总 RNA 用 cDNA第1 链合成试剂盒[天根生化科技(北京)有限公司]反转录成cDNA,步骤如下:取10 μL 2×miRNA 转录反应液、2 μL 酶溶液,混合,加入2 μg 总RNA,补足水(无RNAase)至20 μL,37℃放置60 min。通过该反应,在Poly(A)聚合酶的作用下,miRNAs 3’端加上poly A 尾巴;Oligo(dT)与 Poly A 尾巴结合;最后,在逆转录酶的作用下,将总miRNAs 逆转录成cDNA。取cDNA 进行实时定量荧光PCR 扩增测定miR-16 水平,miRNAs 荧光定量检测试剂盒(SYBR Green)购自天根生化科技(北京)有限公司。miR-16的正向引物序列为5'-TAGCAGCACGTAAATTGGCG-3',反向引物从miRNAs荧光定量检测试剂盒中获得,序列未显示。反应体系为20 μL,包含10 μL 2×反应缓冲液、0.5 μL 正向引物(终浓度0.25 μmol/L)、0.5 μL 反向引物(终浓度 0.25 μmol/L)、1 μL cDNA 模板、1 μL ROX 染料、7 μL 水(无 RNAase)。PCR 扩增程序为94℃ 2 min 预变性;然后94℃ 20 s、52℃ 30 s、72℃ 30 s,循环 35 次。荧光 PCR 仪购自 ABI(型号 StepOne Plus),获得 Ct值,并根据内参照 U6 计算 miR-16 的相对含量。
2.7 Western blot法测定SERT蛋白的表达 使用总蛋白提取试剂盒(碧云天生物技术有限公司)提取中缝核组织的总蛋白,并且通过BCA 法对蛋白进行定量。取8 μL蛋白提取液(约50 μg)与2 μL 5×上样缓冲液混合后,置于沸水中5 min,使蛋白变性,冷却至室温后,上样至SDS-PAGE 胶的加样孔中,100 V 电泳2 h(电泳装置为Bio-Rad 生产)。电泳结束后,用转膜装置在300 mA 电流下将蛋白转至PVDF 膜上。PVDF 膜经封闭后,进行I抗和II抗孵育,然后进行化学发光、显影和定影。抗SERTI抗和II 抗均购自Santa Cruz。使用ChemiDocTMXRS+分子成像仪(Bio-Rad)进行蛋白条带分析,并用内参照β-actin 校正,得出SERT蛋白的相对水平。
3 统计学处理
统计分析采用SPSS 19.0 统计学软件。实验数据用均数±标准差(mean±SD)表示,5 组间脑脊液miR-16 和中缝核miR-16、中缝核SERT 水平及抑郁样行为指标的比较采用方差分析,组间比较采用SNK-q检验,组内治疗前后比较采用配对t检验,3 个剂量拮抗剂组间的剂量反应关系分析采用Spearman偏相关分析。以P<0.05为差异有统计学意义。
结 果
1 脑脊液中miR-16水平的变化
空白对照组与阴性对照组比较,脑脊液中miR-16 水平的差异无统计学显著性(P>0.05);拮抗剂5 nmol 组、10 nmol 组和 20 nmol 组 miR-16 水平均显著低于空白对照组和阴性对照组(P<0.05),见图1。脑脊液中miR-16 水平与拮抗剂的注射剂量呈负相关关系(r=-0.92,P<0.05)。
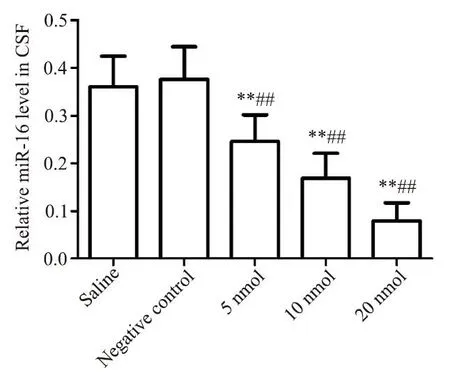
Figure 1.Relative miR-16 level in cerebrospinal fluid(CSF)of the rats in each group.Mean±SD. n=10.**P<0.01 vs saline group;##P<0.01 vs negative control group.图1 各组大鼠脑脊液miR-16水平的比较
2 中缝核miR-16水平的变化
空白对照组与阴性对照组比较,中缝核中miR-16 水平的差异无统计学显著性(P>0.05);拮抗剂5 nmol 组、10 nmol 组和 20 nmol 组中缝核 miR-16 水平均显著低于空白对照和阴性对照组(P<0.05),见图2。中缝核miR-16 水平与拮抗剂的注射剂量呈负相关关系(r=-0.57,P<0.05)。
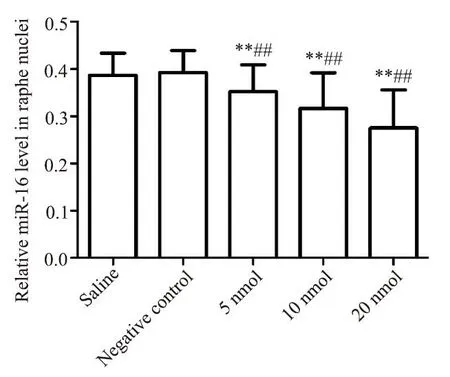
Figure 2.Relative miR-16 levels in raphe nuclei of the rats in each group.Mean±SD. n=10.**P<0.01 vs saline group;##P<0.01 vs negative control group.图2 各组大鼠中缝核miR-16水平的比较
3 中缝核SERT的蛋白水平变化
与阴性对照组比较,空白对照组中缝核中SERT蛋白水平的差异无统计学显著性(P>0.05);拮抗剂5 nmol 组、10 nmol 组和 20 nmol 组中缝核 SERT 蛋白水平均显著高于空白对照组和阴性对照组(P<0.05或P<0.01),见图3。中缝核SERT 蛋白水平与拮抗剂的注射剂量呈正相关关系(r=0.49,P<0.05)。

Figure 3.Western blot was used to determine the protein levels of SERT in the raphe nuclei of rats with different treatments.Mean±SD. n=10.*P<0.05,**P<0.01 vs saline group;#P<0.05,##P<0.01 vs negative control group.图3 Western blot检测各组中缝核SERT的蛋白水平
4 行为学指标的变化
采用蔗糖偏好实验和强迫游泳实验评价大鼠的抑郁样行为。注射前,蔗糖偏好率和不动时间在各组间比较差异无统计学显著性(P>0.05)。注射后,两指标的组间差异显著(P<0.05),其中10 nmol组和20 nmol 组的蔗糖偏好率明显低于空白对照组、阴性对照组及同组注射前(P<0.05,P<0.01),不动时间明显长于空白对照组、阴性对照组及同组注射前(P<0.01)。3个剂量组之间比较,随着注射剂量的增加,蔗糖偏好率显著降低、不动时间则明显延长(P<0.05,P<0.01)。见表1。
讨 论
研究证实,许多miRNAs在神经系统中的特异表达,与神经系统发育、分化、生长、记忆、突触可塑性及生物钟调节等密切相关[11-12],其中,miR-16 被认为与抑郁症的关系十分密切。2010 年,Baudry 等[6]在《Science》上发表论文称,1C11 神经内分泌细胞系有两个分化方向,即分泌去甲肾上腺素的细胞系和分泌5-羟色胺(5-hydroxytryptamine,5-HT)的细胞系,其中分泌去甲肾上腺素的细胞系miR-16 表达水平低,但是SERT 合成增加;而分泌5-HT 的细胞系则相反,由此作者首次提出miR-16 与SERT 的靶标关系;另外,该研究还指出选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs)氟西汀通过miR-16 介导了SERT 蛋白的抑制性表达。而后,又有研究者以人肺癌上皮细胞A549、人胎盘绒膜癌细胞系JAR及大鼠中缝核神经元细胞系RN46A为研究对象来研究miR-16 与SERT 的靶标关系,结果表明,miR-16 通过下调SERT基因的表达而影响5-HT递质转运系统[13-14]。
基于miR-16 对SERT基因表达的调节作用,miR-16 可能参与抑郁症的病理生理过程。但是,抑郁症患者血液中miR-16 的水平与健康对照比较无统计学差异[10],分析原因,可能是由于血液中的miR-16 受体内外多种因素的影响,其在抑郁症患者和健康对照间的差异已不甚明显,从而限制了其在抑郁症发病中的作用。
众所周知,脑脊液因其所在的部位及其生理学作用,比血液能更好地反应大脑病理过程中的各项指标变化[15-16]。在脊椎动物体内,脑组织内有丰富的miRNAs[17],一方面提示 miRNAs 可能在脑功能的发挥中起着重要作用,另一方面,脑脊液miRNAs 的表达水平可能有别于血液miRNAs,它或许能反映脑组织中的某些变化。已有研究者指出,脑脊液中的miRNAs 可能参与某些神精疾病的病理过程,如阿尔茨海默病患者[18]和帕金森氏病患者[19]的脑脊液中,均有miRNAs 的表达异常,miRNAs 可能成为这些疾病的生物标志[20]。在抑郁症方面,Wan 等[21]对抑郁症患者脑脊液中miRNAs 进行了检测,发现血清中miR-221-3p,miR-34a-5p和let-7d-3p 水平高于健康对照,而miR-451a 水平低于健康对照。我们研究发现,抑郁症患者的脑脊液miR-16 水平明显低于健康对照组[10],另外,我们建立慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)模型,检测了该模型大鼠脑脊液中miR-16 的水平,也得出其水平低于对照组大鼠的结果[9]。
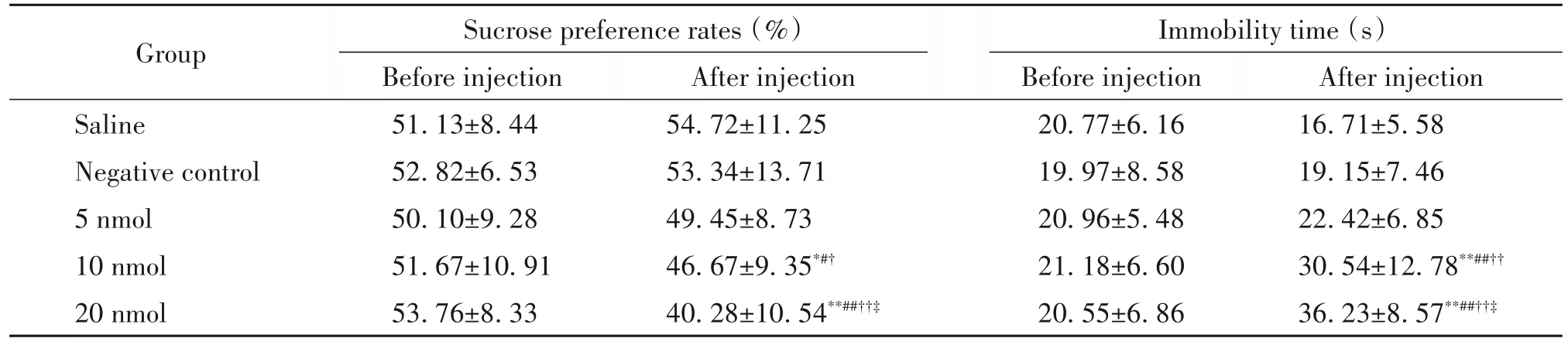
表1 各组大鼠蔗糖偏好率与不动时间的比较Table 1.Sucrose preference rates and immobility time among each group(Mean±SD. n=10)
miRNA 拮抗剂成为近年来研究miRNA 沉默作用的重要手段,它是根据miRNA 成熟体序列而设计的单链RNA,通过与体内成熟miRNA 结合,阻止miRNA 与其靶基因mRNA 的互补配对的同时,引起miRNA 降解,从而抑制miRNA 发挥作用。为进一步验证miR-16 在抑郁症发病机制中的作用,本实验通过侧脑室注射miRNA 拮抗剂,探讨人为降低脑脊液miR-16 至不同水平对中缝核miR-16 和SERT 水平的影响及其剂量反应关系。结果显示,各拮抗剂组的脑脊液miR-16 水平和中缝核miR-16 水平与对照组比较,均有不同程度的下降,而中缝核SERT 蛋白水平则增加,该结果与其他文献报道一致,即miRNA拮抗剂能有效降低动物体内miRNA 水平、提升其靶基因表达[6,22]。但是,目前的研究均未进行剂量反应关系探讨,而本实验得出miR-16 拮抗剂注射剂量与中缝核miR-16 水平呈负相关关系、与中缝核SERT蛋白表达呈正相关关系,这是本实验的特色之一。
在抑郁行为学实验中,拮抗剂10 nmol 组和20 nmol 组表现出明显的抑郁样行为,而5 nmol 组的抑郁样行为尚不明显,可能是因为miR-16 的小幅下降尚不能达到引起行为改变的阈值,对此有待进一步研究。
本次实验中,虽然各剂量组脑脊液miR-16 水平下降明显,但是中缝核miR-16 和SERT 水平却变化有限(约10%~20%),其原因可能有以下几点:(1)注入的miR-16 拮抗剂随脑脊液流动而分布于其他脑区,减少了进入中缝核的量;(2)中缝核miR-16 水平下降后,机体启动负反馈性调节,从而使中缝核miR-16 下降不明显;(3)除了 miR-16 外,SERT基因表达还受其他因素调节,比如miR135a[7]。目前的研究显示,miRNAs 与靶基因并非一一对应关系,即每个miRNA 可以有多个靶基因,而几个miRNAs 也可以共同调节同一个基因[23]。根据文献报道,抑郁症患者血液和脑组织中的miR135a 水平显著降低;服用抗抑郁药后,miR135a 水平上调;miR-135a基因过表达小鼠的中缝核SERT 蛋白表达明显降低,而miR-135a基因敲除小鼠则相反[7]。因此,基于基因表达调节的多因素性,miR-16 水平降低可能在一定程度上影响到SERT基因表达。
本研究存在的不足:(1)只分析了降低脑脊液miR-16 水平对中缝核组织的影响。海马、前额叶和蓝斑核等都可能参与抑郁症的发生和发展[6,11,24];(2)只分析了对SERT基因的调节作用。根据miRNAs 对基因调节的网络作用,miR-16 可能还参与其他抑郁症相关基因的调节[23];(3)未将 miR-16 与其他 miRNAs(如 miR-135a)结合来探讨对SERT基因表达以及抑郁样行为的影响。后续实验有待针对以上不足,进行深入研究。
总之,本次实验表明,降低脑脊液miR-16 水平可影响大鼠中缝核miR-16 及SERT基因表达,并与抑郁样行为相关,初步探明脑脊液miR-16 作为抑郁症生物标志物和新治疗靶点的可行性。
