27nt-miRNA对氧化型低密度脂蛋白诱导的人脐静脉内皮细胞凋亡的影响*
2020-11-04赵燕姣颜渊鸳罗雪兰周福隆杨瑞霞唐双意欧和生
赵燕姣, 颜渊鸳, 李 丹, 罗雪兰, 杨 鹏,周福隆, 杨瑞霞, 唐双意, 欧和生△
(1广西医科大学药学院,广西南宁530021;2广西中医药大学附属国际壮医医院科技部,广西南宁530201;3广西医科大学第一附属医院药学部,广西南宁530021)
血管内皮细胞(vascular endothelial cells,VECs)是一层位于血管壁内侧的扁平单层细胞。正常生理情况下,VECs 通过调节血流与血管壁之间的物质交换维持着血管内环境稳态;在血管损伤,机械损伤,及氧化型低密度脂蛋白(oxidized low-density lipoprotein,Ox-LDL)、活性氧、促炎细胞因子和高水平的一氧化氮(nitric oxide,NO)等生物活性因子的刺激作用下,VECs 的通透性发生改变,导致炎症细胞入侵和血管壁脂质沉积,从而导致血管壁增厚与管腔狭窄。Ox-LDL 是一种动脉粥样硬化的促进因子,它可与内皮细胞表面的LOX-1 受体结合以诱发氧化连接反应导致胆固醇沉积,从而引起细胞凋亡[1]。VECs凋亡在动脉粥样硬化(atherosclerosis,AS)等血管生成性疾病的发病机制中发挥着重要作用[2]。
微小RNA(microRNA,miRNA,miR)是一类含有19~22 个核苷酸(nucleotide,nt)的高度保守的非编码单链小分子 RNA[3]。新近研究显示,miRNA 逐渐成为血管生成性疾病相关内皮细胞调亡的重要调控因子,如miR126-3p 高表达可以抑制HLMVEC 的增殖、促进其凋亡,使血管生成所阻[4];miR-106b 可通过调节PTEN 的表达激活PI3K/AKT 通路,促进HAEC 增殖,抑制其凋亡[5]。我们的前期研究证实,来自内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)第4 内含子中的27 碱基重复序列转录的RNA(27nt-miRNA,27nt-miR)高表达可显著抑制人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)的增殖、迁移和血管生成,这与27nt-miR 抑制eNOS 的表达/活性及其代谢产物NO的合成与释放相关[6]。由于NO 不仅是维持血管舒张功能的重要因子,而且参与内皮细胞的增殖、迁移和凋亡的调节[7],故推测 27nt-miR 可通过对相关凋亡基因的调控,参与VECs增殖、迁移与凋亡的调节。为证实上述推测,本研究通过建立体外Ox-LDL 诱导HUVECs 凋亡模型 ,探 讨 27nt-miR 对 Ox-LDL 诱 导HUVECs 凋亡的影响以及作用机制,为AS 等慢性心血管疾病的治疗提供参考资料。
材料和方法
1 主要试剂和仪器
HUVECs(Procell);DMEM培养液(Gibco);胎牛血清(Lonsera);慢病毒载体(上海吉凯基因化学技术有限公司);氧化低密度脂蛋白(广州奕元生物技术公司);CCK-8(武汉博士德生物技术公司);Hoechst 33258 染色试剂盒和caspase-3 活性检测试剂盒(上海碧云天生物技术有限公司);Annexin V-APC/7-AAD 凋亡检测试剂盒(杭州联科生物技术股份有限公司);TRIzol 试剂盒(Axygen);逆转录试剂盒和SYBR RT-qPCR 试剂盒(TaKaRa);兔抗 Bcl-2 抗体、兔抗 Bax 抗体、兔抗 caspase-3 抗体、兔抗 GAPDH 抗体及抗兔lgG(H+L)荧光II 抗(Cell Signaling Technology)。实时荧光定量 PCR 仪(Applied Biosystems);倒置相差荧光显微镜(Olympus)。
2 方法
2.1 27 nt-miR 慢病毒载体的构建和鉴定 委托上海吉凯基因化学技术有限公司以27nt-miR 序列(5′-GUCAUCAGUCGAGCUAGACGAG-3′)设计27nt-miR高表达慢病毒载体,然后以其反义序列及阴性对照随机序列构建anti-27nt-miR 和miR-NC 慢病毒载体。以 Ubi-MCS-SV40-EGFP-IRES-Puromycin 为载体,经AgeI/NheI 双酶切,转染293T 细胞,浓缩得到目的慢病毒载体。病毒载体上含有绿色荧光蛋白和嘌呤霉素抗性蛋白,可观察绿色荧光表达并用嘌呤霉素筛选得到稳定细胞株。
2.2 HUVECs 慢病毒质粒转染和实验分组 取对数生长期细胞,以细胞密度为5×107/L,按每孔2 mL将细胞悬液接种于6 孔板,孵育过夜至细胞贴壁。上述3 种慢病毒载体以感染指数(multiplicity of infection,MOI)=70 感染HUVECs,置于培养箱中转染10 h 后更换新鲜完全培养液。参考 Zhang 等[5]的方法,实验分为5 组:(1)正常对照组;(2)Ox-LDL 组;(3) 27nt-miR+Ox-LDL 组 ;(4) anti-27nt-miR+Ox-LDL 组;(5)miR-NC+Ox-LDL 组。除正常对照组正常培养外,Ox-LDL 组给予40 mg/L Ox-LDL 处理48 h诱导细胞凋亡,其余转染组细胞均先转染相应慢病毒质粒继而给予40 mg/L Ox-LDL 处理48 h 诱导细胞凋亡。
2.3 CCK-8 法检测 HUVECs 活力 参考蔡爽等[8]的方法,将各组细胞接种到96孔板中,每孔5×103个,每组设置3 个复孔,待细胞贴壁后按设定实验条件处理,每孔加入110 μL CCK-8 试剂(100 μL 培养液+10 μL CCK-8),避光孵育 1 h 后,酶标仪检测 450 nm 波长处各组的吸光度(A450),实验重复3 次。细胞活力(%)=(实验组A450值-调零组A450值)/(空白组A450值-调零组A450值)×100%。
2.4 划痕法检测HUVECs 的迁移能力 参考沈凤等[9]的方法,将各组细胞接种于 48 孔板中,每孔 3×104个,每组设置3 个复孔,培养细胞至密度100%融合,用吸头垂直各孔底部中间划“一”字痕,PBS 冲洗3次,然后加入含40 mg/L Ox-LDL的无血清培养液继续培养,于显微镜下观察0 h 和24 h 的迁移愈合情况,实验重复3 次。迁移率(%)=(0 h 划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
2.5 caspase-3 活性试剂盒检测caspase-3 活性 参考Chen等[10]的方法,取各组细胞接种于6孔板中,每孔2×105个,每组设置3个复孔,培养箱中培养至细胞贴壁后,加入含40 mg/L Ox-LDL 的无血清培养液2 mL 继续培养48 h。收集并冰浴裂解各组细胞,取上清液 50 μL,加入 40 μL 检测液和 10 μL Ac-DEVD-pNA,避光孵育2 h,酶标仪检测405 nm 波长处各组的吸光度(A405),实验重复3次。
2.6 Hoechst 33258 染色法检测HUVECs 的凋亡情况 参考李松岩等[11]的方法,取无菌盖玻片置于6孔板内,将各组细胞以每孔5×104个接种于玻片上,待细胞生长至密度为70%时,每组分别加入40 mg/L的Ox-LDL 刺激48 h,弃去培养液,加入0.5 mL 固定液 10 min。PBS 洗涤 3 次,加入染色液 5 min,PBS 洗涤3 次。将荧光淬灭封片液滴于载玻片上,盖上盖玻片。荧光显微镜下随机拍取5 个不同的视野,计算细胞凋亡率,实验重复3 次。细胞凋亡率(%)=视野内细胞凋亡数/视野内总细胞数×100%
2.7 流式细胞术检测各组HUVECs 的凋亡率 参考蔡爽等[8]的方法,取各组细胞接种于6 孔板中,每孔 2×105个,待细胞贴壁后给予 40 mg/L 的 Ox-LDL 处理48 h。收集细胞并清洗。取500 μL上样缓冲液重悬细胞。每管依次加入5 μL Annexin V-APC 和5 μL 7-AAD,轻柔混匀后,室温避光孵育15 min,利用流式细胞仪检测细胞凋亡率,实验重复3次。
2.8 RT-qPCR 法检测 HUVECs 中 Bcl-2、Bax和caspase-3的mRNA表达情况 用Trizol试剂盒提取各组细胞总RNA。委托上海生工生物工程设计、合成目标引物,序列见表1。分别取各组细胞总RNA 1 μg,根据逆转录试剂盒说明书进行逆转录合成cDNA,以cDNA 为模板,按SYBR RT-qPCR 试剂盒说明书加入反应体系,上机检测。每个样本重复测定3 次,取平均值,以 GAPDH 为内参照,采用 2-ΔΔCt法进行数据分析。反应条件:95℃ 10 min;95℃ 15 s,60℃ 30 s,72℃ 45 s,40 个循环;最后 72℃延伸 5 min,终止反应。
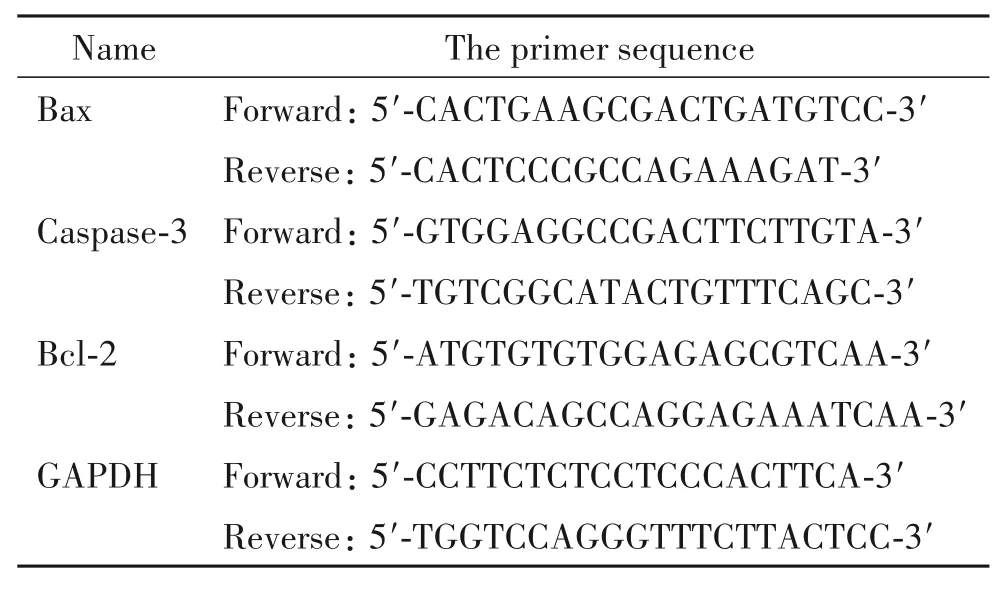
表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
2.9 Western blot 法 检测 HUVECs 中 Bcl-2、Bax 和caspase-3 蛋白表达情况 收集并裂解各组细胞,取上清液,BCA 法检测蛋白浓度。分别取40 μg蛋白进行SDS-PAGE、转膜,分别加入相应Ⅰ抗稀释液(稀释比例1∶1 000),4℃孵育过夜。次日加入荧光Ⅱ抗(稀释比例1∶10 000)室温避光孵育1 h。利用LICOR 公司的Odyssey 红外荧光扫描成像系统分析蛋白电泳条带灰度值,以GAPDH 为内参照。蛋白相对表达量=目的蛋白灰度值/GAPDH 灰度值。实验重复3次。
3 统计学处理
采用SPSS 25.0统计软件分析实验数据,数据均以均数±标准差(mean±SD)表示。单因素方差分析用于多组间比较,LSD-t检验用于组间两两比较。以P<0.05为差异有统计学意义。
结 果
1 27nt-miR 对 Ox-LDL 诱导的 HUVECs 活力的影响
与正常对照组相比,Ox-LDL 组细胞活力显著降低(P<0.05);与miR-NC+Ox-LDL 组相比,27nt-miR+Ox-LDL 组细胞活力显著降低(P<0.05),而anti-27ntmiR+Ox-LDL组细胞活力显著升高(P<0.05),见图1。

Figure 1.27nt-miR inhibited the viability of HUVECs.Mean±SD. n=3.*P<0.05 vs normal control group;#P<0.05 vs miR-NC+Ox-LDL group.图1 27nt-miR抑制HUVECs活力
2 27nt-miR 对 Ox-LDL 诱导的 HUVECs 迁移能力的影响
与正常对照组相比,Ox-LDL 组HUVECs 迁移率降低(P<0.05);与 miR-NC+Ox-LDL 组相比,27ntmiR+Ox-LDL 组HUVECs 迁移率显著降低(P<0.05),而anti-27nt-miR+Ox-LDL 组HUVECs 迁移率显著升高(P<0.05),见图2。
3 27nt-miR 对 Ox-LDL 诱 导 的 HUVECs 中 cas⁃pase-3活性的影响
与正常对照组相比,Ox-LDL 组HUVECs 内caspase-3 相对活性升高(P<0.05);与miR-NC+Ox-LDL组相比,27nt-miR+Ox-LDL 组 HUVECs 内 caspase-3的相对活性显著升高(P<0.05),而anti-27nt-miR+Ox-LDL 组 HUVECs 内 caspase-3 的相对活性显著降低(P<0.05),见图3。
4 27nt-miR对Ox-LDL诱导HUVECs凋亡的影响
Ox-LDL 组HUVECs 的凋亡率显著高于正常对照组(P<0.05);与 miR-NC+Ox-LDL 组相比,27ntmiR+Ox-LDL 组HUVECs 的凋亡率升高(P<0.05),而anti-27nt-miR+Ox-LDL 组HUVECs 的凋亡率降低(P<0.05),见图4。
5 27nt-miR 对 Ox-LDL 诱导的 HUVECs 凋亡率的影响
与正常对照组相比,Ox-LDL 组HUVECs 的凋亡率显著升高(P<0.05);与miR-NC+Ox-LDL 组相比,27nt-miR+Ox-LDL 组HUVECs 的凋亡率显著升高(P<0.05),而anti-27nt-miR+Ox-LDL组HUVECs的凋亡率显著降低(P<0.05),见图5。
6 27nt-miR 对 Bax、caspase-3和Bcl-2 mRNA 表达的影响
与正常对照组相比,Ox-LDL 组Bax 和caspase-3 mRNA 的相对表达量显著升高(P<0.05),而 Bcl-2 mRNA 的相对表达量和Bcl-2/Bax 的mRNA 表达比例显著降低(P<0.05);与 miR-NC+Ox-LDL 组相比,27nt-miR+Ox-LDL 组 Bax和caspase-3 mRNA 的 相 对表达量显著升高(P<0.05),Bcl-2 mRNA的相对表达量和Bcl-2/Bax 的mRNA 表达比例显著降低(P<0.05),而 anti-27nt-miR+Ox-LDL 组 Bax和caspase-3的 mRNA 相对表达量显著降低(P<0.05),Bcl-2 mRNA 的相对表达量和Bcl-2/Bax 的mRNA 表达比例显著升高(P<0.05),见图6。
7 27nt-miR 对 Bax、caspase-3和Bcl-2 蛋白表达的影响
Ox-LDL组Bax和caspase-3蛋白表达水平高于正常对照组(P<0.05),而Bcl-2 蛋白表达水平和Bcl-2/Bax 蛋白表达比例低于正常对照组(P<0.05);27ntmiR+Ox-LDL 组 Bax和caspase-3 蛋白表达水平较miR-NC+Ox-LDL 组上调(P<0.05),Bcl-2 蛋白表达水平和 Bcl-2/Bax 蛋白表达比例下调(P<0.05);而anti-27nt-miR+Ox-LDL 组 Bax和caspase-3 蛋 白 表 达水平较 miR-NC+Ox-LDL 组下调(P<0.05),Bcl-2 蛋白表达水平和Bcl-2/Bax 蛋白表达比例上调(P<0.05),见图7。
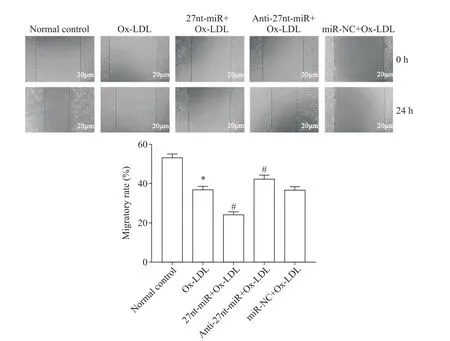
Figure 2.27nt-miR inhibited the migration of HUVECs.The scale bar=20 μm.Mean±SD. n=3.*P<0.05 vs normal control group;#P<0.05 vs miR-NC+Ox-LDL group.图2 27nt-miR抑制HUVECs的迁移

Figure 3.27nt-miR increased the activity of caspase-3 in the HUVECs.Mean±SD. n=3.*P<0.05 vs normal control group;#P<0.05 vs miR-NC+Ox-LDL group图3 27nt-miR增强HUVECs内caspase-3活性
讨 论
本实验通过研究27nt-miR 对Ox-LDL 诱导的HUVECs 凋亡的影响及相关分子机制,得到结果如下:(1)27nt-miR 可促进Ox-LDL 诱导的内皮细胞凋亡;(2)27nt-miR 促进Ox-LDL 诱导的内皮细胞凋亡的同时,抑制细胞的活力和迁移;(3)27nt-miR 通过促进Ox-LDL诱导的Bax和caspase-3表达上调及Bcl-2表达下调参与细胞凋亡进程。
内皮细胞凋亡可破坏内皮完整性和屏障功能,引起炎性细胞浸润,脂质转运和新内膜形成,促进脂质沉积,导致AS等血管疾病的发生发展[12]。Ox-LDL是引发和促进AS 等心血管疾病发生发展的危险因素之一,它可诱导内皮细胞凋亡。研究表明,正常生理条件下,低浓度的Ox-LDL 促进内皮细胞增殖,在维持血管壁环境稳态中起重要作用,而高浓度的Ox-LDL 则可引发内皮细胞凋亡或坏死[1]。研究表明,Ox-LDL 可通过调控PI3K/Akt 信号通路诱导内皮祖细胞凋亡,引起组织缺血和血管形成受损,加重冠状动脉进程[13]。本实验中,观察到使用 Ox-LDL 刺激HUVECs 后细胞的凋亡率显著上升,细胞活力和迁移率显著下降,提示Ox-LDL 对HUVECs 具有明显的凋亡诱导作用。
内皮细胞的异常凋亡、增殖和迁移是AS 等心血管疾病发展中的重要致病事件[14]。miRNA 作为基因转录调控分子,通过调节内皮细胞的增殖、迁移和凋亡参与心血管疾病的发生发展[15]。例如,miR-200c-3p 通过结合锌指结合E-box 的同源盒2,抑制血管紧张素Ⅱ诱导的大鼠肾动脉内皮细胞增殖和迁移,减轻高血压性肾损伤[16]。miR-345-3p 在 Ox-LDL 诱导的HUVECs 凋亡过程中表达下调,其通过靶向TRAF6抑制Ox-LDL 诱导的细胞凋亡和炎症反应,减缓 AS 的发展[17]。miR-497 在 AS 模型鼠和 Ox-LDL 诱导HUVECs凋亡过程中均表达上调,其通过调控Bcl-2/Bax-caspase-9-caspase-3 途径抑制细胞增殖,诱导细胞凋亡,加重AS 炎症程度[18]。本课题组前期研究表明,27nt-miR 参与调节VECs 的增殖、迁移和管腔形成,并抑制哺乳动物雷帕酶素靶蛋白诱导的VSMCs 凋亡[19]。在本实验中,我们通过将 27nt-miR高表达与anti-27nt-miR 慢病毒质粒转染入HUVECs,之后用Ox-LDL刺激HUVECs,结果显示,27nt-miR 高表达可显著提高内皮细胞的凋亡率,与此同时内皮细胞的增殖速度与迁移能力显著降低,而抑制27ntmiR 表达则可以部分缓解Ox-LDL 诱导的细胞凋亡和增殖、迁移抑制。这一结果提示27nt-miR 可促进Ox-LDL 诱导的 HUVECs 凋亡,并且抑制 HUVECs 增殖和迁移。
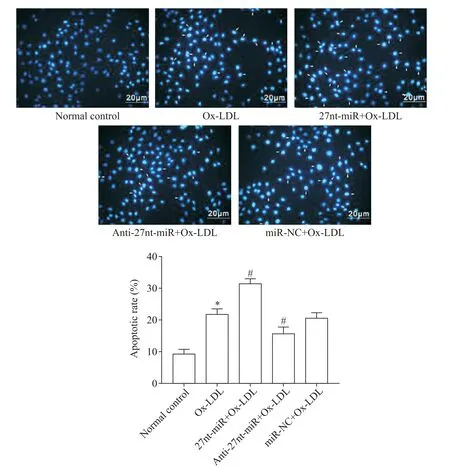
Figure 4.27nt-miR promoted the apoptosis of HUVECs induced by Ox-LDL.The apoptosis was detected by Hoechst 33258 staining.The scale bar=20 μm.Mean±SD. n=3.*P<0.05 vs normal control group;#P<0.05 vs miR-NC+Ox-LDL group.图4 27nt-miR促进Ox-LDL诱导的HUVECs凋亡
Bcl-2 是一种抗凋亡蛋白,可以通过抑制线粒体细胞色素C的释放,激活下联caspase级联反应,或作为抗氧化剂防止多种刺激诱导的细胞凋亡[20]。Bax是Bcl-2 同源的水溶性相关蛋白,凋亡发生时,Bax从细胞质转移至线粒体,Bax 蛋白被激活,诱导线粒体膜电位降低,促使线粒体释放细胞色素C,激活半胱氨酸蛋白酶caspase-9,继而活化下游效应蛋白caspase-3,从而诱导细胞凋亡[21]。caspase-3作为半胱氨酸蛋白酶家族一员,是细胞凋亡蛋白级联反应中的下游关键蛋白,被认为是凋亡中的关键调节因子。因此,caspase-3 活性是凋亡过程主要的指标。本研究结果显示,27nt-miR 高表达可负调控Bcl-2 蛋白表达水平,促进Bax 和caspase-3 的蛋白表达,增强caspase-3 活性,而抑制27nt-miR 表达则表现出相反的趋势。因此,我们推测27nt-miR 可能通过调控凋亡相关蛋白 caspase-3、Bax和Bcl-2 的表达,影响 Ox-LDL 诱导内皮细胞凋亡的进程。此外,值得注意的是,多数miRNAs在基因转录水平通过抑制翻译或促进RNA 降解调控靶基因表达,例如miR-338-3p 通过靶向抑制AMBI的mRNA 3'非翻译区抑制其表达,促进Ox-LDL 诱导的内皮细胞凋亡[22]。因此,本研究进一步通过 qRT-PCR 检测各组 Bax、caspase-3和Bcl-2的mRNA 改变情况,结果显示,27nt-miR 高表达显著促 进 Bax和caspase-3 的 mRNA 表 达 ,而 Bcl-2 的mRNA 表达和Bcl-2/Bax 比例均显著降低。这提示27nt-miR 在基因转录水平参与了 Bax、caspase-3 和Bcl-2 mRNA 的调控,进而影响了 Bax、caspase-3 和Bcl-2 的蛋白表达,最终参与Ox-LDL 诱导内皮细胞凋亡的进程。

Figure 5.27nt-miR promoted the apoptosis of HUVECs induced by Ox-LDL.The apoptosis was detected by flow cytometry.Mean±SD. n=3.*P<0.05 vs normal control group;#P<0.05 vs miR-NC+Ox-LDL group.图5 27nt-miR促进Ox-LDL诱导的HUVECs凋亡
综上所述,本研究初步明确27nt-miR 可促进Ox-LDL诱导的HUVECs凋亡,并抑制HUVECs的活力和迁移,这与27nt-miR 调控凋亡相关蛋白Bax、caspase-3和Bcl-2表达有关。
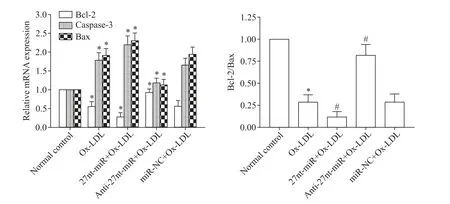
Figure 6.27nt-miR up-regulated the mRNA expression levels of Bax and caspase-3 and down-regulated the mRNA expression level of Bcl-2 in the HUVECs.Mean±SD. n=3.*P<0.05 vs normal control group;#P<0.05 vs miR-NC+Ox-LDL group.图6 27nt-miR上调HUVECs中Bax和caspase-3 mRNA表达水平,下调Bcl-2 mRNA表达水平
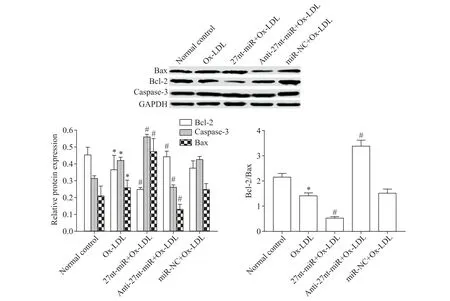
Figure 7.27nt-miR up-regulated the protein expression levels of Bax and caspase-3 and down-regulated the protein expression level of Bcl-2 in the HUVECs.Mean±SD. n=3.*P<0.05 vs normal control group;#P<0.05 vs miR-NC+Ox-LDL group.图7 27nt-miR上调HUVECs中Bax和caspase-3蛋白表达水平,下调Bcl-2蛋白表达水平
